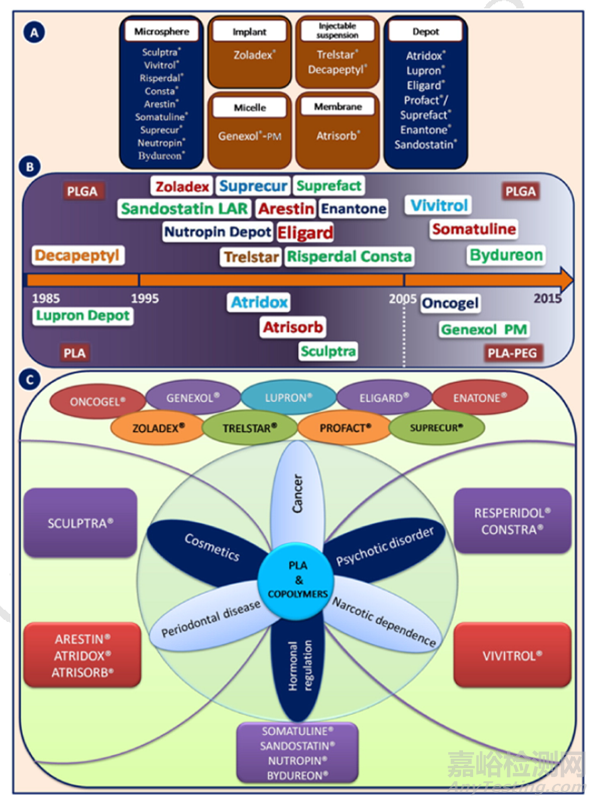
图1: PLA/PLGA的给药系统进展示意
FDA批准的第一个长效注射剂是基于PLA/PLGA递送系统的醋酸亮丙瑞林(商品:LUPRON),目前已经可提供 6 个月的API的duration。实际上,第一款基于该聚合物体系的上市产品是1986年欧盟批准的的醋酸曲普瑞林(商品:DECAPETYL)。
在美国市场推出的首款醋酸亮丙瑞林的duration是1个月(目前有1/3/4/6月产品),尽管其专利覆盖范围已经到期,但是LUPRON上市后30多年后的今天,FDA尚未有批准醋酸亮丙瑞林的仿制产品上市。LUPRON作为现在长效释放产品老大哥的地位不容撼动,从侧面反映出基于PLGA聚合物产品的复杂性。
表1: LUPRON--- FDA批准的第一个长效注射剂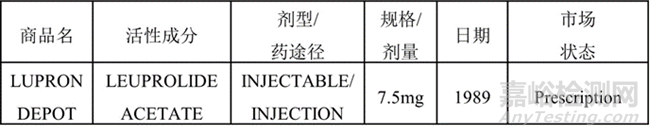
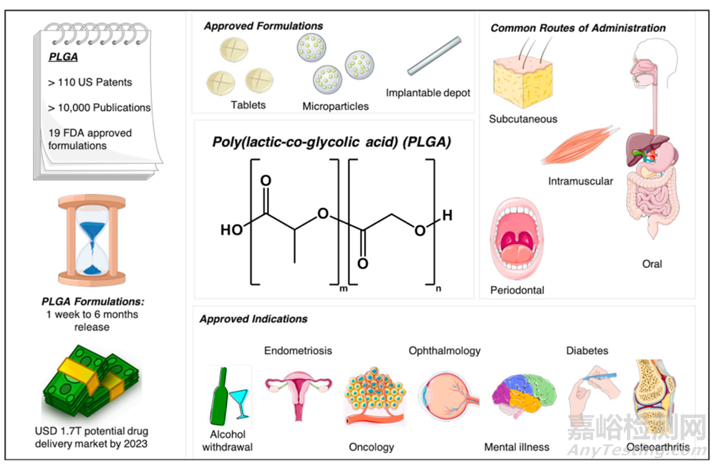
长效控释制剂具有调节药物释放、保护API避免提前失活、无需重复给药和提高患者依从性等优点。控释途径(口服、注射、透皮、植入)制剂形式有微/纳米球、凝胶、薄膜和丸剂。可注射的微球是这些形式中最受欢迎的制剂形式。大多数上市的长效注射剂配方由聚合材料组成,其中PLGA占有该类产品的半壁江山。
那么PLGA是何方神圣呢?
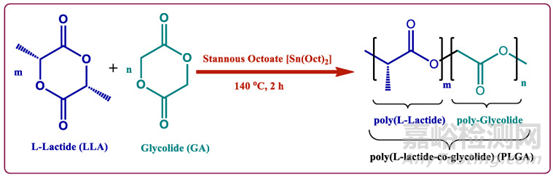
图2:PLGA合成示意图
PLGA(poly(lactic-co-glycolic acid),PLGA)(聚乳酸-羟基乙酸共聚物)是PLA(Poly(lactic acid))(聚乳酸)家族成员,PLA/PLGA目前是经FDA批准用于药物载体研究的明星聚合物。PLGA体内分解单体乳酸进入三羧酸循环,而乙醇酸由肾脏排泄或由三羧酸循环代谢而消除。
图3:PLA/PLGA临床使用产品
开发基于PLGA的长效产品有哪些困难呢?
长效产品首先应满足缓释效果,不能出现爆发释放或者延迟不释放的问题。延迟不释放药物达不到功效,爆发释放会造成一系列问题。比如,呕吐等不良反应随着艾塞那肽(商品名:BYDUREON)爆发释放率的增加而增加。零级释放动力学是理想的目标,即药物释放速率与其在释放介质中的溶解浓度无关,并且随着时间的推移以恒定的速率输送。而且,体外实验很难模拟体内实际的释放效果(仿制药生物等效性证明困难)。
仿制药制造商要想在ANDA获批,则其必须证明(基于PLGA的长效仿制药)产品在药学、治疗学和生物学上与达到参考上市药物(RLD)等效(这个过程一般需要2,000-5,000剂量的RLD,由于RLD供应和制药商的商业化策略而往往受限,这又成为仿制药成功的一大障碍)。仿制药产品应具有与RLD相同的原料药、剂型、强度、给药途径、原料药吸收率、安全性和疗效。
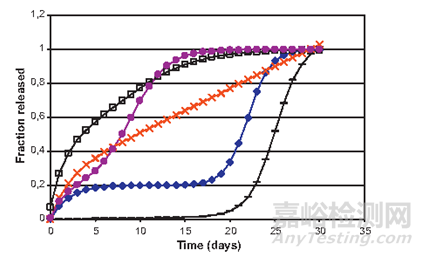
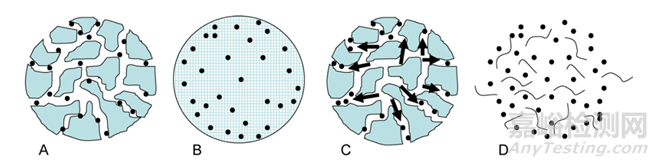
针对药物释放,一般而言,基于PLGA的药物表现出三种释放模式:突释、缓释和二次突释。
一份研究有显示醋酸亮丙瑞林RLD初始释放百分比在40%左右(推测原因可能是:药物附于载体表面/孔道中),然后发挥出持续释放效果(见下文)(推测原因可能是:PLGA降解和微粒形态变化,表皮变得致密)。药物长效释放过程真的是这么简单吗?
经典释放曲线第一阶段为突释(表面上的未包封药物颗粒或靠近表面的药物分子易于通过水合作用进入)。爆发释放的其他原因也可能是裂缝的形成和颗粒的分解。第二阶段通常是缓慢释放阶段,药物缓慢扩散,同时聚合物降解和水合进行。第三阶段(第二次爆发)通常是快速释放期(侵蚀的开始)。
图4:不同释放曲线示例
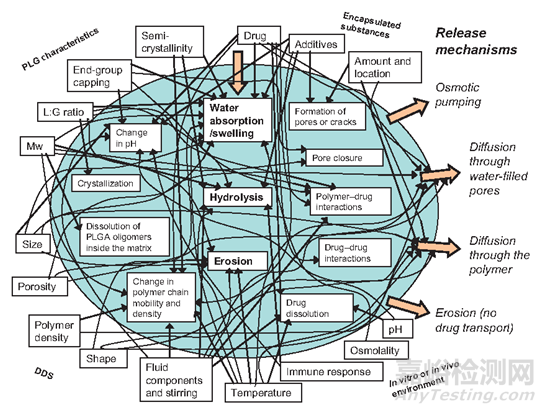
我们来着重看下PLGA长效药物涉及到的释放机制。
图5:药品释放机制图示
首先,我们看下基于PLGA的药物传输系统中发生的具体物理化学过程。
聚合物进入人体后,水会首先被吸收进空隙中并随之产生了允许药物释放的网络。聚合物遇水则会发生酯键的水解断裂,伴随着分子量的降低和酸性水解产物出现。分子量的降低会导致疏水性的降低而进一步促进水的吸收(低聚物分子量在1100Da时候会变成水溶性),酸性产物则会导致自催化水解现象的发生(PLGA降解产物引起的炎症会进一步促进其降解)。以上现象造就了后面侵蚀现象发生,药物开始更加快速地释放(二次爆发)。总结一下:即疏水性、高分子量和缓慢降解的PLGA最终将变成更亲水性、低分子量和快速降解的PLGA。
图6:基于PLGA的药物传输系统中药物释放的物理化学过程
那么,有哪些因素影响PLGA物理化学行为呢?
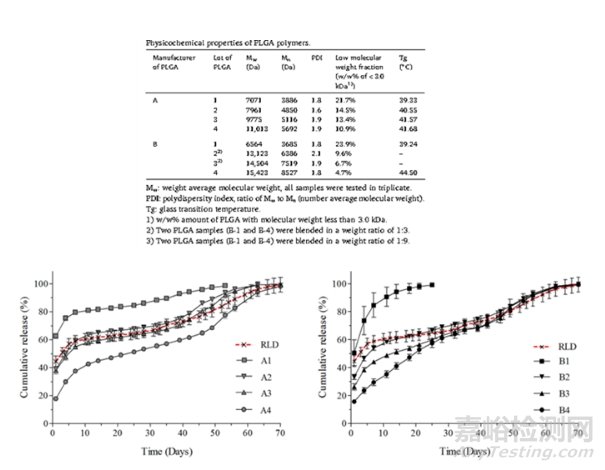
一般来说,大量药品从微球中不受控制的爆发释放可能导致不良的副作用和毒性。既然是人工合成的聚合物,那么单体乳酸和羟基乙酸的随机聚合必然会影响终产物PLGA的性质。Ochi M et al., 发表的一份《PLGA分子量分布对亮丙瑞林微球释放的影响》的研究表明,亮丙瑞林的释放不仅依赖于PLGA的分子量,还依赖于PLGA的重量分布。
图7:不同PLGA对亮丙瑞林微球释放的影响
理论上,分子量较高的PLGA需要更多时间水解为低聚物(其中,粒径小微粒扩散直径短吸水速率高,很明显,具有较高孔隙率的制剂利于水进入加速聚合物降解而释放药物分子),因此应该具有较慢的降解速率和释放动力学,但由于药物分布不均与而具有更高的爆发释放。单体比例为50:50的PLGA具有最快的生物降解速率(50-60天)。单体羟基乙酸亲水,比例高的PLGA具有较高的水合率;比例低则药物释放速率较慢。
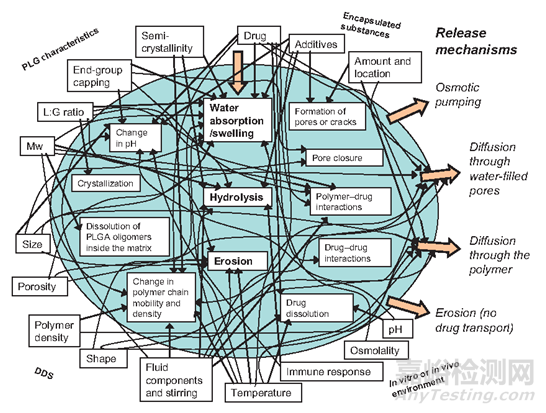
实际上,除此之外,包括释放环境如酸碱度在内的多种因素会影响微球药物的释放。
图8:影响药物从PLGA基质中释放的因素
微球的稳定性与聚合物链的玻璃转化温度(Tg)有关。微球在在低于Tg温度时候聚合物链的流动性较低利于其保存。载药PLGA微球的Tg范围为30~60℃(体液进入微球会进一步降低Tg值),PLGA微球在体内药物释放环境中可以发生玻璃化转变。玻璃转化温度较低的配方可以增加PLGA链的柔韧性而增加水渗透而增加药物释放。微球物理化学性质的变化会影响药物释放速率。
药物本身和添加的辅料可能会影响上面列出的许多过程。
一份研究研究显示了氨基酸的稳定作用(水溶液稳定性),包括脯氨酸、赖氨酸和苯丙氨酸,显著提高了艾塞那肽的水稳定性(氨基酸可能通过优先相互作用来稳定肽。脯氨酸可以形成两亲性超分子组装体,防止蛋白质聚集。疏水性芳香族氨基酸苯丙氨酸往往存在于疏水性内部或肽的跨膜片段中。在这样的位置上,它可以在肽稳定中发挥多种作用)。这些氨基酸的效果相对不如非离子表面活性剂泊洛沙姆188和蔗糖。水溶性添加剂中泊洛沙姆188的效果最好(可以降低表面张力,诱导肽在空气/水界面的吸附减少,从而减少二级结构的变化和肽的不稳定)。糖类中蔗糖和海藻糖是蛋白类产品(单抗、多抗和ADC)中常见的稳定剂,它通过水替代和玻璃化作用产生保护作用。本实验中蔗糖是在冻融和冻干的实验中表现最好且具有提高包封率效果。
表2:各种添加剂对艾塞那肽(商品名:BYDUREON)稳定性的影响。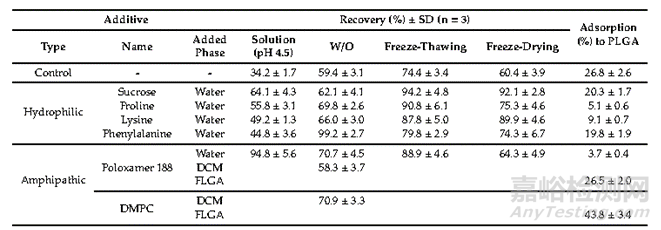
N-甲基吡咯烷酮(NMP)为两性溶剂(同时溶解亲水性的生物大分子药物和亲油性的高分子材料)。根据美国药典NMP的最大日暴露量为376mg,最大剂量浓度为0.63mg/mg/每单位剂量。当然,该剂量非定值会随时更新。
表3:美国药典登记NMP最大剂量
由于酸性PLGA降解产物的存在,蛋白质降解可以通过调整PLGA聚合物的特性来延迟降解,或者通过在配方中掺入碱性盐来中和酸性环境。
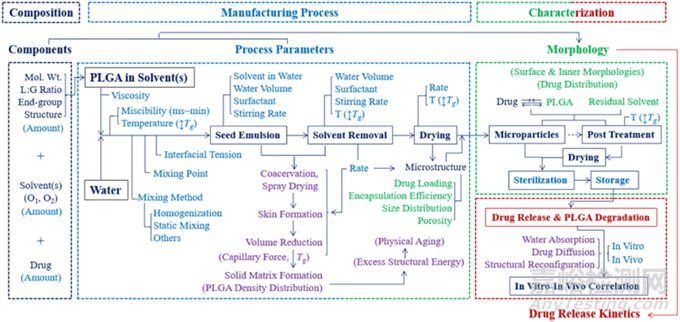
开发基于PLGA的长效配方技术壁垒较高,无菌制备工艺在内诸多要点需要控制。
图9:PLGA微粒的制造流程图(乳化法)以及影响配方性能的参数
PLGA在药物递送中具有广阔前景,并广泛用于蛋白类产品的给药。Nutropin Depot 是唯一被批准用于递送蛋白质生长激素的PLGA产品,但由于技术原因已经停产。除了包含利培酮(RISPERDAL CONSTA)、纳曲酮(VIVITROL)、盐酸米诺环素(ARESTIN)几款产品外,大都为多肽或蛋白类药物。
表4:FDA批准上市的基于PLA/PLGA产品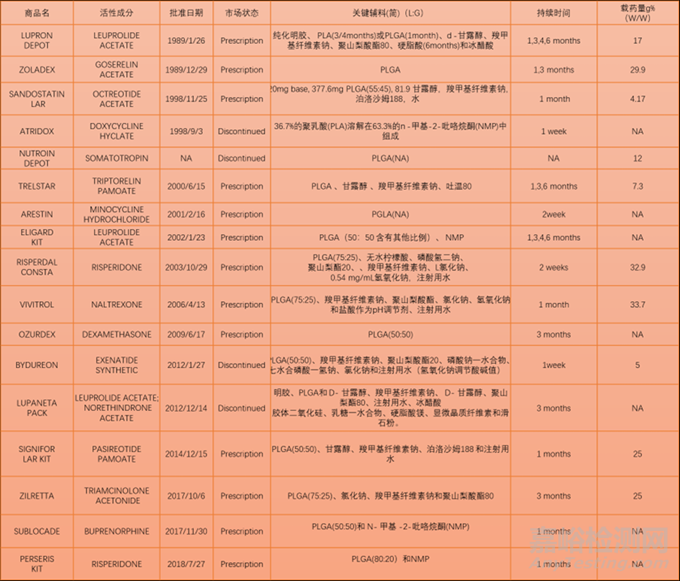
PLGA水解的酸性环境实际上不利于蛋白类产品的稳定,上面提到配方中的酸碱调节辅料体系在一定程度上具有缓冲作用。
目前,PLGA被广泛用于包括在小分子、核酸和蛋白在内的药物递送系统。尽管首款基于PLGA的产品已经上市三十年有余,目前基于该聚合物体系的产品仅有二十多款成功上市。学术界、工业界和监管机构尚有很大空间来开展研究和制定规则,以解决众多悬而未决的问题。
Reference
1. https://doi.org/10.1016/j.jconrel.2020.01.050
2. https://doi.org/10.1016/j.addr.2016.07.002
3. https://doi.org/10.1016/j.ijpharm.2021.120450
4. https://doi.org/10.1016%2Fj.jconrel.2020.10.044
5. https://doi.org/10.1016/j.ijpharm.2011.05.049
6. https://doi.org/10.3390/pharmaceutics11120627