您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-08-21 09:37
阿尔茨海默病(Alzheimer’s disease, AD)是一种进展性神经退行性疾病,其特征是在大脑皮层和海马区域出现淀粉样斑块和神经纤维缠结(NFT),这是该疾病的主要病理标志。因此,与淀粉样斑块相关的Aβ和与神经纤维缠结相关的tau是AD的指示性生物标志物。AD常见的症状包括记忆丧失、学习能力受损以及智力和思维能力下降。AD潜在发生机制包括活性氧或氧化应激、线粒体功能障碍、胆碱能功能障碍、神经炎症、葡萄糖代谢障碍以及最重要的胰岛素信号通路失调或胰岛素抵抗。因此,通过影响以上路径可能减少AD相关的症状,并延缓神经退行性过程和疾病进展。能够模拟以上机制(氧化应激、线粒体功能障碍、胆碱能功能障碍、神经炎症和胰岛素抵抗)的动物模型适合用于寻找新的治疗干预措施和针对AD的药物治疗。
目前批准的药物要么是乙酰胆碱酯酶抑制剂(如利斯的明、多奈哌齐和加兰他敏),要么是NMDA受体拮抗剂(如美金刚)。然而,这些药物只能提供有限的症状缓解,无法阻止AD的进展。在过去四十年中,针对AD识别出的许多新分子通过防止大脑中淀粉样沉积和清除现有淀粉样斑块以及其他与疾病相关的已知机制发挥作用。尽管这些化合物在临床前AD模型中显示出有希望的数据,但AD治疗的临床失败率接近100%。尽管导致失败的因素很多,但主要问题仍然与药物开发阶段使用的临床前模型有关。临床前药效数据和临床疗效之间存在差距。所以,临床前对AD候选药物的评估存在缺陷和不完整,可能是这些分子在临床试验中失败的原因。
此外,基于淀粉样假说和AD的遗传学,对具有淀粉样斑块和tau蛋白靶点的转基因AD模型的依赖不断增加。然而,小鼠大脑产生的淀粉样肽与人脑不同,即使小鼠模型出现淀粉样沉积,也常常无法表现出显著的神经元丢失。尽管临床前AD模型存在许多局限性,但这些模型还是可以在某种程度上预测病理生理学。为了模拟人类AD的发病机制,3XTg-AD和5XFAD转基因小鼠模型是目前在AD治疗研究中主要使用的动物模型。AD的动物模型还包括脑室内注射链脲佐菌素(ICV-STZ)、淀粉样β蛋白诱导、秋水仙碱诱导等模型,这些模型主要关注认知衰退和痴呆等参数。下面具体看下AD动物模型的优缺点。
经中枢给药的化合物诱导模型
ICV-STZ诱导的模型
AD的发生与代谢相关。在代谢因素中,葡萄糖代谢受损和能量利用障碍在疾病早期阶段就已出现。通过脑室内注射(intracerebroventricular, ICV)链脲佐菌素(streptozotocin, STZ)诱导胰岛素信号传导受损是一种广泛使用的动物模型。
大脑的皮层、海马、下丘脑、嗅球等区域存在大量的胰岛素受体。研究显示,在ICV-STZ诱导的胰岛素抵抗影响下,胰岛素、胰岛素受体等表达下调。ICV-STZ模型还与氧化应激、线粒体功能障碍、胆碱能功能障碍和神经炎症等现象相关,这些因素被认为是神经退行性的触发点,并且与胰岛素抵抗密切相关。这些与ICV-STZ模型神经病理学相关的特征可能导致认知障碍和记忆受损,这也是验证散发性AD模型的有力依据。此外,胰岛素增敏剂二甲双胍可以减轻疾病病理,这表明胆碱能和胰岛素信号通路在ICV-STZ模型的AD中发挥了作用。
淀粉样蛋白诱导的模型
作为ICV-STZ的替代方法,可以通过脑室内或海马内注射淀粉样蛋白-β-42、淀粉样蛋白-β-40和淀粉样蛋白-β-25−30来诱导模型。这些淀粉样蛋白根据其所含氨基酸的数量被进一步分类,并且它们在AD的发病机制中具有不同程度的致病性,其中淀粉样蛋白-β-42的致病性最强。脑内注射β淀粉样蛋白已被证明可以驱动神经退行性过程,并导致学习和记忆障碍。由于β淀粉样蛋白的作用,活性氧过度产生。在淀粉样蛋白诱导的模型中,烟碱型乙酰胆碱受体的表达下调,从而导致胆碱能功能障碍。淀粉样蛋白还在转基因小鼠模型中发挥作用。此外,中枢注射淀粉样蛋白还会导致tau相关缠结的形成。通过氧化应激途径也可能引发线粒体功能障碍。目前,已有靶向淀粉样蛋白治疗AD的抗体获批上市。
经口给药的化合物诱导模型
秋水仙碱在临床上用于治疗痛风,它是一种从植物(秋水仙,Colchicum autumnale)中提取的天然化合物。秋水仙碱可以与微管蛋白结合,导致微管结构不稳定。通常通过口服途径给药。然而,当以15微克的剂量给大鼠口服时,会导致认知功能障碍。这种认知功能障碍与通过脑内注射诱导的散发性阿尔茨海默病相似。秋水仙碱会破坏氧化平衡和胆碱能通路,并加剧导致突触功能障碍和神经退行性的神经炎症通路。在秋水仙碱诱导的模型中,COX-2、PGE2、IL-1β和TNF-α可能是引发炎症反应的因子。此外,微管是轴突和神经元细胞骨架的核心组成部分,其显著恶化会导致神经元死亡。
经腹腔给药的化合物诱导模型
东莨菪碱诱导的模型
东莨菪碱是一种强效的抗胆碱能药物,提取自黑莨菪(Hyoscyamus niger)。它通常用于预防晕动症,以及手术后用于控制恶心和呕吐。东莨菪碱是一种毒蕈碱受体的竞争性抑制剂,可用于缓解许多与胆碱能相关的不适和副作用,例如增加的肠蠕动、唾液分泌、流泪、出汗等。乙酰胆碱是记忆处理过程中最重要的神经递质之一,通过增强突触连接发挥作用。因此,东莨菪碱介导的胆碱能神经阻断被广泛用作AD的动物模型。东莨菪碱通过增加乙酰胆碱酯酶(AChE)的活性,加速乙酰胆碱的分解。
在AD模型中,东莨菪碱的剂量约为2 mg/kg,通过腹腔注射给药。在此过程中,东莨菪碱会破坏多个脑区的连接性,例如空间记忆映射和功能网络。东莨菪碱诱导模型的优势在于避免了脑内注射模型(ICV模型)等复杂手术操作。此外,胆碱能药物如多奈哌齐和利斯的明以及抗氧化剂如褪黑素已被证明可以逆转东莨菪碱诱导的记忆障碍,这进一步证实了氧化应激途径的参与。因此,该模型主要用于开发AD治疗的预防性选择。
阿托品诱导的模型
阿托品也是一种生物碱类药物,提取自颠茄(Atropa belladonna),被用作抗胆碱能药物来治疗心动过缓和近视。与东莨菪碱类似,阿托品会侵入胆碱能通路,导致毒蕈碱型乙酰胆碱受体功能低下,并在一定程度上阻断烟碱型受体。阿托品以5 mg/kg的剂量通过腹腔注射给药,连续21天,可产生淀粉样斑块,这是AD的病理标志之一。这一过程可能是由于胆碱能通路与淀粉样蛋白生成之间的关联。此外,观察到乙酰胆碱的释放减少是由Aβ引起的,反之亦然。
氯化铝诱导的模型
铝是一种元素,过量会导致多种毒性。通过腹腔注射4 mg/kg或40 mL/kg的氯化铝,每天一次,持续约40天,可以在大鼠或小鼠中建立AD模型。氯化铝模型中的主要触发因素是氧化应激和线粒体功能障碍,可能是通过抑制电子传递链中的NADH脱氢酶实现的。此外,氯化铝模型中,神经炎症介质(包括iNOS、NF-κB、COX-2和促炎细胞因子)发生改变,导致神经退行性变。此外,1天内给予100 mg或5天内给予20 mg的铝盐也被发现可以诱导与AD相关的神经毒性。另外,铝盐还会导致胆碱能功能障碍和氧化应激,从而引发凋亡过程。该模型也常用于AD的预防性治疗研究。
经皮下给药的化合物诱导模型
D-半乳糖是一种单糖,存在于乳制品、鳄梨、甜菜等食物中。D-半乳糖的代谢会产生活性氧。
通过皮下注射D-半乳糖(剂量为50、100和200 mg/kg),在莫里斯水迷宫测试中,小鼠的逃避潜伏期增加;在新物体识别测试中,区分指数降低,且这种变化呈剂量依赖性。这表明D-半乳糖诱导的空间记忆和识别记忆受损。此外,D-半乳糖还会增加海马区的氧化应激。
有研究显示,D-半乳糖处理后免疫系统功能减弱,模拟了衰老大脑的特征。它还会抑制大脑海马区和齿状回区域的神经发生,并破坏皮层和海马区的钙稳态,从而产生类似于痴呆病例中的兴奋毒性条件。由于D-半乳糖是一种糖,其代谢会产生类似胰岛素抵抗的状态,因此该模型可用于研究与胰岛素抵抗相关的AD病例。
转基因模型
三转基因模型(Triple Transgenic Model)
三转基因模型是一种模拟家族性AD的遗传模型,涉及三个基因的突变,包括位于21号染色体的APP基因、位于14号染色体的早老素1(presenilin 1)基因以及小鼠中的p-tau基因,因此得名三转基因模型。这些基因的突变可能导致AD发病,因为APP与淀粉样斑块相关,tau与神经原纤维缠结相关,而早老素1是γ-分泌酶的蛋白水解亚单位(参与APP的裂解)。
该转基因模型表现出脑萎缩、突触破坏和神经元死亡,并且在前额叶皮层、海马和齿状回等区域无法再生神经元,从而导致认知能力下降和记忆障碍。在转基因小鼠中,空间记忆和识别记忆均被发现受损。除了认知障碍外,突变小鼠还报告了表型改变。
5XAD模型
5XAD是另一种家族性AD的转基因小鼠模型,表示有五个基因的突变。5XAD表达带有S-K670N、S-M671L、F-I716V和L-V717I突变基因的APP695。这些基因是小鼠中表达的APP突变类型,这些基因的突变导致AD病理。这些突变导致APP产生过多的老年斑。此外,该模型还表现出胶质增生、突触破坏和神经元死亡。与其它转基因模型相比,该模型更早地表现出AD的特征。然而,与三转基因模型相比,该模型中磷酸化tau病理较为少见。此外,该模型动物的皮层和海马脑区可见促炎细胞因子和免疫标志物,表明存在神经炎症和由凋亡引起的神经退行性变。
已上市的Aβ抗体Aducanumab和Lecanemab主要采用的Tg2576转基因小鼠开展的主要药效学评价,这类小鼠的特点是过度表达突变形式的APP (isoform 695),其中包含瑞典型突变 (KM670/671NL),导致Aβ水平升高,最终形成淀粉样斑块,与5XAD模型有些类似。
非化合物诱导、非转基因模型
老年大鼠模型
与年轻大鼠相比,老年大鼠自然地在海马、颞叶和新皮层中出现损伤,导致学习和记忆能力受损。由于该模型非侵入性,且能够模拟晚发性/老年性散发性AD的病理症状,比其他化学诱导的模型更受青睐。用于该模型的大鼠年龄范围通常在15到20个月之间。从疾病的临床角度来看,这种模型更具相关性。此外,由衰老引起的痴呆表现出神经炎症细胞因子、氧化应激、胰岛素抵抗和线粒体功能障碍。该模型还产生了与AD其他模型相当的淀粉样蛋白生成和tau病理。
高脂饮食诱导模型
高脂饮食被广泛用于构建胰岛素抵抗、肥胖和糖尿病的模型。然而,在最近的多项研究报告中,它也被推荐作为认知功能障碍模型。给大鼠或小鼠提供高脂饮食大约10到14周,可能在一定程度上诱导中枢胰岛素抵抗。高脂饮食的成分包括25%脂肪、20%蛋白质和50%碳水化合物。痴呆和AD长期以来被认为具有异常的脑胰岛素信号传导。该模型的核心特征是胰岛素抵抗。此外,高脂饮食诱导的肥胖会阻碍大脑区域的正常血液流动,减少氧气和葡萄糖的供应,从而导致血管性痴呆。此外,高脂肪饮食摄入量高的情况下,也会出现由高血压和糖尿病引起的认知能力下降。脂肪相关的胆固醇通过上调APP,在老年斑的生成中发挥作用。导致记忆丧失的其他机制可能还包括血脂失衡和葡萄糖运输干扰。高脂饮食诱导的AD模型还会通过降低抗氧化酶和增加促炎细胞因子,加剧氧化应激和神经炎症。
其它非大、小鼠模型
除了大鼠、小鼠,还有一些利用其他种属构建的AD模型,比如斑马鱼模型、秀丽隐杆线虫模型、果蝇模型、豚鼠模型和猴模型,篇幅所限,不再一一展开。另外,除了体内模型,也有些体外模型可用,比如采用神经母细胞瘤细胞系、诱导多能干细胞(iPSC)衍生的细胞系进行的研究,但体外模型的结果在人体转化方面更具挑战。
最后,除了以上模型外,还有些新型模型出现,比如STZ-APP/PS1 模型,这是一种用于治疗小鼠记忆障碍的新型方法。该策略结合了之前使用的STZ诱导的痴呆和经过基因改造的转基因模型。这种模型将产生更多且更接近AD特征的表现。又如果糖诱导模型,类似于半乳糖,它可以干扰代谢过程,通过引发胰岛素抵抗并导致葡萄糖代谢受损。果糖还可以刺激糖皮质激素的释放,从而调节食物摄入。如果通过饮食摄入过量的果糖,可能会导致神经元死亡。与食物摄入和饥饿相关的大脑区域,如下丘脑和海马,可能会受到影响。最终,它可能会导致记忆障碍和认知功能障碍。
下表对不同AD模型的优缺点进行了总结。
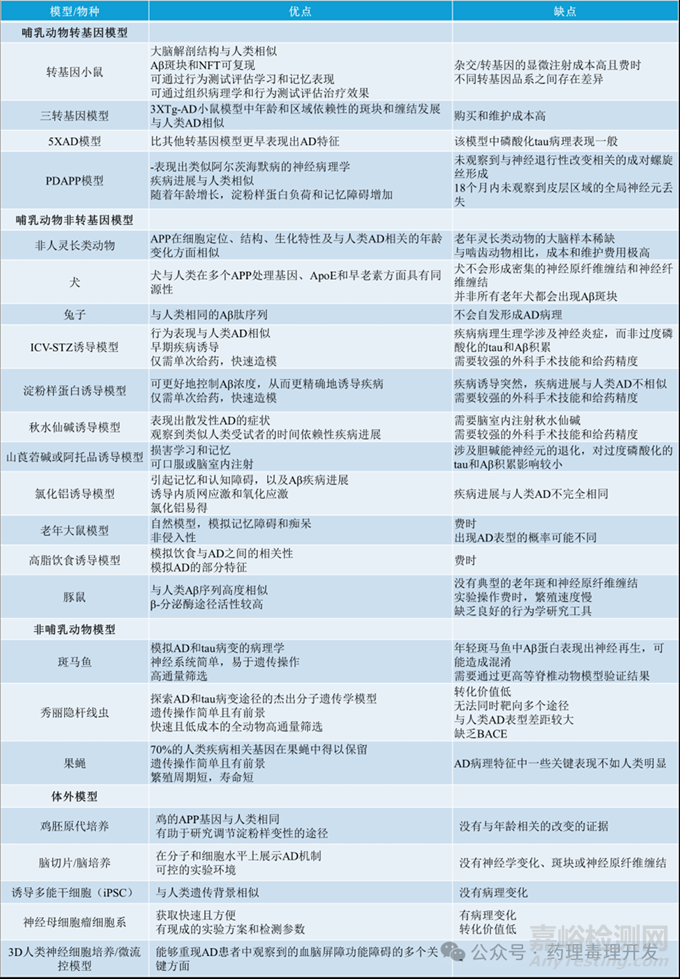

来源:药理毒理开发


