中药具有多成分、多靶点、多途径的特点,其药效物质和作用机制的研究是阐释中药整体功效及作用本质的核心。线粒体是细胞内能量生成的主要细胞器,参与生物体内多项重要生理和生化过程的调节,通过探究中药对线粒体结构、功能的影响,有助于揭示中药的药效物质基础,探索其作用机制。该文从中药对线粒体结构和功能的影响及中药作用于线粒体的效应靶点和活性成分两个方向,综述了中药及其活性成分发挥线粒体调控作用的机制和研究进展,以期为进一步开发靶向线粒体功能的中药或天然产物活性机制研究提供参考。
线粒体是真核细胞的重要组成部分,也是生物能量的主要来源细胞器,其内膜上进行的氧化磷酸化过程为细胞各项活动提供了90%以上的能量,故线粒体被称为“细胞的动力工厂”。不仅如此,线粒体在生物合成、信号传导中也扮演着关键角色,在氧化应激、细胞内钙稳态维持、细胞凋亡及脂质代谢等诸多方面发挥着极其重要的作用[1-3]。线粒体结构异常和功能缺陷会影响细胞乃至组织器官的正常生理功能,进而引发神经系统疾病、心血管疾病、肿瘤、呼吸系统疾病、消化系统疾病及糖尿病等[4-6]。
中药在我国被广泛应用于常见病、慢性病及多发病的预防和治疗,具有确切显著的临床疗效。研究发现,中药(包括单体、有效部位、单味药、复方)可直接或间接调节多种信号通路,进而影响线粒体的能量代谢、氧化应激及蛋白表达等过程,从而干预疾病的发生与发展[7-9]。近年来,基于线粒体的中药药效物质及作用机制研究已成为热点,通过探究中药活性成分与线粒体的相互作用及药效相关性,能够在一定程度上揭示中药的物质基础,而对线粒体结构和功能影响的研究则可从细胞、亚细胞水平评价中药药效并探讨其作用机制[10-14]。
本综述将从中药对线粒体结构和功能的影响,以及中药对线粒体的效应靶点和活性成分研究两个方面进行综述。
Part.01 中药对线粒体结构和功能的影响
1.1中药对线粒体数量、形态、结构的影响
细胞损伤的过程伴随着线粒体数量、形态和结构的改变,正确认识线粒体数量、形态和结构的变化是开展线粒体功能影响研究的关键[15-17]。对于线粒体数量、形态和结构完整性的检测一般采用透射电子显微镜,史华伟等[18]通过透射电子显微镜观察了中药复方醒脾解郁方对抑郁模型大鼠骨骼肌线粒体超微结构的影响,发现抑郁模型大鼠骨骼肌线粒体数目减少、形态肿胀、空泡变性,内嵴排列紊乱甚至溶解消失,出现明显的线粒体结构损伤。给药醒脾解郁方后,骨骼肌线粒体接近正常,未见肿胀及空泡变性,说明中药复方醒脾解郁方有较好的线粒体结构保护作用。
线粒体膜通透性转换孔(Mitochondrial permeability transition pore,m PTP)是存在于线粒体内、外膜之间的蛋白复合体孔道,其开放与关闭的状态与线粒体膜的通透性密切相关[19]。m PTP开放异常,会造成线粒体肿胀和膜电位异常,一些促凋亡蛋白释放入胞质,激活一系列级联反应后引起细胞凋亡[20],中药可调节m PTP进而改变线粒体形态。韩学超等[21]通过研究中药天麻提取物天麻素在心肌细胞氧化应激损伤模型中的作用,发现其可激活m PTP上游的相关调节因子,有效抑制m PTP的开放,减轻线粒体膜电位的下降,保护线粒体结构和功能,进而对心肌细胞、心脏乃至机体发挥一定的抗氧化应激损伤保护作用。Huang等[22]通过研究中药黄芩中的主要成分黄芩素对SARS-Co V-2病毒的影响,发现其可以通过抑制线粒体m PTP的开放及氧化磷酸化,维持线粒体形态的完整性,从而有效抑制SARS-Co V-2病毒的复制。
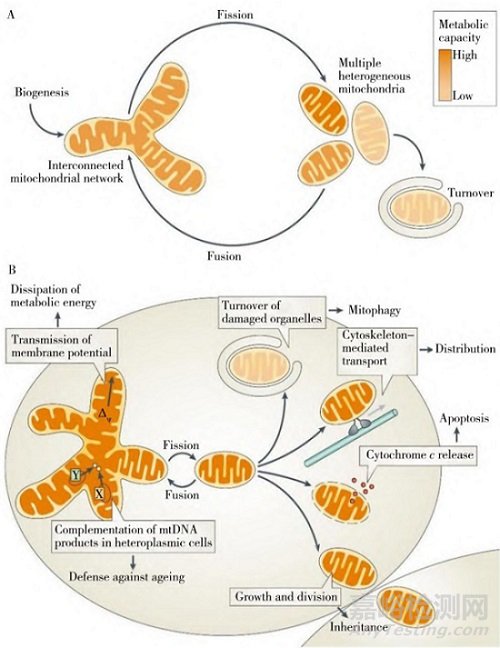
线粒体是一个动态的细胞器,在细胞的不同生理过程和环境条件下的数量、大小和形态会发生相应的变化,具有高度可塑性,各种生理病理刺激均会影响线粒体的分裂与融合、自噬等过程。线粒体通过控制分裂与融合、自噬等过程来维持线粒体正常功能,应答细胞的不同生理需求,成为近年来研究的热点。线粒体通过不停地进行融合与分裂运动来维持线粒体稳态,这种运动被称为线粒体动力学(Mitochondrial dynamics)[23]。线粒体的分裂与融合过程可以保证细胞内线粒体维持一定的数量,保持一定的形态比例,以适应不同的生理环境,不仅对于线粒体形态的控制至关重要,还影响着线粒体DNA的质量控制和细胞的生存状态(见图1)。该变化过程与诸多生物学过程息息相关,如能量代谢、抗衰老、自噬和凋亡、遗传等[24]。目前中药对线粒体融合分裂的研究主要关注于其受控蛋白的表达变化情况,包括促线粒体融合蛋白Mfn1、Mfn2和Opal,促线粒体分裂蛋白Drp1和Fisl等。研究表明,中药可以通过调控线粒体分裂与融合过程等动态变化达到治疗缺血/再灌注损伤、心肌梗死等疾病的作用[25]。Luo等[26]采用结扎左冠状动脉前降支建立心肌梗死模型,研究桃红四物汤对心脏功能的影响,发现桃红四物汤可以显著减少线粒体的分裂达到治疗缺血性心肌病的作用。
1.2中药对线粒体功能的影响
线粒体功能异常与肿瘤、神经退行性疾病、心血管疾病、免疫紊乱、糖尿病及衰老等发生和发展密切相关。中药可以直接或间接调节线粒体功能,从而干预疾病的发生、发展,具有良好的临床疗效。中药对线粒体功能的影响主要包括以下方面:干预线粒体能量代谢、氧化应激、钙离子稳态和凋亡等。
1.2.1线粒体能量代谢
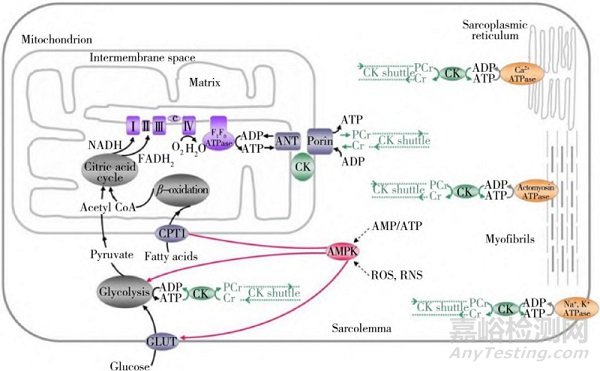
线粒体的主要功能为氧化磷酸化合成ATP(见图2)。糖类、脂肪和氨基酸等在细胞质中经过糖酵解、脂肪酸β氧化等一系列过程产生丙酮酸和脂肪酸,这些物质在主动运输转运作用下穿过线粒体膜,进入到线粒体基质中,再经过一系列分解代谢过程形成乙酰辅酶A,是三羧酸循环的初级底物[27]。糖酵解和三羧酸循环过程中产生的还原型烟酰胺腺嘌呤二核苷酸(NADH)和还原型黄素腺嘌呤二核苷酸(FADH2)是两种还原性的电子载体,所携带的还原性电子载体经线粒体内膜上的电子呼吸链逐级定向传递O2,生成H2O,同时释放出能量,被F0F1-ATP酶复合体用来催化ADP磷酸化而合成ATP,供机体各种活动的需要。中药可通过影响线粒体呼吸链、酶活性、三羧酸循环等途径,实现对机体异常能量代谢的调节。Song等[28]研究了强肌健力汤对重症肌无力大鼠线粒体呼吸链活性的影响,发现其可以通过促进呼吸链复合物的酶活性来修复线粒体功能损伤,改善能量代谢,达到治疗重症肌无力的效果。
图1 线粒体分裂和融合动力学过程[24]
图2 线粒体ATP的产生和消耗[27]
1.2.2线粒体氧化应激
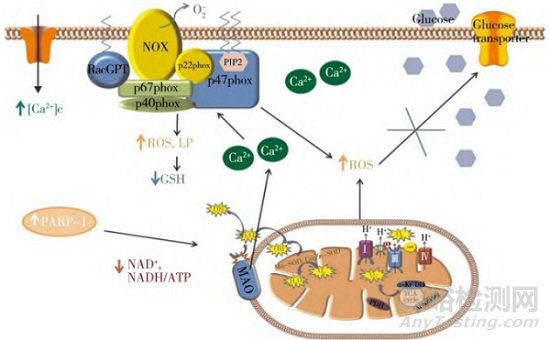
氧化应激是机体内氧化与抗氧化作用失衡的一种状态,当机体遭受有害刺激时,高活性分子如活性氧自由基(Reactive oxygen species,ROS)产生过多,氧化程度超出氧化物的清除速度,导致多种形式的损伤,线粒体呼吸链电子传递过程中的电子泄漏可能导致活性氧的产生(见图3)。生理状态下,ROS参与细胞内如生长、繁殖、发育分化、衰老等过程,在细胞中起着重要的调节作用;病理状态下,ROS的过量聚集会导致细胞和线粒体的结构和功能损伤,线粒体能量代谢障碍,从而引发线粒体介导的细胞凋亡[29]。许多中药能够调节细胞线粒体ROS的产生进而修复氧化应激损伤,杜肖等[30]观察了小续命汤有效成分组对脑缺血/再灌注大鼠恢复期脑组织线粒体的作用,发现小续命汤有效成分组对脑组织线粒体功能损伤有明显的改善作用,还可以降低线粒体ROS的含量,这可能是其发挥神经保护的作用机制。Zhang等[31]发现益气复脉散注射剂可以部分抑制线粒体ROS的产生,并通过调节Ca MKII信号通路改善心力衰竭小鼠的线粒体功能,为阐述益气复脉散注射剂治疗心血管疾病的潜在作用机制提供了科学依据。
图3 线粒体活性氧的产生及影响[29]
1.2.3线粒体钙稳态
线粒体是细胞内储存钙的主要场所之一,参与了钙信号形成以及钙稳态平衡。作为细胞内局部钙缓冲器,线粒体能够快速摄取大量钙,防止细胞质内钙水平过度升高,维持机体钙稳态平衡。但是过量的钙可导致线粒体膜通透性转换孔开放,进而导致线粒体功能障碍,影响Ca2+相关酶活性和信号转导。
中药可直接或间接调控线粒体Ca2+转运,干预线粒体和细胞内钙稳态,阻止细胞凋亡事件的发生。Ma等[32]发现中药复方灯盏生脉通过调节NMDA受体介导的Ca2+/Ca MKII途径,促进长时程增强效应来提高认知能力,类黄酮和咖啡酰类化合物是灯盏生脉的主要活性成分,灯盏生脉中的主要药效成分灯盏乙素(scutellarin)有望治疗认知缺陷。Gao等[33]发现中药注射剂双黄连可以通过激活线粒体Ca2+单向转运体以增强线粒体Ca2+摄取,降低肥大细胞胞质钙浓度,从而稳定肥大细胞膜,发挥抗过敏治疗作用。Dong等[34]发现中药黄芪中活性成分黄芪甲苷可以通过抑制线粒体Ca2+单向转运体蛋白的过度激活,维持线粒体钙稳态,进而抑制热诱导的细胞凋亡。
1.2.4线粒体凋亡
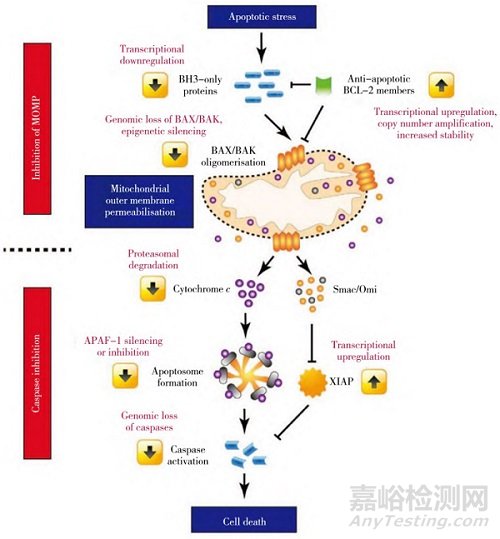
目前发现介导细胞凋亡的通路有3条,分别为线粒体通路、死亡受体通路和内质网应激通路,各条通路之间存在密切的联系,其中线粒体途径是细胞调亡最重要的信号通路(见图4)[35]。疾病发生造成线粒体结构受损,导致细胞色素C从线粒体释放到细胞质中,而促使凋亡因子Bax从细胞质进入线粒体,进而激活Caspase级联反应或激活凋亡诱导因子AIF相关的细胞凋亡,引起m PTP开放、膜电位下降,诱导线粒体途径的凋亡。另外,线粒体基质中Ca2+水平的增加,会引起m PTP的持续开放,导致线粒体肿胀,线粒体凋亡。
中药可以通过调控线粒体凋亡途径来治疗疾病,沈文华等[36]发现白头翁总皂苷碱水解产物在体内外均可以抑制肝癌细胞的生长,其作用机制与激活线粒体凋亡途径密切相关,有望成为治疗肝癌的新型药物。Zhao等[37]通过研究中药复方益心舒对心肌缺血/再灌注损伤模型的影响,发现其可以抑制线粒体介导的凋亡途径以减弱心肌细胞凋亡,且不会影响死亡受体通路和内质网应激通路,从而为临床试验和应用提供了依据。
图4 线粒体凋亡机制[35]
Part.02 中药对线粒体的效应靶点和活性成分研究
2.1中药对线粒体的效应靶点研究
目前报道的文献中主要侧重于中药对线粒体结构、功能的影响,对中药在线粒体内的具体效应靶点研究较少,限制了对中药的药效物质和作用机制的深入探讨。线粒体上有许多药物结合作用的靶点,例如线粒体电子呼吸链酶、m PTP、三羧酸循环关键酶、线粒体脂质代谢相关酶等,但大多数中药的具体靶点仍不清楚。近年来,蛋白质组学等技术被广泛应用于中药研究中,去探索其可能的线粒体效应靶点[38-41]。
随着人类基因组测序的完成、质谱技术的快速发展及蛋白质数据库的完善,不仅能快速检测低丰度蛋白质,还可以对某些蛋白质的亚细胞定位及功能信息进行深入研究,线粒体蛋白质组学越来越受到研究人员的重视。另外,以线粒体为切入点,研究线粒体能量代谢等功能所涉及的代谢物在机体内的变化是阐释中药药效基础、作用机制和效应靶点的一个新的发展方向。Wang等[42]建立了针对心肌细胞及其线粒体中代谢物测定的HPLC-MS/MS分析方法,发现尼克酰胺可通过补充NAD供给的方式,维持细胞三羧酸循环代谢的正常运行,修复线粒体能量代谢障碍而保护心肌细胞。丹参中的丹参酮ⅡA通过抑制m PTP保护缺血心肌线粒体,其机制为抑制电压依赖性钙通道(VDCC)的活性,减少钙离子内流,从而降低m PTP开放的触发信号,防止线粒体膜电位崩解和细胞色素C释放[43]。人参中的人参皂苷Rg1和Rh1通过激活SIRT3实现线粒体保护作用,其中Rg1通过SIRT3去乙酰化ATP合成酶α亚基(ATP5A1),恢复线粒体呼吸链功能,减少ATP耗竭和细胞凋亡[44];Rh1直接结合SIRT3并上调Foxo3a表达,通过PINK1/Parkin通路加速受损线粒体的清除,同时促进线粒体融合蛋白Mfn1/2的表达,维持线粒体网络稳定性[45]。这些研究为中药调控线粒体多类型效应靶点的研究提供了新的思路和方法。
2.2以线粒体为靶的中药的活性成分研究
中药可以通过影响线粒体的结构、功能达到治疗疾病的目的。Sheng等[46]基于蛋白质组学和代谢流分析技术首次发现了中药复方灯盏生脉中的主要活性成分灯盏乙素可通过靶向脑组织线粒体丙酮酸脱氢酶激酶-丙酮酸脱氢酶复合物轴(PDK2-PDC)来调控线粒体有氧代谢,进而发挥神经细胞保护的作用。该研究为神经系统疾病的治疗提供了一个小分子靶向代谢通路的案例。
细胞能量代谢分析可实时检测线粒体功能和代谢[47-48],通过测定ATP关联呼吸能力、最大呼吸能力、空余呼吸能力等,有助于深入了解线粒体能量代谢紊乱的作用机制。目前细胞能量代谢分析已经被广泛应用于药物筛选、药物转化、药理毒理、癌症、肥胖、糖尿病、衰老等热门领域的研究,在评估各种疾病与线粒体能量代谢关系中发挥着重要作用。Kwan等[49]通过细胞能量代谢分析仪研究了中药复方当归补气汤及其主要成分对H9C2心肌细胞能量代谢的影响,发现黄芪甲苷是诱导基础呼吸和ATP生成的主要活性化合物,藁本内酯能够显著诱导质子泄漏,当归补气汤可以通过增加基础呼吸、质子泄漏、非线粒体呼吸和ATP的产生来改善H9C2心肌细胞状态。
活细胞荧光成像技术使用活细胞染料标记细胞内特定生物大分子,或使用荧光蛋白标记体内特定蛋白,通过检测该染料或荧光蛋白特定的激发和发射波长可提供丰富的活细胞结构和功能变化信息。活细胞荧光成像具有实时、高清晰、高灵敏的优势,可以直接显示所测试的化合物在细胞中是否起作用,因此,基于荧光的成像技术已经被用于以线粒体为靶点的中药活性成分筛选研究。Wang等[50]采用活细胞荧光成像技术筛选芪参益气方中对心肌细胞线粒体功能有影响的活性成分,随后利用荧光自动显微镜筛选平台,对过氧化氢引起的心肌细胞线粒体膜电位变化进行分析,通过高效液相色谱-质谱联用技术确定了潜在的心脏保护成分,该方法可有效地发现作用于线粒体的中药活性成分。
Part.03 结论与展望
线粒体是细胞生物能量代谢的主要场所,同时还承担着许多其他生理功能,如细胞凋亡、增殖、代谢等过程的调控,与机体衰老、神经退行性疾病、肿瘤、心血管疾病等多种疾病的发生和发展密切相关,基于线粒体的中药药效基础和作用机制研究已经取得一定的成果。随着新分离和分析技术、组学数据库、蛋白质功能研究和数据处理软件的快速发展和不断完善,将有利于进一步深入研究中药作用于线粒体的深层机制。此外,细胞中的线粒体与其他关键细胞器还存在相互作用,需深入研究中药对细胞器之间的协同调节作用。
参考文献
[1] Brestoff J R,Singh K K,Aquilano K,Becker LB,Berridge M V,Boilard E,Caicedo A,Crewe C,Enríquez J A,Gao J,Gustafsson Å B,Hayakawa K,Khoury M,Lee Y S,Lettieri-Barbato D,Luz-Crawford P,McBride H M,McCully J D,Nakai R,Neuzil J,Picard M,Rabchevsky A G,Rodriguez A M,Sengupta S,Sercel A J,Suda T,Teitell M A,Thierry A R,Tian R,Walker M,Zheng M. Nat. Metab.,2025,7(1):53-67.
[2] Li M,Wu L,Si H,Wu Y,Liu Y,Zeng Y,Shen B. Signal Transduct. Target. Ther.,2025,10(1):71.
[3] Yang Y,Owusu FB,Wu H,Zhang X,Li R,Liu Z,Zhang S,Leng L,Wang Q. J. Ethnopharmacol.,2025,345:119588.
[4] Moura J P,Oliveira P J,Urbano A M. Biochim. Biophys. Acta,2025,1871(5):167803.
[5] Sun A,Pollock C A,Huang C. Biochem. Pharmacol.,2025,231:116669.
[6] Zheng Y,Yang J,Li X,Qi L,Zheng Z,Kong J,Zhang G,Guo Y. Neurobiol. Dis.,2025,208:106862.
[7] Zhang C,Chang X,Zhao D,He Y,Dong G,Gao L. J. Pharm. Anal.,2025,15(2):101051.
[8] Wang J,Dong Z H,Gui M T,Yao L,Li J H,Zhou X J,Fu D Y. Biosci. Rep.,2019,39(12):BSR20192909.
[9] Pan D,Chen P,Zhang H,Zhao Q,Fang W,Ji S,Chen T. Pharmacol. Res.,2025 ,215:107712.
[10] Wieckowski MR,Giorgi C,Lebiedzinska M,Duszynski J,Pinton P. Nat. Protoc.,2009,4(11):1582-1590.
[11] Liao P C,Bergamini C,Fato R,Pon L A,Pallotti F. Methods Cell Biol.,2020,155:3-31.
[12] Shimada S,Maeda S,Hikita M,Mieda-Higa K,Uene S,Nariai Y,Shinzawa-Itoh K. Protein Expr. Purif.,2018,150:33-43.
[13] Léger J L,Jougleux J L,Savadogo F,Pichaud N,Boudreau L H. Platelets,2020,31(2):258-264.
[14] Yang X X,Xu F,Wang D,Yang Z W,Tan H R,Shang M Y,Wang X,Cai S Q. J. Chromatogr. A,2015,1413:33-46.
[15] Légiot A,Céré C,Dupoiron T,Kaabouni M,Camougrand N,Manon S. Microb. Cell,2019,6(5):257-266.
[16] Chen W W,Freinkman E,Wang T,Birsoy K,Sabatini D M. Cell,2016,166(5):1324-1337.
[17] Chen W W,Freinkman E,Sabatini D M. Nat. Protoc.,2017,12(10):2215-2231.
[18] Shi H W,Guo R J,Zhao Z W,Wang H,Deng X F,Yuan Q J,Guo X,Guo J Y,Wang H. J. Beijing Univ. Tradit. Chin. Med.( 史华伟,郭蓉娟,赵振武,王惠,邓潇斐,袁清洁,郭晓,郭建友,王惠 . 北京中医药大学学报),2017,40(4):284-289.
[19] Robichaux D J,Harata M,Murphy E,Karch J. J. Mol. Cell. Cardiol.,2023,174:47-55.
[20] Zoratti M,Biasutto L,Parrasia S,Szabo I. Expert Opin. Ther. Targets,2024:28(1/2):1-3.
[21] Han X C,Xu J M,Xu S,Sun Y H,He M L,Li X D,Li X Y,Pi J Y,Yu R,Tian W. J. Southern Med. Univ.( 韩学超,徐菁蔓,徐森,孙雅涵,何玛莉,李晓东,李心雨,皮佳仪,于睿,田炜. 南方医科大学学报),2018,38(11):36-41.
[22] Huang S,Liu Y,Zhang Y,Zhang R,Zhu C,Fan L,Pei G,Zhang B,Shi Y. Signal Transduct. Target. Ther.,2020,5(1):266.
[23] Tábara L C,Segawa M,Prudent J. Nat. Rev. Mol. Cell Biol.,2025,26(2):123-146.
[24] Westermann B. Nat. Rev. Mol. Cell Biol.,2010,11(12):872-84.
[25] Wu L,Li Q,Liu S,An X,Huang Z,Zhang B,Yuan Y,Xing C. Free Radic. Res.,2019,53(7):727-736.
[26] Luo Z R,Li H,Xiao Z X,Shao S J,Zhao T T,Zhao Y,Mou F F,Yu B,Guo H D. Cardiol. Res. Pract.,2019,2019:5198278.
[27] Tokarska-Schlattner M,Wallimann T,Schlattner U. C. R. Biol.,2006,329(9):657-668.
[28] Song J,Lei X,Jiao W,Song Y,Chen W,Li J,Chen Z. Sci. Rep.,2018,8(1):8623.
[29] Angelova P R,Abramov A Y. FEBS Lett.,2018,592(5):692-702.
[30] Du X,Lu C,He X L,Du G H. China J. Chin. Mater. Med.( 杜肖,路畅,贺晓丽,杜冠华. 中国中药杂志),2017,42(11):2139-2145.
[31] Zhang Y,Zhang L,Zhang Y,Fan X,Yang W,Yu B,Kou J,Li F. Front. Pharmacol.,2019,10:381.
[32] Ma C,Sheng N,Wu J,Wang L,Jiang J,Yu H,Zhang J. J. Pharm. Anal.,2024,14(3):435-438.
[33] Gao Y,Hou R,Fei Q,Fang L,Han Y,Cai R,Peng C,Qi Y. Sci. Rep.,2017,7:38736.
[34] Dong Z,Zhang C,Chen Y,Chen Y,Yuan Z,Peng Y,Cao T. Cell. Physiol. Biochem.,2017,42(2):480-494.
[35] Lopez J,Tait S W. Br. J. Cancer,2015,112(6):957-962.
[36] Shen W H,Ji X M,Shu Z,Yang S L,Liu Y L,Feng Y L,Xu Q M. Chin. Tradit. Herbal Drugs(沈文华,季秀美,舒展,杨世林,刘艳丽,冯育林,许琼明. 中草药),2019,50(4):106-113.
[37] Zhao Y,Xu L,Qiao Z,Gao L,Ding S,Ying X,Su Y,Lin N,He B,Pu J. Sci. Rep.,2016,6:23025.
[38] Calvo S E,Mootha V K. Annu. Rev. Genom. Human Genet.,2010,11:25-44.
[39] Wang Y,Zhao Y,Jiang W,Zhao X,Fan G,Zhang H,Shen P,He J,Fan X. J. Proteome Res.,2018,17(2):794-803.
[40] Lin L,Liu Y,Fu S,Qu C,Li H,Ni J. Cells,2019,8(3):263.
[41] Jiang Y H,Jiang L Y,Wu S,Jiang W J,Xie L,Li W,Yang C H. Biol. Pharm. Bull.,2018,41(9):1430-1439.
[42] Wang H,Liang X,Luo G,Ding M,Liang Q. Mol. Biosyst.,2016,12(7):2257-2264.
[43] Hu T,Zou H X,Le S Y,Wang Y R,Qiao Y M,Yuan Y,Liu J C,Lai S Q,Huang H. Int. J. Mol. Med.,2023,52(5):109.
[44] Tang Y L,Zhou Y,Wang Y P,He Y H,Ding J C,Li Y,Wang C L. Exp. Ther. Med.,2020,20(2):1245-1252.
[45] Gong S,Chen H,Fang S,Li M,Hu J,Li Y,Yu B,Kou J,Li F. Br. J. Pharmacol.,2025,182(13):3017-3035.
[46] Sheng N, Zhang Z, Zheng H, Ma C, Li M, Wang Z, Wang L, Jiang J, Zhang J. Adv. Sci., 2023, 10(32):e2303584.
[47] Gardner J,Hammond S,Jensen R,Gibson A,Krantz M S,Ardern-Jones M,Phillips E J,Pirmohamed M,Chad⁃wick A E,Betts C,Naisbitt D J. Clin. Exp. Allergy,2024,54(1):21-33.
[48] Eyster C,Matsuzaki S,Pranay A,Giorgione J R,Faakye A,Ahmed M,Humphries K M. PLoS One,2025,20(5):e0317167.
[49] Kwan K K L,Huang Y,Leung K W,Dong T T X,Tsim K W K. Front Pharmacol.,2019,10:614.
[50] Wang Y,Zhao X,Gao X,Nie X,Yang Y,Fan X. Anal. Chim. Acta,2011,702(1):87-94.