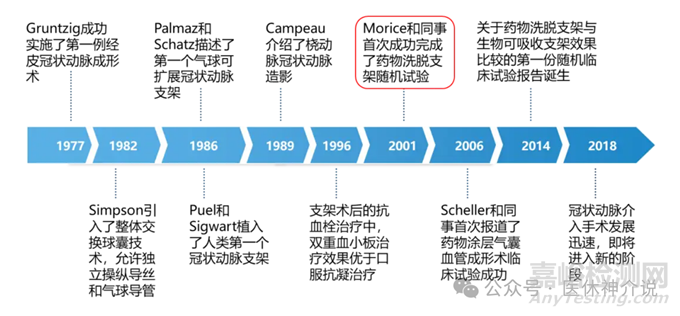
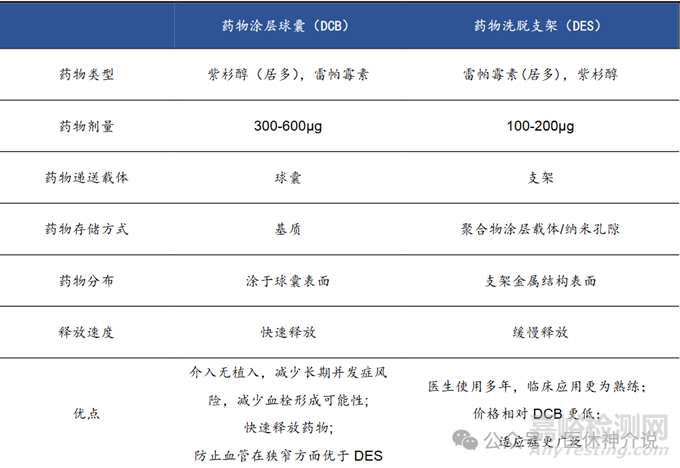
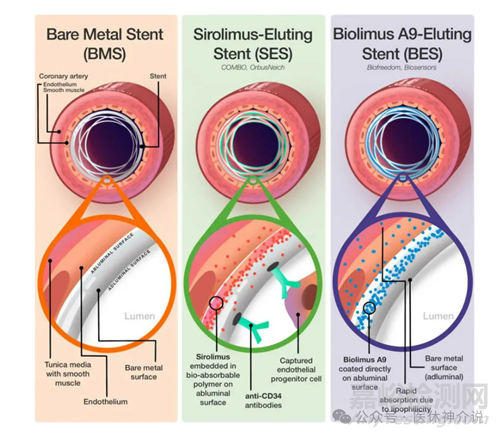
药物支架(DES)的发展过程,其发展的演变是基于临床结果反馈驱动的。对再狭窄问题的合理解决方案是局部(即在损伤部位)递送阻止平滑肌细胞增殖的药物。典型的DES设计包括金属裸支架平台、药物载体涂层和抗增生药物。
1-支架材料
支架设计能影响短期和长期的临床结果。在植入过程中,被压握在输送球囊上的支架,通过股动脉或挠动脉进入血管狭窄部位。支架材料所具备的特点有:
①一个低卷曲的轮廓;
②高度的顺应性,使其能通过弯曲复杂的血管;
③在支架植入血管的过程中,它应符合血管几何形状;
④支架应提供较好的血管覆盖面,并具有高的径向强度、小的径向回缩。
靶病变支架置放失败的手术并发症包括血管损伤、剥离和血栓形成。病理研究表明支架植入后会导致动脉愈合延迟及内皮化不良现象的发生。早期的支架通常由生物惰性金属制成,如不锈钢,近年来,钻铭等金属合金作为支架设计的材料己被证明优于不锈钢,自膨胀DES通常采用镰钦合金作为平台材料。
由于这些金属合金的强度和X 射线衰减水平都得到了提高,使得支架可以设计得更薄。
第一代DES的长期安全性问题也增加了临床对开发更具生物相容性的支架的需要,包括使用仿生和生物可阵解聚合物涂层的支架和完全生物可吸收支架。
2-支架涂层
经皮冠状动脉成形术只能在损伤血管和引起再狭窄的情况下进行,在靶部位进行药物洗脱是解决这一问题的有效方法。因此,目前大多数经批准的DES由金属支架组成,支架周围是包裹了药物的聚合物涂层。由于聚合物可能引起一些不良生物应答反应,因此涂层支架聚合物的生物相容性是非常重要的。
为了有效抑制内膜生长,理想的DES所周聚合物应该是抗凝、抗炎、细胞毒性低,并且可通过再内皮化促进血管愈合。支架表面涂层应与血液相容,直到内皮化过程完成前应避免血栓栓塞形成。部分实验研究了聚合物支架涂层对支架血液相容性的影响,证实聚合物可支持持续、可控的药物释放。
Parker等问总结了DES中聚合物的关键要求,包括物理性能、稳定性、与药物的相容性、与血管组织的生物相容性以及药物释放的控制。
尽管DES在治疗冠状动脉粥样硬化性心脏病(CAD) 方面取得了成功,但由于有可能造成支架血栓形成等晚期不良临床事件的发生,需对其长期安全性和有效性做更多观察研究。DES设计的研究和发展目前集中于提高其性能和长期安全性。另外,支架材料的表面特征,包括表面能、表面结构、表面电位以及表面氧化层的稳定性,都是影响血栓形成和内膜新生的因素。
有人研究并描述了涂层存在的不规则性,如在商用支架中发生的分层、开裂和剥落现象。在各种支架聚合物涂层模型上对DES 进行了体外定量耐久性试验,即定量缺陷(QD) 检测,以区分涂层之间的性能差异。
采用光学显微镜、扫描电镜和微天平对支架涂层缺陷进行了检测,实验结果表明不同的涂层模型表现出不同的QD指标,反映了涂层耐久性的优劣。
根据这些结果,采用所述方法则能够区分出不同的聚合物涂层模型用于支架涂层的聚合物可大致分为:
①非生物降解型聚合物,如聚甲基丙烯酸正丁醋、聚苯乙烯-b-异丁烯-苯乙烯等;
②可降解聚合物,如聚乳酸或其共聚物等;
③生物类聚合物,如磷酸胆碱聚合物、透明质酸和纤维蛋白等。
根据支架使用的要求,最有效的方法是促进药物装载和稳定释放,第一代DES涂上永久的聚合物能够使其持续释放药物,随后,这些永久聚合物开始被磷酸胆碱等生物相容性更好的永久聚合物和共聚物取代。这些改进的聚合物模拟血红细胞的磷脂外表面,大大降低了血栓的形成,使后期临床不良事件发生率大幅降低。
氟化物涂层药物洗脱支架可以说是第二代药物洗脱支架金标准。高生物相容性永久涂层采用的氟化聚合物在植入医疗器械中广泛应用,如人工血管材料、氟化物人造瓣膜,不可吸收氟化聚合物缝线和补片,人工血管的氟化聚合物涂层等等。氟化物涂层具有良好的生物相容性,血栓、炎性反应发生率低。永久聚合物涂层可以起到隔绝金属与血液的作用;在绿色荧光染色下,各种可降解载体的药物洗脱支架血小板吸附情况较多,而氟化物涂层的药物洗脱支架血小板吸附情况最少,血栓发生风险最低;另外在电镜下观察炎症细胞的负荷量,同样氟化物涂层的药物洗脱支架是最少的,炎症反应发生率最低。炎性反应会影响到血管内皮愈合。
14 天内皮化结果: 氟化物涂层DES相比其他可降解载体DES内皮愈合更完整。
氟化物涂层优异的物理性能,扩张后涂层长期完整、平滑。在电镜下看,氟化物涂层即使到爆破压都没有瑕疵,而其他三种非氟化物载体的支架都出现了裂痕、破损,甚至有断裂和脱皮情况,这就会给炎症和血小板附着提供更多机会。
氟化物涂层良好药物相容性,稳定的药物释放曲线,精准平缓,抑制内膜过度增生。
在BMS和DES之间,市场上也有直接使用不含药物的特殊涂层支架抑制血小板稀附,也就是所谓的钝化涂层支架。这些涂层的主要目的是在支架表面之间提供生物惰性屏障来抑制j血小板猫附,这类涂层包括类金刚石、碳化硅、氧化铁等问。
使用DES局部给药已成为一种非常有前景的有效对抗ISR的方法。为了使局部给药成功,需要解决的挑战包括:
①使用最合适的药物;
②确定局部所需与全身剂量的比例;
③确定能够为所需治疗部位提供药物的生物相容性载体。
3-药物
DES的候选药物主要包含四类药物(抗炎、抗血栓形成、抗增殖和免疫抑制型),这些药物能有效抑制导致再狭窄的一个或多个生化途径。一些研究也使用了抗体阻断特定受体作为活性化合物。目前关于这些药物的释放动力学、有效剂量、临床应用安全性和效益的评价己有了充分的研究报道。
1) 紫杉醇
紫杉醇是一种亲脂分子,来源于太平拌红豆杉短叶红豆杉,是癌症化疗中非常常见的药物成分。紫杉醇对球囊和支架介导的损伤后新生内膜增生的血管相容性和疗效己在体内和体外实验中得到证实。工作模式是聚合微管蛋白的α单元和β单元,从而稳定微管,停止其从G2期向有丝分裂期的过渡。
紫杉醇能抑制平滑肌细胞的增殖和迁移,因为细胞骨架的结构变化是动脉粥样硬化和再狭窄发展的主要步骤之一。
2) 西罗莫司(雷帕霉素)
迄今己对西罗莫司、佐他莫司、依维莫司、比欧莫司A9、他克莫司、毗美莫司等6种莫司药物进行了研究。西罗莫司又称雷帕霉素,是一种具有强免疫抑制作用的大环抗生素。它作为一种药物能结合特定的细胞浆蛋白CFK.-506 结合蛋白-12) ,阻止细胞增殖。
西罗莫司还能抑制再狭窄级联的几个阶段,如炎症、新内膜增生的形成、总蛋白和胶原的合成以及平滑肌细胞的迁移。同时它也是一种低剂量无细胞毒性的强炎症抑制剂。
3) 佐他莫司和依维莫司
佐他莫司和依维莫司是西罗莫司的类似物。两者在预防再狭窄方面具有相似的作用机制。它们与胞质FK-506结合蛋白-12结合,抑制平滑肌细胞和T细胞的增殖。这些化合物的乙醇·水分配系数也比西罗莫司高,后者有利于支架的缓慢释放。此外,它们的亲脂性有利于通过细胞膜抑制靶组织的新生内膜增殖。
4)他克莫司
他克莫司也是一种免疫抑制剂,也可与胞质FK-506结合蛋白-12结合,由此产生的复合物相互作用并抑制钙调神经素,从而抑制T 细胞信号转导和IL-2转录。
细胞培养实验表明,他克莫司比西罗莫司具有更旱的内皮细胞再生能力。然而,他克莫司抑制血管平滑肌细胞增殖或迁移的作用不如西罗莫司。结合其强大的抗炎作用,他克真司是一种有希望用于药物洗脱支架的化合物。
5) 比欧莫司A9
比欧莫司A9是一种高度亲油的半合成西罗莫司类似物。在细胞水平上,比欧莫司A9 与细胞内FK-506结合蛋白-12形成复合物,与哺乳动物西罗莫司靶蛋白结合,可逆地抑制增殖平滑肌细胞的细胞周期转变,其效力与西罗莫司类似。比欧莫司A9具有增强的抗炎和抗增殖活性,并具有更好的药代动力学特性。
6) 地塞米松
支架植入后再狭窄主要表现为对程序性损伤的炎症反应和包括平滑肌细胞增殖在内的纤维细胞的强烈反应。地塞米松是皮质类固醇,是公认的抗炎药物,系统地用于广泛的炎症疾病治疗和抑制成纤维细胞、平滑肌细胞和巨噬细胞的增强。临床前数据表明,地塞米松涂层DES 对新内膜增殖有抑制作用。不过地塞米松支架的抗再狭窄临床效果无法与西罗莫司或第一代紫杉醇洗脱支架相比。
7) 抗体
一般来说,球囊血管成形术后,无论是否植入支架,都要系统地给予抗血栓形成药物。为此, Aggarwal 等评估了抗血小板GPIIb/illa 抗体洗脱的纤维素涂层支架在兔动物模型中的应用。研究表明,这些抗体洗脱支架能有效抑制支架微环境中血小板聚集,从而减少血栓形成,改善血流和动脉效能,抑制循环血流变化。