您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-09-01 08:52
技术背景
自19世纪以来生物制药历经小分子药物和多肽药物的两次变革,但其发展受靶点成药性的限制,开发难度大。而小核酸药物的发现可以视为第三次变革,继2023年诺贝尔医学奖授予mRNA疫苗相关研究后,2024年诺贝尔生理学奖授予了在微小核糖核酸(microRNA)及转录后基因调控来控制蛋白质表达的研究。由于在生物体内DNA解旋RNA转录控制着氨基酸形成多肽的序列,多肽的延长形成复杂构型成为蛋白质,小核酸药物对比经典的小分子药物和抗体药物在蛋白层面进行疾病干预与消除不同,小核酸药物能在遗传信息的源头发挥作用,具有特异性强、丰富的基因靶点、疗效持久等优势,相比与传统药物复杂的合成与纯化工艺,能显著降低生产成本与研发周期。现已经成为全球医药研发和投资的重要风口,迄今为止小核酸药物市场规模的持续增长,这也必将推动整个产业链的上游发展。
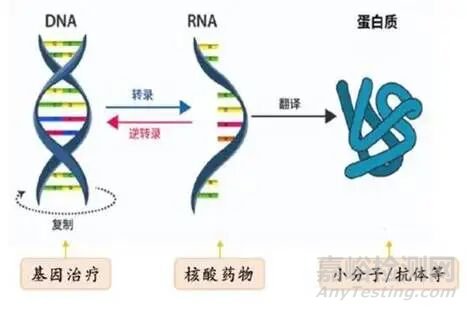
图片来源平安证券研究所
由于小核酸属于人体内源性物质,没有任何修饰的RNA在人体内非常不稳定性并且有阻碍RNA进入细胞的磷脂双分子层存在,小核酸药物在临床应用上有极大挑战。多个早期小核酸药物临床研究接连折戟也暴露了小核酸药物的结构性问题:
新技术加持下小核酸药物的一骑绝尘
由于构成小核酸药物的基本单元核苷极易被体内的核酸酶降解、且药代动力学性质差等问题,一般不能直接连入序列中作为核酸药物,小核酸药物需要经过多位点的化学修饰以提高其亲和力、稳定性、优化代谢途径等。经过数十几年其中核苷结构优化已经更新迭代多次,分别为:
第一代的磷酸骨架修饰:硫代磷酸酯(P-S替代P-O)以及后期的磷酸二硫代(PS2)修饰都能影响小核酸药效的巨大改善;
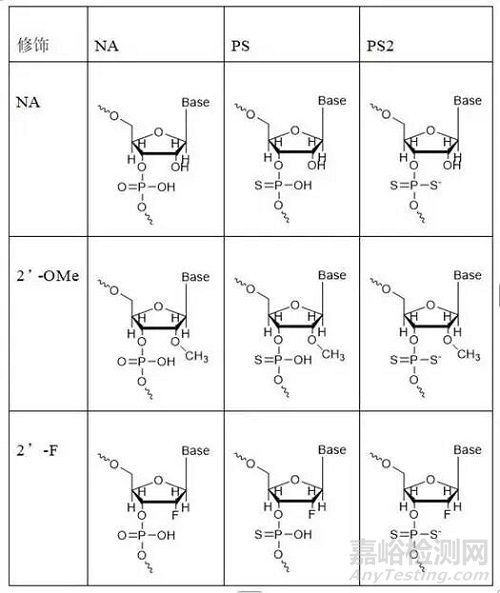
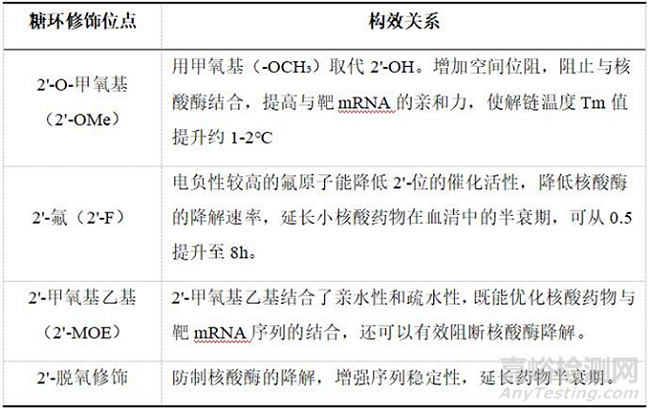
第二代的2’-O-甲基(2’-OMe)、2’-O-甲氧基乙基(2’-MOE)以及2’-氟(2’-F)是最常用的2’位取代基,此外碱基修饰通过对核苷上的碱基嘧啶和嘌呤环的结构修饰,可以加强药物与mRNA碱基之间的相互作用,例如甲基取代(5-Methylcytosine)嘧啶环上的碳5位如,5-甲基尿苷和5甲基胞苷在(ASO)反义寡核苷酸药物中经常应用。
第三代的糖环结构修饰又进化出锁核酸(LNA)、吗啉环(PMO)等新颖的化学结构,本文对小核酸药物基本结构单元(核苷单体)的各种结构修饰方式进行比较详细的阐述,并结合具体的小核酸药物的具体实例说明核苷单体修饰和结构优化的必要性,核苷单体不仅是小核酸药物的基石,更是能够承载核酸药物腾飞的强大推手。
一、磷酸骨架修饰及其衍生
1.1磷酸骨架修饰(P-S替代P-O)
磷酸骨架修饰是第一代小核酸药物中常见的化学修饰,是最基本的化学修饰,其中使用较多的骨架修饰为硫代磷酸,即用一个硫原子取代磷酸二酯键的非桥氧原子(P-S替代P-O),该修饰明显降低寡核苷酸的亲水性、增加了对核酸酶降解的抵抗力,提高了药物稳定性和半衰期,促进其与血清蛋白的结合,增加细胞摄取,指导核糖核酸酶降解靶标mRNA。在(ASO)反义寡核苷酸,和(siRNA)小干扰核酸药物中颇为常见,
1.1.1 横空出世Fomivirsen
Vitravene® (Fomivirsen)是由Isis Pharmaceuticals同Novartis联合研发,于1998年获FDA批准,1999年获得EMA批准。主要用于治疗艾滋病(AIDS)病人并发的巨细胞病毒(CMV)性视网膜炎二线治疗。通过对人类巨细胞病毒(CMV) mRNA的反义抑制作用具有特异性强,疗效维持久,抗病毒强,给药次数少,不良反应少等优势。Vitravene® (Fomivirsen)是第一个获准上市反义寡核苷酸类药物,主要是利用硫代磷酸盐进行主链修饰,即用一个硫原子取代磷酸二酯键的非桥氧原子(P-S替代P-O)可通过增加疏水性、对内切酶的抗性等来促进体内细胞摄取、提高生物利用度。
Fomivirsen的结构图片来源化源网
1.1.2 Tofersen 托夫生渐冻症患者的希望之光
2023年4月25日,美国食品药品监督管理局(FDA)批准Biogen公司的Qalsody (tofersen,托夫生)注射液用于治疗具有超氧化物歧化酶1(SOD1)突变的肌萎缩侧索硬化症的成人患者(ALS)-渐冻症,这是FDA批准的第四种治疗渐冻症的药物,不同之处是是托夫生是第一个获批的靶向性ALS渐冻症的药物,它是首个针对ALS渐冻症的遗传病因的治疗方式。
Tofersen是一种反义寡核苷酸,是一种20个碱基混合主链寡核苷酸。2'-甲氧基乙氧基(2'-MOE)这种修饰不仅能有效阻断核酸酶作用,还能优化药物与靶序列的结合,在19个核苷酸间连接中,15个是3′-O到5′-O硫代磷酸二酯,4个是3′-O到5′-O磷酸二酯,用一个硫原子取代磷酸二酯键的非桥氧原子,降低寡核苷酸的亲水性、增加了对核酸酶降解的抵抗力,提高了药物稳定性和半衰期。
托夫生结构式图片来源医药魔方
1.2磷酸二硫代PS2修饰技术
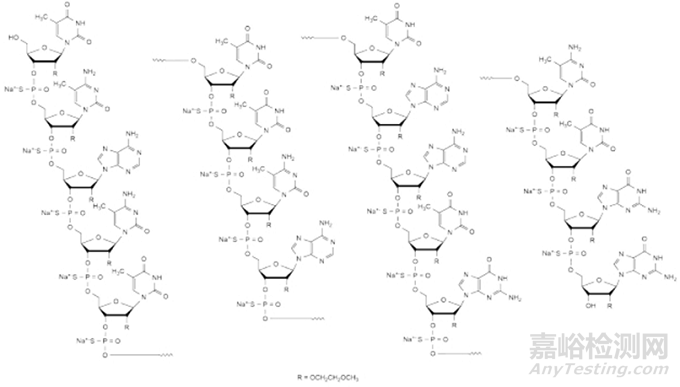
最近几年磷酸骨架修饰也发生了更新迭代即磷酸二硫代PS2修饰在小核酸药物研发中日益受到关注,磷酸二硫代(PS2)修饰是一种创新的化学修饰技术,通过将寡核苷酸骨架中的两个非桥接氧原子完全替换为硫原子,PS2修饰因其磷原子中心的无手性特点,从而赋予了药物独特的物理和化学性质。尤为突出的是磷酸二硫代(PS2)与2'-O-甲基(2’-OMe)结合的MePS2形式,在siRNA和RNA适体等药物的研发中展现出显著的优势,为解决成药性难题提供了新的途径,相较于传统的磷酸硫(PS)修饰,有效避免了非对映异构体混合物的复杂性,使得药物质量控制流程得以极大简化。
图磷酸二硫代(PS2)修饰
通过PS2技术修饰后能大幅度提升核酸与蛋白靶点之间的结合亲和力,强化结合与沉默效率,在实验中通过一个PS2修饰就能使得适体与凝血酶的结合力提升1000倍左右,这种性能为高灵敏度诊断工具以及高效治疗性适体的开发提供了更广阔的思路。
天然siRNA序列在血清中的半衰期很短,大约20分钟,这限制了它的效递送效率,通过PS2双硫键的修饰,siRNA的血清半衰期得到了显著延长,达到24小时以上,实验中未修饰的siRNA在含有10%胎牛血清的环境中仅3小时就完全降解了,而通过PS2双硫键的修饰的siRNA在相同环境中能保持60%的完整性。单次给药后,PS2双硫键的修饰的siRNA能维持长达7天的靶基因沉默效果,远超未修饰siRNA的2天。
二、核苷糖环2’位修饰以及递送载体的应用
第二代的化学修饰主要集中在核糖结构中,主要是对核糖结构部分的羟基进行化学修饰,因为2’位的修饰能够改变糖环本身的折叠,影响整个核酸分子的最稳定构象,从而影响其结合能力,改变分子的活性,另外引入2’位修饰基团,其作为核酸酶底物的契合度会降低,可以增强对核酸酶的抗性。由于RNA和DNA的结构仅差一个2’位的羟基,因此该羟基微小的改变就足以引起显著效应,也决定着RNA糖基部分的构像,最终影响与靶RNA的亲和力。2’-O-甲基(2’-OMe)、2’-O-甲氧基乙基(2’-MOE)以及2’-氟(2’-F)是最常用的2’位取代基,它们相比未经修饰的2’-OH有更好的核酸酶抗性,提高了药物在血浆中的稳定性、增加了在组织中的半衰期,能够延长药效时间。
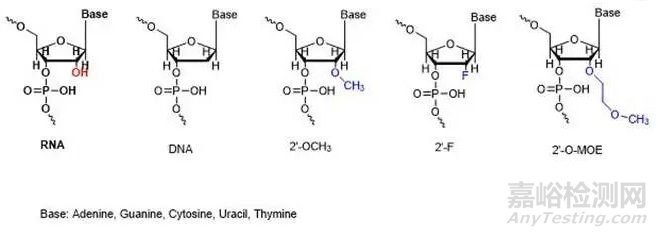
图2’位的修饰
现阶段大部分寡核苷酸药物都是采取固相亚磷酸酰胺化学法进行合成,起始物料核苷亚磷酸酰胺单体(核苷单体)的制备是固相合成工艺的关键技术,每个公司都有自己的专利技术和工艺过程来商业化量产高质量的核苷单体产品,满足寡核苷酸药物以及相关产品的临床研究的迫切需求。
2.1 天价神药70万一针的诺西那生
诺西那生由Ionis和Biogen联合开发,是治疗脊髓性肌萎缩症儿童和成人的首个药物,于2016 年12 月23日获得美国FDA 批准上市,Nusinersen 自上市也来,销售连年增长,已经成为突破20 亿美金以上的药物。
Nusinersen (诺西那生)是一种修饰的反义寡核苷酸,糖环的2’-羟基修饰与磷酸骨架修饰协同作用的一款药物。 Nusinersen 含18 个核苷酸,结构被修饰为加帽型(gapmer )抵制核酸酶降解增强其序列结构稳定性,其糖环的2’-羟基被2'-甲氧基乙氧基(2’-MOE)所取代,有效阻断核酸酶作用,优化药物与靶序列的结合。序列中胞嘧啶的5’引入了甲基,作为核苷碱基部位的修饰,以消减免疫刺激副作用。诺西那生钠的磷酸骨架的修饰是用硫代磷酸酯键链接取代,它用一个硫原子取代磷酸二酯键的非桥氧原子(P-S替代P-O)其结构式为:
诺西那生结构式图片来源www.fda.gov
2.2 核苷修饰之siRNA药物Patisiran 首开先河
Patisiran (Onpattro®)由Alnylam研发,于2018年8 月获得美国FDA及EMA批准上市。Patisiran是一种以脂质纳米颗粒(LNP)为递送系统的小干扰RNA(siRNA)药物,通过靶向并沉默转甲状腺素蛋白(TTR)的mRNA,抑制突变蛋白的表达,用于治疗成人遗传性TTR淀粉样变性多发性神经病(ATTR-PN),这是全球首款获得FDA批准的RNAi疗法,其成熟工艺及序列选择、修饰技术带来了确切的疗效,极大的满足了患者的需求,该产品在2018 年上市后就取得了巨大的成功,每季度保持了销售额的高速增长,2021年在全球范围内的业绩达到4.75亿美元,同比增长55%。
Patisiran 是化学合成的双链寡核苷酸,正义链和反义链各包含21 个核苷酸。正义链的19 个核苷酸与反义链的互补19 个核苷酸杂交,从而形成19 个核苷酸碱基对,并在每条链上留下两个3’-末端核苷酸作为未杂交的突出端,在修饰上Patisiran 应用了2’-脱氧修饰和2’-O-Me 修饰协同作用。

Patisiran结构图片来源www.fda.gov
2.3 GalNAc 精准递送Givosiran
Givosiran 是第一个用GalNAc 递送载体技术上市的siRNA 药物2019 年11 月FDA批准上市,也是第一个治疗成人急性肝卟啉症(AHP)的药物,该药物在2021年的业绩达到1.28亿美元,同比增长132%,具有极大的市场潜力。
Givosiran是一种化学合成的双链寡核苷酸,正义链有21个核苷酸,反义链23个核苷酸,采用2'-O-甲基(2'-OMe)和2'-氟(2'-F)糖基修饰,结合硫代磷酸(PS)骨架,显著增强核酸酶抗性和靶向ALAS1 mRNA的结合亲和力,实现RNA干扰以减少毒性卟啉前体,展现了糖基与骨架修饰的完美协同。
Givosiran 应用了ESC -GalNAc-siRNA共轭技术(增强稳定化学修饰),通过ESC 修饰方式增强了双链对核酸酶的稳定性。另外,附着于正义链的3’末端的靶向肝细胞的配体L-96具有3 个GalNAc靶头,其他三个末端(正义链的5’和反义链的3’,5’)在每侧的最后两个亚基中具有硫代磷酸酯键。这种增强稳定化学修饰(ESC-GalNAc-siRNA)在小核酸药物注射皮下后具有更强的稳定性,能延长药物在血清中半衰期至数天,并且与标准模板化学(STC)相比,该药物的效力提高了10 倍。GalNAc偶联进一步优化肝细胞靶向,降低脱靶效应。临床试验显示,Givosiran使AHP发作率降低约70%,实现季度给药2-3个月注射一次。这款药物通过糖基与骨架修饰的结合,完美兼顾了稳定性与生物活性,成为了为系统性递送的siRNA疗法的新星,体现出化学修饰在小核酸药物中的重要作用。
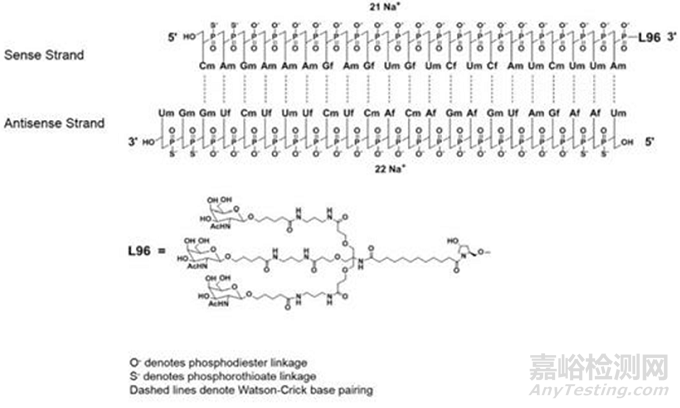
Givlaari(givosiran)结构图片来源www.fda.gov
2.4 长效之王Inclisiran
Inclisiran是降低胆固醇的RNAi 疗法,虽然目前降低胆固醇的药物主要为汀类药物和抗体类药物,但汀类药物对于严重高胆固醇血症患者及他汀不耐受患者均得不到控制,而抗体类药物面临着极高的成本或频繁给药问题,因此,采用创新的疗法来替代并解决这一大众化心血管疾病的迫切需求。
Inclisiran 于2020年获EMA批准上市,是首款降低LDL-C 的RNAi 疗法。Inclisiran是合成的化学修饰的双链小核酸(siRNA),正义链包含21个核苷酸,反义链包含23个核苷酸,化学修饰包括硫代磷酸酯、 2’-F、2’-甲氧基,和三价GalNAc递送载体技术等等协同加持,由于有递送载体L-96实现精准给药,递送效率和半衰期大幅提升,即可实现长效,一年2针的给药方式能够极大改善患者生活质量。
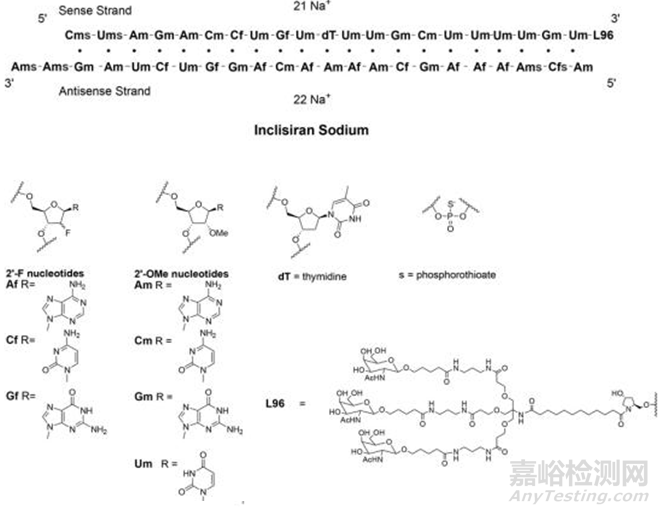
Inclisiran结构图片来源www.fda.gov
三、第三代化学修饰技术—核糖五元环修饰
3.1锁核酸(LNA)修饰技术及其应用
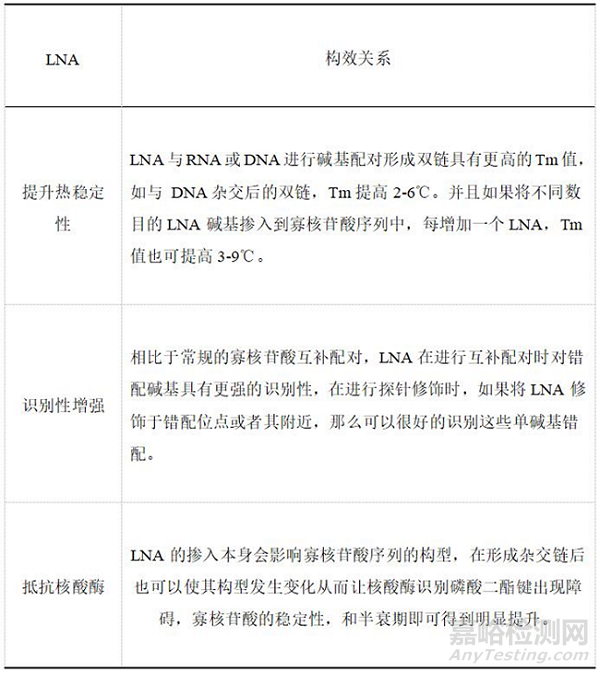
锁核酸(LNA)是在核苷分子的五碳糖环的2'-O原子和4'-C原子之间构建了亚甲基桥,这种修饰使核苷分子出现了双环的结构,此构型不仅加强了呋喃糖 C3’-内型的N 构型,降低了核糖结构的柔韧性,进而增强磷酸盐骨架的结构强度。这种刚性结构限制了核酸酶接近磷酸二酯键,同时大幅提高了热稳定性(每个修饰位点可使Tm值提升5-10℃)和靶向特异性。锁核酸(LNA)与DNA、RNA相比,LNA良好的水溶性,可以很好地穿过细胞的磷脂双分子层从而进入细胞,易被机体吸收,它也没有毒性,注入小鼠体内进行毒副作用检测并没有发现病理改变。现阶段LNA主要用于ASO和siRNA的设计中。遵循Watson-Crick配对原则,能够与互补的LNA、单链DNA、RNA形成高亲和力的杂交物,可以降低或阻断转录翻译过程。除此之外,还能在中性条件下和双链DNA结合形成三股螺旋寡核苷酸而影响基因的表达
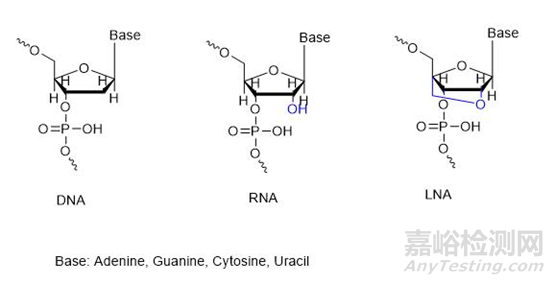
图DNA,RNA和LNA结构
3.1.1 LNA修饰应用反义治疗(ASO)
反义治疗是指将天然或人工合成的核酸探针导入目标细胞,探针和细胞内的靶标DNA或者RNA形成杂交链从而抑制、封闭或破坏相关致病基因表达,达到治疗目的。反义药物是依据这一原理,一般由20-30个核苷酸构成,但由于人体内核酸酶的广泛存在,未经修饰的寡核苷酸链容易被降解,因此利用LNA修饰增强其稳定性。LNA应用于miRNA mimics,可以使之更有效地结合到相应的靶标转录因子上从而影响下游靶基因的表达,LNA也可应用于miRNA inhibitor例如,序列miR-155与蕈样真菌病(mycosisfungoides,MF)存在关系,miR-155 inhibitor竞争性地结合miR-155,即可阻止miR-155与靶基因结合,能够致使病变细胞死亡,阻断病变细胞增殖,治疗肿瘤。
3.1.2 LNA修饰分子信标在实时定量PCR中应用
实时定量PCR是一种在DNA扩增反应中,以荧光化学物质测每次聚合酶链式反应(PCR)循环后产物总量的方法,它结合了PCR技术和实时荧光检测技术,能够实时监测DNA的扩增情况,从而实现对靶DNA的定量分析。用LNA修饰后的探针,可以实现高通量的SNP分型。比如进行HIV病毒的SNP检测时,传统的Taqman探针长度需要到25-35个核苷酸,但是由于HIV-1的自然异质性,很难在200个碱基对中找到三个保守区域包含大部分HIV-1M组亚型,检测灵敏度大幅降低,锁核酸(LNA)能缩短探针长度、提高探针Tm值,通过构建LNA-Taqman探针实现了探针更短,识别单碱基错配的能力更强,弥补传统探针的不足,提高了检测灵敏度。
3.1.3 LNA修饰核酸适配体
核酸适配体(aptamer)长度一般在15-60碱基之间,一般是特异性结合靶标物的单链核酸。其靶标物不局限于核苷酸分子,还包括病毒、细菌、活细胞氨基酸、多肽等大分子,利用LNA技术修饰的核酸适配体(aptamer)可以提高其稳定性,核苷分子的双环的结构,增强磷酸盐骨架的结构强度,这种刚性结构限制了核酸酶接近磷酸二酯键,从而避免或降低核酸适配体在生物体内中被酶切的风险。
3.2 PMO技术治疗杜氏肌营养不良症(Duchenne Muscular Dystrophy,DMD)
PMO技术是五元核糖杂环被六元吗啉环取代,与常规RNA 或DNA 相比,PMO 碱基与吗啉部分相连,并且亚基通过磷酸二氨基酯键连接,该键在生理上呈中性电荷pH 值。PMO 的骨架保留了对目标RNA 的强结合力,以及序列的特异性,并且不容易被核酸酶降解,PMO改造可以增强核酸药物对核酸酶的抵抗、提高亲和力和特异性等。
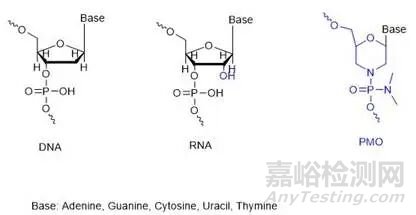
常规 DNA 和RNA相比吗啉环
3.2.1 Eteplisen( EXONDYS 51)治疗杜氏肌营养不良症(DMD)的药物
Eteplisen( EXONDYS 51)由Sarepta Therapeutics研发,于2016年9 月19 日获得美国FDA 加速批准上市,成为首个获批治疗杜氏肌营养不良症(DMD)的药物,年销售额已超4亿美元。Eteplirsen 含有30 个核苷酸,并且经过PMO 修饰,其中5’起始端的羟基聚乙二醇(PEG3)作为柔性连接臂,增强分子的水溶性、稳定性和生物相容性,减少空间位阻,并降低免疫原性。
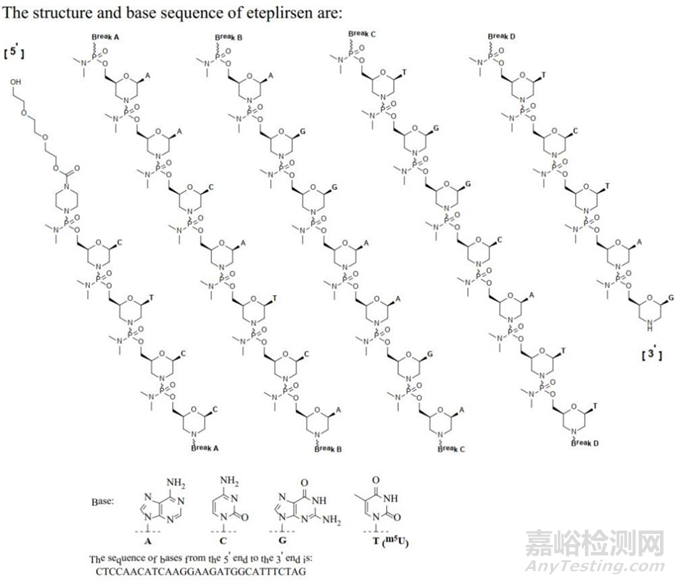
Eteplirsen结构图片来源医药魔方
3.2.2 Casimersen(AMONDYS 45)治疗杜氏肌营养不良症(DMD)
Casimersen(AMONDYS 45)同样是由Sarepta Therapeutics公司开发,并于2021年02月25日获得美国FDA批准上市并用于治疗杜氏肌营养不良症(DMD)的反义寡核苷酸。此款药物同样应用了PMO 修饰技术,吗啉环的骨架保留了对目标RNA 的强结合力,同样也有不容易被核酸酶降解的特性。
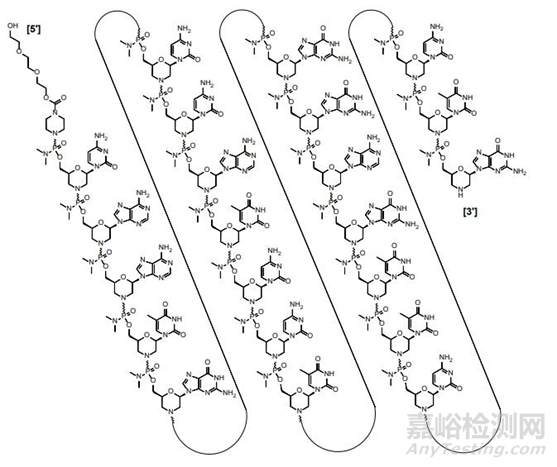
Casimersen结构图片来源www.fda.gov
结语:
纵观全球在化学修饰技术驱动小核酸药物发展的领域Ionis、Alnylam、Sarepta Therapeutics等国际巨头一直处于头部,然而时代更迭,在2025年的中美紧张的贸易关系背景下,我们要积极响应关键技术不能完全依赖进口的时代主题要求,推出自己的化学修饰专利创新的布局。如今中国已有多家公司在小核酸药物研发领域深耕多年,比如,瑞博生物、炫景生物、舶望制药、等小核酸药物研发企业均有各自的化学修饰技术专利,其各自的研发管线也均有进入临床阶段的利好进展,核酸药物在未来十年大概率会迎来爆发式增长,也要坚信会有更多的疾病因为其致病基因的发现而被小核酸药物完美治愈。
参考文献:
[1] 华创研究
[2] 海通证券研报
[3] 弗若斯特沙利文
[4] 平安证券研报
[5] 上海北外滩金融研究院 2022年11月08日信熹研究《基因噪声的调音器—小核酸药物研究报告》
[6] 萌学同学2025年6月4日《 PS2修饰在小核酸药物研发中的突破与应用前景》
[7] 书海里的鱼儿2025年4月14日《PS2修饰技术在核酸药物中的广泛应用与创新》
[8] 浩悦资本浩悦资本生物医药组《蓬勃发展的小核酸药物,迈入常见慢性病,引领研发新浪潮》
[9] 经济参考报http://www.jjckb.cn/2022-01/10/c_1310417259.htm
[10] 健元医药 药融圈 2022年12月28日《小核酸药物的基石—核苷单体》
[11] 微信公众号合理用药百科2023年11月17日《三大核心技术助力! siRNA药物实现超长药效》
[12] TiPLab -《siRNA化学修饰的专利保护—序》http://www.tip-lab.com/article/?uuid=d99406dfb9f74acc9aec3b21654c9752
[13] Natt 2020-04-16 《这个纳米药物一年挣十个亿!命途多舛的诺奖技术,沉寂20年后王者归来!》http://m.nanoer.net/main/view?id=17848
[14] 中国生化制药工业协会2024年8月8日核酸药物专栏 | 化学合成寡核苷酸原料药所用起始物料的药学研究
[15] 肖肖医药行业研究报告 2025年08月19日《一文了解小核酸药物市场现状,哪些企业正在推进“现代制药第三次浪潮”》
[16] 刘珂瑶,罗应楠,胡一雪,王东纳,张列峰.siRNA 无载体递送研究进展[J/OL].南京师大学报自然科学版.
[17] 瞪羚社 作者Kris.医药时间 2024年06月12日《40 余年浮沉,小核酸药物厚积薄发》
[18] 黄新新. RNAi药物研究进展 [J]. 中国处方药, 2021, 19 (09): 19-20.
[19] 德奥平生物 2023-06-15 《体外诊断IVD-特殊蛋白及小分子原料的专业提供商》
[20] 李锦潮肖斌宣俊峰孙朝晖李林海等 中华检验医学杂志 2022年06月07日《多重核酸检测技术的临床应用现状及未来》2022,45(4) : 428-432
[21] 点慈阵 2021年09月12日《全球首个杜氏肌营养不良新药eteplirsen的专利布局》
[22] Nan, Y. et al. Antisense Phosphorodiamidate Morpholino Oligomers as Novel Antiviral Compounds. Front. Microbiol. 2018, 9. https://doi.org/10.3389/fmicb.2018.00750
[23] Aysha S. Ansari1 , Paul J. Santerre2 , and Hasan Uludağ 1,3,4,* Biomaterials for Polynucleotide Delivery to Anchorage-Independent Cells DOI: 10.1039/C7TB01833A
[24] Moizza Mansoor and Alirio J. Melendez Gene Regulation and Systems Biology 2008:2 275–295 Advances in Antisense Oligonucleotide Development for Target Identifi cation, Validation, and as Novel Therapeutics http://creativecommons.org/licenses/by/3.0/.
[25] Carlo Rinaldi and Matthew J. A. Wood Antisense oligonucleotides: the next frontier for treatment of neurological disorders doi:10.1038/nrneurol.2017.148
[26] Thomas C. Roberts Robert Langer and Matthew J. A. Wood Advances in oligonucleotide drug delivery doi.org/10.1038/s41573-020-0075-7
[27] Yuchen Nan and Yan-Jin Zhang Antisense Phosphorodiamidate Morpholino Oligomers as Novel Antiviral Compounds doi: 10.3389/fmicb.2018.00750
[28]百度百科\科普中国\科学百科

来源:药事纵横


