您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-08-28 19:43
摘要
目的: 与传统的微晶剂型相比,基于微球技术的阿立哌唑长效注射剂(long-acting injectable for mulation,LAI)旨在提高生物利用度并减少总剂量。本研究旨在评估2种剂型的药动学特征和生物等效性,并评估阿立哌唑微球长效制剂对稳定期精神分裂症患者的疗效和安全性。
方法: 本研究为一项多中心随机开放标签临床试验,共纳入260例稳定期精神分裂症患者。受试者按2∶2∶1的比例随机分配,分别每4周注射1次微球制剂350mg(MS 350mg)或对照制剂400mg(AM 400mg)共5次注射; 或每6周注射1次500mg微球制剂(MS 500mg)共4次注射。主要目的是评估稳态生物等效性(AUC0-d28)和血浆浓度的波动程度。采用阳性和阴性症状量表(positive and negative symptom scale,PANSS)评分评估疗效,安全性结果评估包括治疗出现的不良事件(treatment-emergent adverse events,TEAEs)和药物不良反应(adverse drug reactions,ADRs)。
结果: MS 350mg制剂与AM 400mg制剂具有生物等效性。两组在第1次注射后第12周、第20周和第24周的PANSS评分均较基线显著降低,组间无显著差异。MS 350mg组血药浓度波动程度较低,表明其药物暴露谱更为稳定。MS350mg组的TEAEs(75.7% vs 54.4%)及ADRs(83.5% vs 62.1%)发生率均低于AM 400mg组。
结论: 微球制剂与微晶制剂具有生物等效性,可持续改善患者症状,血浆波动更小且安全性更优。这些研究结果支持微球制剂作为精神分裂症长期治疗的可行方案。
关键词
阿立哌唑微球; 长效注射剂; 药动学; 疗效; 安全性; 波动度
精神分裂症是一种严重的慢性精神疾病,全球终生患病率约为0.7%~1%[1-4]。中国人群研究显示,城市地区的终生患病率从1990年的0.39%升至2010年的0.83%[5],增加了1倍。精神分裂症通常在成年早期表现,其特征为阳性精神病症状(如幻觉、妄想或紧张性行为)或阴性症状(如动机减少和认知障碍),被认为是世界上致残率最高的疾病之一,超过一半的精神分裂症患者有多种其他合并症[6]。
阿立哌唑是一种广泛应用于精神分裂症治疗的药物[7-8]。与传统的抗精神病药不同,阿立哌唑作为多巴胺系统稳定剂,对多巴胺D2受体和5-羟色胺1A(5-hydroxytryptamine 1A,5-HT1A)受体具有部分激动作用,以及对5-HT2A受体有拮抗作用[9-10]。其独特的作用机制有助于降低锥体外系症状(extrapy ramidal symptoms,EPS)的发生率,同时有效控制病情[11-12]。多巴胺D2受体占有率已被认为是抗精神病药物疗效的关键决定因素[13]。患者水平的神经受体影像学荟萃分析表明,抗精神病药物的疗效与颞叶皮质和纹状体的结合相关,而EPS主要与纹状体多巴胺受体的结合相关[14]。因此,抗精神病药血浆浓度的波动可能导致D2受体结合率的变化,进而引发症状控制不稳定或不良反应增加[15]。
尽管口服阿立哌唑具有临床应用价值,但其因为广泛的首过效应和P-糖蛋白外排作用以及较差的水溶性而导致生物利用度较低[16-17]。为了达到治疗浓度,需要较高的口服剂量,可能增加剂量依赖性不良反应的风险。此外,每日给药可能加剧血浆浓度的波动影响疗效[18]。为了解决这些问题,阿立哌唑长效注射剂(long-acting injectable formulation,LAI)应运而生。大冢制药公司和灵北公司联合开发的Abilify MaintenaⓇ利用微晶悬浮技术实现阿立哌唑的缓释[19],2013年获得美国FDA批准,该药物可提高用药依从性、降低复发率并可稳定控制症状[20]。然而,与其他长效制剂类似,其血浆浓度仍存在波动,提示需要进一步优化药物释放特征以增强血浆浓度的稳定性,从而更好地进行长期疾病管理。
本研究评估的注射用阿立哌唑微球是一种新型长效肌内给药制剂,旨在优化给药间隔内的药物释放,减少峰谷浓度波动。此外,该制剂通过提高微球制剂的生物利用度,将剂量从400mg·4周-1(Abilify MaintenaⓇ)降至350mg·4周-1。这种新制剂旨在增强阿立哌唑的药动学(pharmacokinetics,PK)稳定性,为精神分裂症管理提供一种可能更优的长效制剂。综上所述,本研究旨在研究注射用阿立哌唑微球制剂的PK特征,并评估其在精神分裂症患者中的安全性和有效性。
对象与方法
1 临床试验设计和受试者
该研究是一项在中国16个中心开展的多中心开放标签随机阳性对照临床试验。本研究在所有参与研究的试验机构均提交了伦理委员会并通过伦理审查以及获得批件[伦理审查批号: (2021)临审(79)号2121138FS-2],获得了所有参与试验患者的知情同意并签署了纸质知情同意书。
入组标准: 年龄18~64岁,体重指数(body mass index,BMI) 18.5~35.0kg·m-2,体重≥45kg(女性)或≥50kg(男性),被诊断为精神分裂症且病情稳定[筛选期及基线访视期阳性和阴性症状量表(positive and negative symptom scale,PANSS)评分≤70],并接受过至少4周的口服抗精神病药治疗(不包括氯氮平、氯丙嗪、氟哌啶醇和硫利达嗪)。该研究在筛选期,受试者被调整为阿立哌唑片(安律凡Ⓡ,浙江大冢制药有限公司,中国)每日10mg的治疗方案,允许联合使用不超过1种其他抗精神病药物,该治疗至少持续14d。
排除标准: 合并《精神疾病诊断与统计手册》(Diagnostic and Statistical Manual of Mental Disor ders,DSM-IV-TR)诊断标准确认的其他精神障碍者(精神分裂症除外); 实验室检查指标异常,包括总胆红素或肌酐水平>1.5倍正常值上限(upper limit of normal,ULN),谷丙转氨酶(alanine aminotrans ferase,ALT)或谷草转氨酶(aspartate aminotrans ferase,AST)>2倍ULN; 用药史不符者,首次给药前4周内使用过氯氮平、氯丙嗪、氟哌啶醇或硫利达嗪,入组前2周内使用过细胞色素酶P450(cyto chrome P450,CYP450)/CYP3A4/CYP2D6抑制剂或诱导剂,入组前2周内服用过处方类中药制剂,研究启动前1年内接受过长效阿立哌唑注射剂(含试验药及对照制剂)治疗; 合并未控制或不稳定的系统性疾病者,包括心血管、内分泌、呼吸系统、血液系统或免疫系统疾病,或者研究者判断不适合参与本研究的其他疾病。
2 试验药物(investigational medicinal product,IMP)
IMP为注射用阿立哌唑微球(400mg·支-1,丽珠医药集团股份有限公司,中国); 对照药物为Abilify MaintenaⓇ(阿立哌唑注射液,400mg·支-1,大冢制药株式会社有限公司,日本)。
3 随机化和盲法
符合条件的受试者按2∶2∶1的比例随机分配到3种治疗方案中的一种: MS350mg(注射用阿立哌唑微球,350mg·4周-1)、AM 400mg(Ability MaintenaⓇ,400mg·4周-1)和MS 500mg(注射用阿立哌唑微球,500mg·6周-1)。采用区组随机(区组大小10),根据CYP2D6基因型分层,统计人员不参与受试者的选择、招募和随机化。随机化过程由各研究中心通过集中系统(中国泰美医疗科技株式会社有限公司eBalance)进行。研究者和患者非盲,但进行分析的研究者对患者分配情况不知情。
4 试验设计
MS350mg组患者与对照AM 400mg组每4周接受1次肌内注射,即在d1,d29,d57,d85和d113共接受5次肌内注射。MS500mg组每6周接受1次肌内注射,分别于d1,d43,d85,d127共接受4次肌内注射。MS 350mg和AM 400mg组采集29个时间点的血样,分别为: 第1次注射(d1)的给药前1h、给药后4h,12h,d2,d4,d6,d8,d12,d15,d22; 第2~4次注射(d29,d57,d85)分别在给药前1h内和给药后d14采集血样; 第5次注射(d113)的给药前1h、给药后4h,12h,d2,d4,d6,d8,d12,d15,d22,d29,d43,d57采集血样。MS 500mg组采集31个时间点的血样,分别为: 第1次注射(d1)的给药前1h、给药后4h,12h,d2,d4,d6,d8,d12,d15,d22,d29,d36; 第2~3次注射(d43,85)分别于给药前1h内、给药后d14,d28采集静脉血; 第4次注射(d127)给药前1h,给药后4h,12h,d2,d4,d6,d8,d12,d15,d22,d29,d36,d43采集血样。
血样在室温下采集于EDTA-K2管中,并在采集后120min内离心。4℃、1500×g条件下离心15min后,分离、收集血浆,-70℃保存直至分析。血浆样本由获得《药物临床试验质量管理规范》(Good La boratory Practice,GLP)认证的无锡药明康德新药开发股份有限公司(中国上海)进行集中分析,采用经过验证的LC-MS/MS方法测定阿立哌唑的浓度[21]。
5 指标和统计学方法
5.1 PK评价和安全性分析
采用非房室模型(non-compartmental model,NCA)计算阿立哌唑的PK参数。这些参数包括稳态血浆峰浓度(steady-state peak plasma concentration,Cmax,ss)、稳态血浆谷浓度(steady-state trough plasma concentration,Cmin,ss)和从零时(给药前)至第5次注射后28d的AUC0-28d,ss。使用Phoenix WinNolinTM软件(8.3.4版,Certara,Inc,美国)对自然对数转化后的Cmax,ss和AUC0-28d,ss进行汇总分析,计算几何均值比及其90%置信区间(confidence interval,CI),如在等效性区间(80.00%~125.00%)之内,则判断为生物等效。在安全性分析中,记录整个研究期间的不良事件,根据监管活动医学词典(medical dictionary for regulatory activities,MedDRA)编码,并采用不良事件通用术语评价标准(common terminology criteria for adverse events,CTCAE) 5.0版进行严重程度分类[22]。
5.2 血浆浓度波动
对血浆浓度波动程度(degree of fluctuation,DF)及峰谷波动幅度(Swing)进行描述性分析,计算获得的算术均值、几何均值、变异系数、标准差、四分位数及极值均以表格形式呈现。此外,根据CYP2D6表型(弱代谢型、正常代谢型、中间代谢型、超快代谢型)进行了分层描述性分析。本试验未进行推论性统计分析。第1次注射的DF和Swing由下式(1)和式(2)计算:
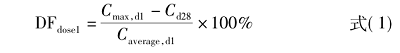
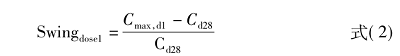
对最后一次注射进行了类似的DF和Swing计算。对于第2~5次给药,由于稀疏采样无法计算阿立哌唑的平均浓度,仅计算Swing。
5.3 有效性分析
主要疗效终点为PANSS总分及临床总体印象-严重程度量表(clinical global impression-severity,CGI-S)评分。在首次给药后每4或6周进行量表评分,并以基线值为基准评估其变化。在第12,20及24周时进行三组间的治疗差异比较。
采用协方差分析(analyses of covariance,ANCOVA)评估各访视点的组间差异,以最小二乘均值差及其95%CI汇总呈现组间比较结果,并计算各治疗组较基线的变化值。模型中,以PANSS及CGI-S评分较基线的变化幅度作为因变量,将基线人口学资料及临床指标纳入协变量,治疗组别设置为固定效应。
采用混合效应模型重复测量法(mixed-effect model for repeated measures,MMRM)评估组间效应,以各访视点的组间最小二乘均值(least square means,LSM)差异及其95%CI呈现比较结果。该模型以基线变化值作为因变量(结局指标),未进行数据填补[23]。模型设定中,固定效应包括治疗组别、访视时间点及组别-时间交互项,基线测量值作为协变量校正初始差异,研究中心设置为随机效应。组间比较以AM 400mg组为对照组。鉴于本疗效分析为探索性分析,未对Ⅰ类错误进行校正,所有比较均采用双侧检验显著性水平(α=0.05)。
5.4 样本量计算
本研究的样本量根据生物等效性和临床疗效评价2个研究目标确定。MS350mg组与AM 400mg组生物等效性评价的主要PK终点为AUC0-28d,ss。设定α为0.05,统计效能为80%,受试者间变异系数为40%,计算出每组需要65例受试者的样本量。在调整15%的脱落率后,每组需要76例受试者的最终样本量,MS 500mg组需要38例受试者,总计190例受试者。另外,对于临床疗效评估,采用单侧非劣效性检验(α为0.025,统计效能为90%),非劣效性界值设定为80%,对照组的预期疗效设定为92%,计算出每组所需的样本量为89例受试者。在15%的脱落率下,每组需要104例受试者,MS 500mg/6周组需要52例受试者,总共260例参与者。最终,本研究共纳入260例受试者以满足统计学要求。
结果
1 受试者信息
本研究共纳入符合条件的144例男性受试者和116例女性受试者。受试者的基线特征见表1。基于意向治疗(intention-to-treat,ITT)人群分析,各组在性别、年龄、体重、BMI和CYP2D6基因多态性等基线特征上均具有可比性。
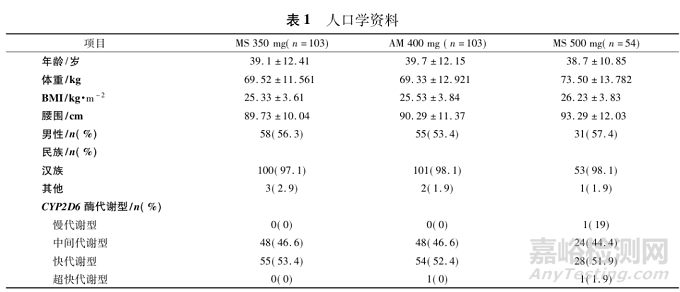
2 稳态PK特征
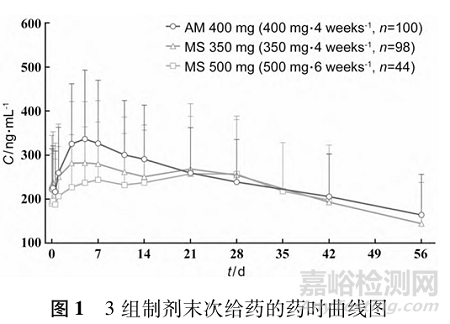
MS350mg组和AM 400mg组第3~5次注射后阿立哌唑谷浓度的线性回归显示,拟合的斜率(95%CI)分别为-0.027(-0.078~0.025)和0.023(-0.017~0.062),表明在给药前血浆浓度已达到稳态。末次给药后的药时曲线见图1,PK参数见表2。最后1次(第5次)给药后,MS350mg组与AM 400mg组之间对数转化的Cmax,ss的几何均值比值和95%CI为92.72%(84.27%~102.01%)。两组间的AUC0-28d,ss几何均值比值为91.14%(83.31%~99.57%),符合80.00%~125.00%的生物等效性范围(见表3),表明注射用阿立哌唑微球(350mg)的与Abilify MaintenaⓇ生物等效。
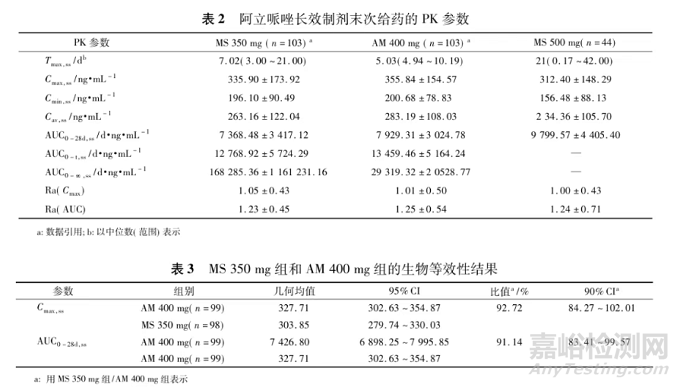
3 稳态浓度的波动
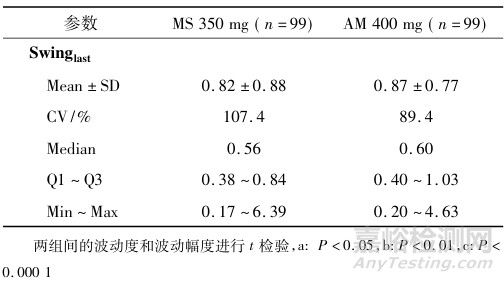
MS350mg组首次给药后DF为(88.89±35.43)%,Swing为(1.84±1.28),末次给药后稳态DF为(52.00±33.32)%,Swing为(0.82±0.88)。而AM400mg组的首次的波动度和波动幅度为(114.15±51.09)%和(3.19±3.79),末次给药的DF和Swing分别为(53.26±30.85)%和(0.87±0.77),见表4。MS350mg组在前4次给药期间的血药浓度波动均低于AM 400mg组,最后一次给药后两组达到稳态,血药浓度波动接近。

4 安全性分析
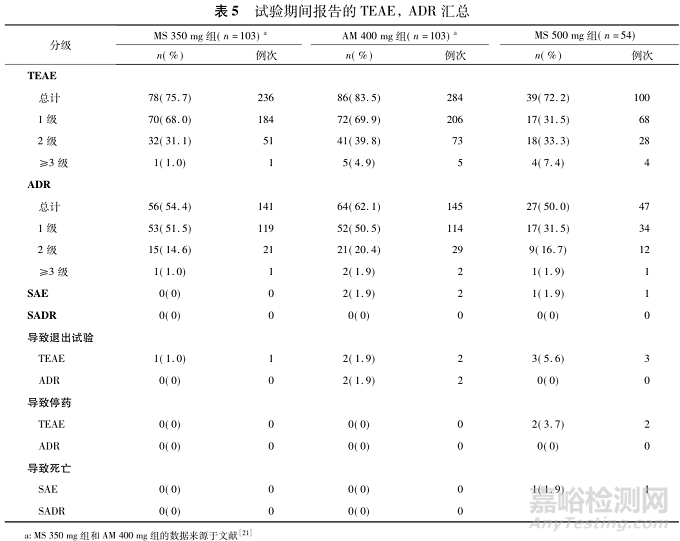
在ITT人群中,MS 350mg组和MS 500mg组治疗出现的不良事件(treatment-emergent adverse events,TEAEs)和药物不良反应(adverse drug reactions,ADRs)的发生率低于AM 400mg组(75.7%和72.2%vs83.5%,54.4%和50.0%vs62.1%)。值得注意的是,大多数TEAEs的严重程度为1~2级,在MS350mg组和AM 400mg组中,3级及以上的TEAEs发生率分别为1.0%和4.9%,MS500mg组为7.4%。MS 350mg组、MS 500mg组和AM4 00mg组因TEAEs导致退出研究的发生率分别为1.0%,5.6%和1.9%。
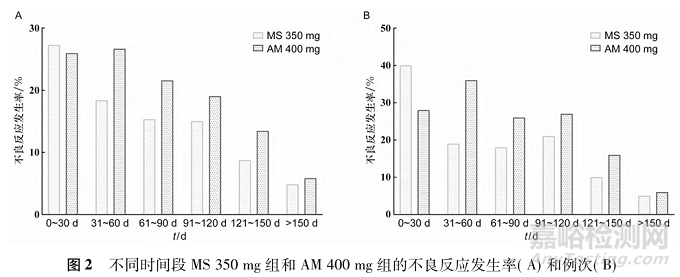
MS 350mg组未报告严重不良事件(serious adverse event,SAE)。MS 500mg组报告1例SAE病例(1.9%,溺死),但与治疗无关。在AM 400mg组中,报告了2例SAE病例(1.9%,用药过量和精神分裂症),与药物无关。在≥3级不良反应方面,MS 350mg组报告了1例(1.0%,体重增加),AM 400mg组报告了2例(1.9%,体重增加和肝功能异常),MS 500mg组报告1例(1.9%,体重增加)。MS 350mg组和MS 500mg组没有受试者因严重不良反应退出研究,而AM 400mg组有2例受试者退出研究。安全事件的详细分类见表5。对各个给药周期的不良反应分别进行统计,从第2次给药至试验结束,MS350mg组的不良反应发生率低于AM 400mg组,见图2。
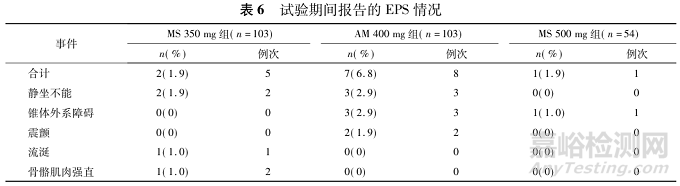
EPS是使用阿立哌唑可能出现的不良反应,包括静坐不能、震颤、流涎和骨骼肌肉强直等。3个治疗组的EPS发生率分析结果表明,与AM400mg组(6.8%)相比,MS350mg组和MS500mg组的EPS相关不良事件发生率(均为1.9%)较低(见表6)。总体而言,与对照组AM400mg相比,MS350mg组与MS500mg组的EPS总发生率较低。综上,微球制剂具有良好的安全性。
5 有效性分析
基于IIT人群,3组患者在试验期间PANSS总分和CGI-S评分较基线变化的趋势一致,均呈下降趋势,见表7。采用ANCOVA评估治疗后12,20,24周的PANSS总分变化,各组间差异无统计学意义(P值分别为0.745,0.909,0.775)。然而,经基线协变量校正后,PANSS总分较基线变化的LSM均有统计学意义,表明组内有明显的疗效改善。同样,MMRM的纵向分析也表明,与基线相比,各访视点的PANSS总分有显著差异(P<0.001),但组间差异无统计学意义(P=0.928),组别与访视点之间无交互作用(P=0.393)。
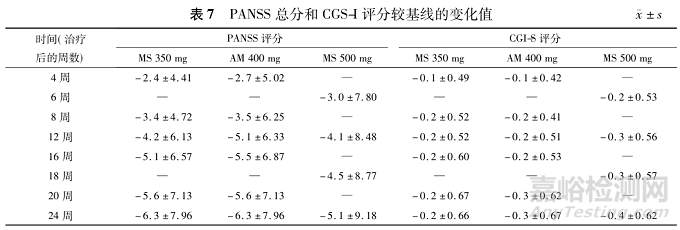
此外,在几乎所有的随访中,3组的PANSS分量表评分(阳性症状、阴性症状和一般精神病理)均呈一致下降趋势,但组间差异无统计学意义。通过比较各组相同时间点较基线的LSM变化,结果显示所有时间点的组间差异均无统计学意义(P>0.05),表明MS 350mg组与AM 400mg组疗效相当。在整个治疗期间,3组的PANSS总分及各分量表评分均持续降低,且所有访视点的改善幅度相近。
CGI-S评分也观察到类似结果。与基线相比,3组患者在第12,20和24周的疾病严重程度变化显著不同,但未检测到组间差异。这些结果表明,微球制剂(350和500mg)与对照制剂疗效相当,可持续改善稳定期精神分裂症患者的整体症状。
讨论
本研究表明,新型注射用阿立哌唑微球制剂与AbilifyMaintenaⓇ具有生物等效性,并且对于稳定型精神分裂症患者具有相当的疗效。初步疗效结果表明,MS350mg制剂在PANSS总分和分量表评分均有一致的改善,与Abilify MaintenaⓇ相比,其剂量较低,但在整个治疗期间症状持续减轻。这些结果对精神分裂症的管理具有重要的临床意义。
注射用阿立哌唑微球是一种新型的LAI,旨在提高阿立哌唑的生物利用度。本研究的PK结果表明,350mg注射用阿立哌唑微球与Abilify MaintenaⓇ在首次和最后一次给药后具有相似的释放特征。MS 350mg/AM 400mg的Cmax,ss和AUC0-28d的几何均值比值在生物等效性范围内,但与对照药物相比,MS350mg组的峰谷浓度波动明显较小。此外,在整个给药期间,注射用阿立哌唑微球制剂的平均血药浓度一直保持在治疗窗口内(94.0~534ng·mL-1)[24],表明可以更好地控制潜在的药物突释,从而使治疗期间的血浆水平更加稳定。
精神分裂症是一种慢性精神疾病,其特征是阳性症状(如幻觉和妄想)、阴性症状(如社交退缩)和一般精神病理学症状(如认知障碍)。长效抗精神病制剂对于提高患者的用药依从性和预防复发至关重要。目前,抗精神病药物的耐受性和不良反应仍然是影响治疗依从性的最大障碍。因此,努力提高生物利用度,以减少潜在的不良反应及最大限度地减少药物浓度的波动变得至关重要。
对ITT人群的分析表明,当与另一种抗精神病药物(主要是奥氮平、利培酮或氨磺必利)联合使用时,从基线期到第20周,MS 350mg,MS 500mg和AM 400mg在PANSS总分和CGI-S评分的平均变化方面没有显著差异。然而,在不同的访视点检测到显著差异,表明注射用阿立哌唑微球有进一步改善稳定精神分裂症患者的整体症状和降低疾病严重程度的潜力。MS 350mg组和MS 500mg组的PANSS分量表评分(阳性和阴性症状,以及一般精神病理)的降低也表明,不同症状均有改善,与Abilify MaintenaⓇ400mg的疗效相当,敏感性分析也显示了类似的结果。从基线期到第24周,两组患者的PANSS总分和CGI-S评分均呈下降趋势,各组间差异无统计学意义。
MS 350mg组的血浆浓度波动更小,将产生较小的多巴胺D2受体占有率波动,这已被证明可改善药效学结局,并降低EPS和其他不良事件的风险[25-27]。综上所述,这些因素可能会增强患者的耐受性并提高长期治疗依从性。治疗药物监测建议指出,长效抗精神病药物的峰谷波动应小于2倍,以实现疗效与耐受性的平衡[25]。微球制剂不仅达到该标准,且与Abilify MaintenaⓇ相比,其首次给药后及稳态时的百分比波动、波动幅度及峰谷比均更低。相较于典型长效制剂,MS 350mg每4周1次的给药方案展现出更一致的药物释放曲线,这可能是其临床优势的潜在机制。从末次给药的药时曲线上来看(见图1),MS 500mg组最后一次给药后的血药浓度更为平稳,具有潜在的血药浓度波动小的优势,同时该给药方案延长了给药间隔,具有更好的依从性。
Ablify MaintenaⓇⅢ期临床研究[20]中最常见的EPS相关不良事件为静坐不能(6.3%,36/576),其次是震颤(3.6%,21/576),本研究中MS 350mg,MS 500mg组和AM 400mg组静坐不能的发生率分别为1.9%,0%和2.9%,震颤的发生率分别为0%,0%和1.9%,注射用阿立哌唑微球2个剂量组均低于Ailify MaintenaⓇ及相应历史数据。这说明微球制剂良好的PK特征可转化为几个优势,较低的血浆峰值浓度有可能降低通常与高药物浓度相关的不良反应(如镇静和静坐不能)的风险。同样,较高的谷浓度也有助于维持D2受体的占有率,从而降低复发机会。PK特征表明,注射用阿立哌唑微球制剂特别适合于更容易出现剂量相关不良反应的患者。
在安全性方面,与Abilify MaintenaⓇ相比,微球制剂的TEAEs和ADRs发生率较低,SAE也较少。这一结果可能与微球制剂较低的浓度依赖性不良反应与其相对稳定的PK特征相关。研究观察到MS 350mg组的临床结局有显著改善,尤其是PANSS各分量表评分的全面下降,进一步证实了该制剂在改善精神分裂症广泛症状中的临床价值。结合持久的症状改善与更优的安全性特征,注射用阿立哌唑微球可作为精神分裂症长期管理的安全有效治疗方案,尤其适用于对高剂量不耐受或长期治疗依从性不佳的患者群体。
该研究表明,新型长效微球注射剂与微晶制剂(Abilify MaintenaⓇ)具有生物等效性,且可持续改善稳定期精神分裂症患者的症状。此外,微球制剂具有稳定的PK特征和较低的血药浓度波动度,这可能有助于提高耐受性并减少与剂量相关不良反应,且研究结果也表明微球制剂的不良反应发生率更低。这些研究结果表明,阿立哌唑微球制剂可为患者提供安全有效的治疗方案。

来源:Internet


