水凝胶微针的药物释放行为是其实现精准治疗的核心指标——既要实现药物在靶部位的有效累积,又需通过可控释放维持治疗浓度,避免毒副作用。本期,EFL团队结合8篇用户案例,梳理水凝胶微针药物释放行为的关键表征方法,附具体文献图表及实验结果,为相关研究者提供参考。
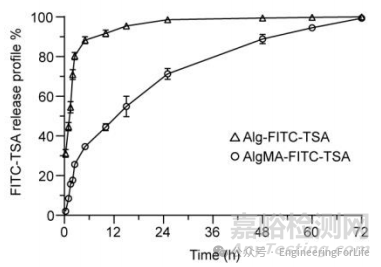
案例1:《ACS Applied Materials & Interfaces》:AI辅助挖掘的TSA药物通过AlgMA微针的可控释放用于糖尿病伤口愈合
实验方法:研究者采用Franz扩散池模型模拟皮肤环境,以荧光标记的FITC-TSA 作为药物示踪剂,将 AlgMA微针(载 TSA)置于含80%水的戊二醛交联明胶膜上,模拟皮肤屏障。通过监测不同时间点接收池中的荧光强度,计算药物释放量,绘制释放曲线。
实验结果:AlgMA微针展现出缓慢释放特性,1小时内释放约8%,24小时释放不足75%,完全释放需近72小时;而未改性的Alg微针1小时释放超40%,24小时几乎完全释放(99%)。这表明AlgMA的交联网络结构有效延缓了药物释放,满足糖尿病伤口长期治疗需求。 DOI: 10.1021/acsami.2c08994
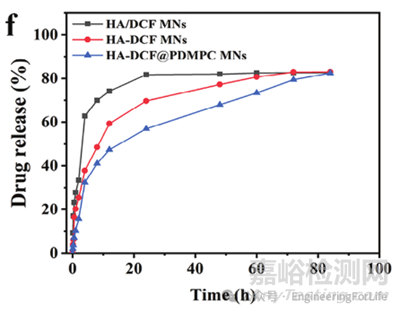
案例2:《Small》:双层润滑微针(HA-DCF@PDMPC)的多级缓释行为表征
实验方法:采用 Franz transdermal 扩散池,将含双氯芬酸(DCF)的不同微针(HA/DCF MNs、HA-DCF MNs、HA-DCF@PDMPC MNs)穿刺大鼠皮肤,受体池为含0.5% Tween 20的 PBS(pH 7.4)。通过UV-vis分光光度计在特征波长检测DCF浓度,计算累积释放率。
实验结果:HA/DCF MNs(物理混合)24 小时累积释放达81.75%,释放过快;HA-DCF MNs(共价结合)24小时释放72%,缓释效果提升;HA-DCF@PDMPC MNs(含润滑涂层)84 小时累积释放仅52%,因涂层阻碍和酯键水解双重作用实现多级缓释,更适配骨关节炎的长期抗炎需求。 DOI: 10.1002/smll.202307281
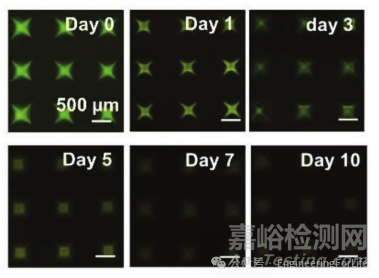
案例3:《Advanced Functional Materials》:MOF-姜黄素复合微针的药物释放动力学
实验方法:以荧光染料替代药物分子嵌入SilMA微针针尖,将微针浸泡于 PBS(pH 7.0)中,在不同时间点通过荧光显微镜观察针尖荧光强度变化,结合图像分析软件量化荧光衰减速率,间接反映药物释放趋势。
实验结果:荧光强度随浸泡时间逐渐降低,1天时荧光明显减弱,7天时仅残留少量荧光,10天时几乎完全消失,表明药物从SilMA微针中持续释放。
DOI: 10.1002/adfm.202315067
案例4:《International Journal of Biological Macromolecules》:GelMA微针负载3D-MSC 外泌体的长效释放评估
实验方法:采用小动物成像系统,对 PKH67 荧光标记的3D-MSC 外泌体(3D-Exo)进行追踪。将载 3D-Exo的GelMA微针置于PBS中,每日监测荧光强度变化,直至无荧光信号,记录释放持续时间。
实验结果:微针释放的外泌体荧光信号可维持近1周,前3天释放量逐渐增加,第4天达峰值后缓慢下降,表明GelMA的网络结构为外泌体提供了保护,实现长效释放,满足脑缺血再灌注损伤的长期修复需求。
DOI:10.1016/j.ijbiomac.2024.133336
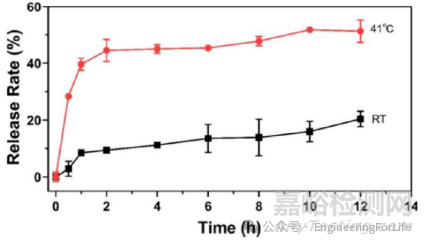
案例5:《Nano Letters》:光热响应共轭聚合物微针(CPNM/F@MN)的按需释放行为
实验方法:以米诺环素为模型药物,将微针置于41℃水中(模拟NIR照射后的体温环境),通过UV-vis分光光度计检测395nm处的吸光度,计算不同时间的药物释放量。同时设置无 NIR 照射组作为对照。
实验结果:NIR 照射下(808nm,0.5 W/cm²),微针1小时释放约25%,2小时释放40%,因 DPPC(相变温度 41℃)在高温下坍塌促进药物释放;无NIR组释放速率显著降低,表明该系统可通过光热刺激实现药物按需释放,精准清除糖尿病伤口的生物膜。
DOI: 10.1021/acs.nanolett.4c06284
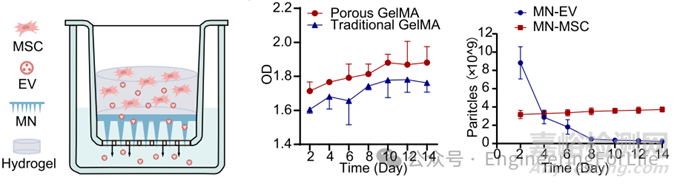
案例 6:《Nature Communications》:多孔GelMA微针的细胞外囊泡(EVs)持续释放特性
实验方法:为评估多孔结构的微针贴片释放MSC - EV(间充质干细胞分泌的细胞外囊泡)的能力,将由多孔GelMA或常规GelMA 制成且植入了MSC的微针贴片,放置在Transwell 的上腔室。通过检测样品光密度(OD),来分析不同类型贴片对MSC分泌组释放情况的差异。
实验结果:从光密度图谱可知,由多孔GelMA制成的微针贴片释放MSC分泌组的效率更高,推测原因是其较大的孔径对MSC分泌组具有更强的渗透性。而释放趋势差异图中,装载MSC - EV的微针贴片,其MSC - EV的释放在前4天内迅速下降;相比之下,接种了MSC的微针贴片,其MSC - EV的释放较为稳定,在2周时还略有增加。这表明多孔微针贴片具有良好的生物相容性,能够让间充质干细胞存活,从而成功构建了一种可持续且高效递送MSC - EV的装置。
DOI: 10.1038/s41467-023-39745-2
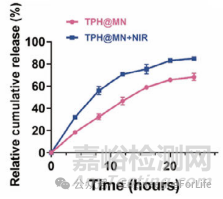
案例7:《Small Structures》:光热水凝胶微针(TPH@MN)的牛磺酸释放行为
实验方法:研究者采用体外释放实验,将TPH@MN分别置于 pH 6.0的酸性PBS溶液中,其中一组施加808 nm近红外光(1.0 W/cm²)照射,通过高效液相色谱法测定不同时间点溶液中牛磺酸的浓度,计算累积释放率并绘制释放曲线。
实验结果:在酸性环境中,TPH@MN 组24小时内牛磺酸相对释放率约为60%;而 TPH@MN+NIR 组在光热作用下,24小时内释放率可达80%。光热效应通过促进HAMA水凝胶网络的溶胀和降解,显著加速了牛磺酸的释放,实现了响应性药物释放调控,适配软组织损伤部位的酸性微环境和按需治疗需求。
DOI: 10.1002/sstr.202470023
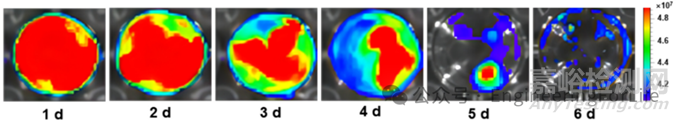
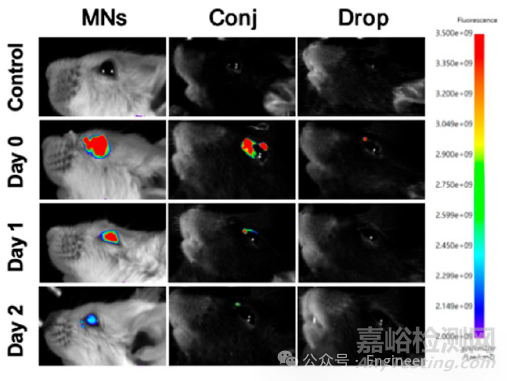
案例8:《ACS Nano》:负载aT-Exo的PVA水凝胶微针的药物释放行为
实验方法:利用活体小动物成像系统,将CM-DID标记的aT-Exo分别通过 PVA 微针(MNs 组)、结膜下注射(Conj组)和滴眼(Drop组)三种方式给药,监测不同时间点眼部的荧光信号强度,评估 aT-Exo 的体内释放和滞留情况。
实验结果:体内成像显示,MNs组在给药后2天仍能检测到较强的荧光信号,而Conj组和 Drop 组荧光信号在1天内显著衰减,表明PVA水凝胶微针实现了aT-Exo的长效释放。
DOI: 10.1021/acsnano.4c00423
EFL Tips:
测试方法:常用Franz扩散池(模拟皮肤屏障)、Transwell系统(模拟组织微环境)、荧光追踪(可视化释放过程)、UV-vis/BCA 试剂盒(量化释放量)等。
关键指标:需关注累积释放率、释放速率、释放持续时间,匹配疾病治疗周期(如糖尿病伤口需7-14天,骨关节炎需数周)。
影响因素:材料交联度(如AlgMA vs Alg)、涂层修饰(如PDMPC 润滑层)、刺激响应性(如NIR触发)等会显著调控释放行为,可针对性优化。