您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-08-26 19:35
随着医疗美容行业的快速发展,以透明质酸、胶原蛋白及再生材料为代表的注射类医美产品凭借微创、见效快等优势,已成为市场主流,广泛应用于面部年轻化和轮廓修饰等领域。然而,由于这类产品需长期留存于人体或逐步降解,其安全性和有效性受到严格监管。根据国家药监局《医疗器械分类目录》,注射类医美产品被明确划分为高风险Ⅲ类医疗器械(分类编码13-09-02),注册审评需符合严格的技术标准[1]。作为生物学评价的核心环节,体外降解试验是评估产品降解特性、验证其临床安全性和合规性的关键依据。
什么是医疗器械体外降解?
医疗器械体外降解研究是指在实验室环境中模拟人体生理条件(如温度、pH值、酶环境等),通过体外试验评估医疗器械材料的降解特性(如质量损失、分子量变化、力学性能衰减、降解产物释放等)的过程。
为什么要做体外降解研究?
评估产品安全性
降解产物毒性:通过体外模拟降解过程,检测降解产物(单体、寡聚物、小分子化合物等)是否对细胞或组织有毒性。例如,某些填充剂降解过程可能产生酸性物质导致局部pH值下降,刺激组织。
体内残留风险:材料降解过慢甚至不降解,可能在体内形成异物,引发炎症、肉芽肿、结节等反应[2]。体外降解研究可通过模拟人体环境(温度、pH值、酶环境),评估材料的降解速率,确保其能按预期降解。例如,未交联的透明质酸因降解过快效果短暂,而过度交联的透明质酸可能降解过慢导致存在长期残留风险[3]。
评价产品有效性
匹配预期效果:不同产品需满足不同的效果持续时间(短效玻尿酸维持3~6个月,长效玻尿酸维持1~2年)。体外降解研究可通过控制pH值、温度、酶等条件,模拟产品在体内的降解速率,预测产品维持效果的时间。
指导临床应用:根据降解数据制定不同方案(补充注射、疗程间隔等)。例如,如胶原蛋白产品通常需每3~6个月补充;皮肤深层填充需慢降解材料,而浅层修复可能需快速代谢产品。
指导材料设计与优化产品配方
材料筛选:比较不同成分(如透明质酸、聚乳酸PLA、聚己内酯PCL)的降解特性,选择最适合目标用途的材料。
工艺优化:例如,透明质酸的交联度或聚左旋乳酸微球的粒径会显著影响降解速率[4,5],需通过体外降解实验确定最佳参数。
满足监管与合规要求
法规要求:各国监管部门(FDA、NMPA、CE-MDR)通常要求提交降解数据作为产品注册的核心资料,证明其符合安全标准。
标准化测试:体外降解实验(如酶解、水解测试)是国际通用的评估手段,便于横向对比同类产品或者验证产品的批次一致性。
预测体内行为与减少动物实验
模拟体内环境:通过体外条件(如37℃、pH 7.4缓冲液、酶等)初步模拟体内降解,减少早期研发中对动物模型的依赖,符合“3R原则”。
加速降解测试:通过高温或高浓度酶加速实验,快速评估长期降解特性,缩短研发周期。
揭示潜在风险与失效机制
非均匀降解:材料(如PCL)可能因结晶区与非结晶区差异导致局部降解过快[6],体外降解研究可提前发现此类问题。
力学性能变化:填充剂在降解过程中可能因结构塌陷失去支撑力,需通过体外力学测试评估。
哪些产品需要做体外降解研究?
根据相关标准[7,8,9],符合下列情况之一,应考虑降解研究:
1)医疗器械设计成可吸收的;或
2)器械预期植入体内超过30 d;
3)最终医疗器械被公认为在人体接触期间可能会释放毒性降解物质。
对于注射类医美产品而言,需要进行体外降解研究的主要包括:透明质酸类(交联/非交联透明质酸钠)、胶原蛋白类(动物源/重组胶原蛋白)、再生材料类(聚左旋乳酸、聚己内酯等)等材料。
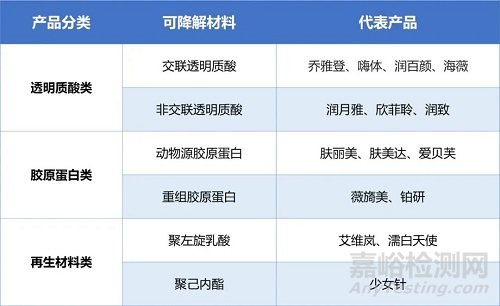
表1 中国Ⅲ类注射类医美产品(仅部分,具体见官网数据库)
案例分析
注射类再生针剂是近年来快速发展的一类创新型生物医学产品,通常采用微创方式将具有再生功能的生物活性物质注射到人体真皮层、皮下组织、筋膜层和肌肉层中,通过激活成纤维细胞、促进胶原蛋白和弹性纤维新生、改善局部微循环等方式,从而起到重塑紧致、美容抗衰作用。与传统填充剂相比,注射类再生针剂具有效果更自然持久、并发症风险更低等优势,其作用效果通常可持续1~5年,适用于面部年轻化、凹陷填充、瘢痕修复、毛发再生等医疗美容领域。这类产品的成分主要包括可降解高分子材料、生物大分子材料和生物活性因子。对于这类复合类型的再生试剂,需要分别对高分子材料和生物大分子材料进行体外降解研究,以评估不同组分的降解机理、降解速率的匹配性、降解产物的毒性以及降解过程中材料的形貌变化等。
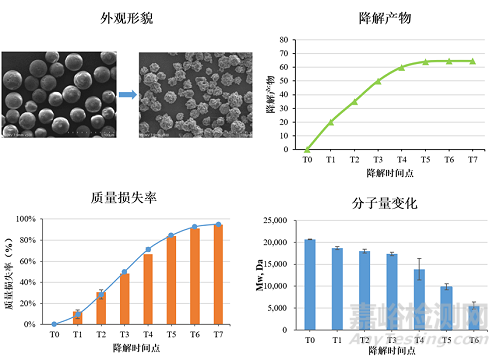
注射类再生针剂的体外降解研究

来源:药明康德医疗器械测试平


