您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-08-24 19:54
摘要
药物性肝损伤是药物研发和临床实践中面临的重要挑战之一,缺乏有效的防控措施。研究表明,药物性肝损伤主要由免疫反应介导。人类白细胞抗原(HLA)等位基因是目前报道与药物性肝损伤相关性最强的遗传因素。由于HLA等位基因的阳性预测值低,给药前HLA基因筛查对预防药物性肝损伤的临床转化价值有限;但其阴性预测值较高,在药物性肝损伤诊断和因果关系评估中具有重要的价值。近年来,抗原加工呈递通路、T细胞受体、免疫刺激分子、细胞因子等免疫相关基因多态性被发现与药物性肝损伤有关;未来将这些基因与HLA联合分析或许可加深药物性肝损伤机制的理解,同时推动其转化应用于临床来改善人类用药安全。
关键词
药物性肝损伤;人类白细胞抗原;免疫遗传;药物基因组学
1前言
药物性肝损伤(drug-induced liver injury,DI LI)是学术界、制药行业和监管部门面临的重大挑战之一,是导致药物开发终止、上市后退出市场和急性肝衰竭的主要原因。目前临床上,排除法是DILI的唯一诊断方法,但因多重用药、基础疾病及其他混杂因素的影响,这种方法并不准确可靠。因此,开发基于发病机制的特异性生物标志物预测、诊断和监测DILI发生发展已成为临床实践中亟需解决的问题。
根据药物作用机制和临床表现,DILI通常分为固有和特异质肝损伤[1]。前者肝损伤常见、可预测具有剂量依赖性,主要发生在药物过量时,并可在动物模型中重现并预测。此类损伤通常在减少剂量或停药后消失。相对而言,特异质肝损伤较为罕见,缺乏剂量依赖性,不可预测,且在临床试验中难以观察到,只在药物上市后大规模人群使用过程中才被发现[1]。值得关注的是,特异质DILI发生一般较为严重,个别患者需肝移植,甚至可能死亡。据统计,这一类肝损伤占美国急性肝衰竭病例的11%[2],而中国约5.6%的药物性肝损伤患者因急性肝衰竭而死亡或经受肝移植治疗[3]。
特异质药物性肝损伤因其罕见性和难以预测,缺乏有效的体内外模型,其机制尚不明确。研究表明,特异质药物性肝损伤主要由免疫介导[4]。全基因组关联研究证实,以人类白细胞抗原(human leukocyte antigen,HLA)为代表免疫相关基因的变异与药物性肝损伤关系密切,提示了免疫应答及其遗传变异在DILI发生发展中起重要作用。本文综述了DILI的免疫遗传变异及其在临床实践中的进展,为揭示DILI机制和制定预防策略提供了参考。
2免疫相关基因多态性与药物性肝损伤的关系
2.1 人类白细胞抗原
2.1.1 HLA基因多态性与药物性肝损伤的关系
HLA是目前已知人类基因组中多态性最丰富的基因。2002年首次发现HLA-B*57∶01与阿巴卡韦超敏反应有关以来,HLA在药物基因组学领域研究成果不断涌现。迄今报道有11个HLA等位基因纳入到FDA药物基因组学标签,用于指导个体化精准用药。越来越多证据表明,HLA等位基因与特异质药物肝损伤有关,这些发现使精准预测药物不良反应成为可能。据统计有25个以上药物引起的肝损伤与HLA相关,见Tab.1。




2.1.1.1 HLA与化学药物
化学药物是引起药物性肝损伤的首要原因。随着对HLA基因在药物性肝损伤中重要角色的认识越来越深入,近年来,被报道与药物性肝损伤相关的HLA基因数量逐渐增多,本部分将对其中的代表性药物及其相关HLA基因进行重点介绍。
氟氯西林是一种用于葡萄球菌感染治疗的药物,可导致胆汁淤积型肝损伤。在英国,氟氯西林是药物性黄疸的第二大原因,每100000例治疗患者中约有8.5例肝损伤。2009年一项关于51例氟氯西林肝损伤患者和282例对照人群的全基因组关联研究发现,HLA-B*57∶01与氟氯西林肝损伤密切相关,HLA-B*57∶01阳性携带者服用氟氯西林后发生肝损伤的风险增加80.6倍[5]。随后的一项纳入197例氟氯西林肝损伤患者的全基因组关联研究中确证了该位点为氟氯西林肝损伤的主要风险因子,并发现HLA-B*57∶03与氟氯西林肝损伤有关[6]。有趣的是,HLA-B*57∶01等位基因也是阿巴卡韦超敏反应的风险基因,表明同一等位基因可影响不同药物引起的不同特异质药物不良反应发生。
阿莫西林-克拉维酸是引起特异质药物性肝损伤常见的药物,占DILI相关住院病例的10%~13%[7]。早在1999年就鉴定了阿莫西林-克拉维酸肝毒性与HLA等位基因相关。Hautekeete在35例阿莫西林-克拉维酸肝毒性患者中发现HLA DRB1*15∶01-DRB5*01∶01-DQB1*06∶02单倍型频率更高,携带该单倍型的患者发生胆汁淤积型和混合型高于比肝细胞损伤型。O'Donohue在22例来自苏格兰的阿莫西林-克拉维酸肝毒性患者中研究发现,70%的患者携带HLA-DRB1*15∶01。Donaldson在40例阿莫西林-克拉维酸肝毒性患者中再次验证了HLA-DRB1*15与肝毒性风险增加有关;同时发现HLA-DRB1*07具有保护作用[8]。2011年在201例阿莫西林-克拉维酸肝毒性患者中进行全基因组关联研究再次验证了HLA-DRB1*15∶01-DQB1*06∶02的相关性,并发现新的等位基因HLA-A*02∶01和PTPN22基因中的rs2476601与阿莫西林-克拉维酸肝毒性有关,其中HLA-A*02∶01与DQB1*06∶02具有相互作用[9]。最近一项大规模人群病例中的全转录组关联和全基因组关联研究鉴定了新的与阿莫西林-克拉维酸肝毒性风险增加相关的ERAP2低表达和HLA-B*15∶18等位基因,并建立了包含5个等位基因的遗传风险评分模型,用于阿莫西林-克拉维酸肝毒性因果评估和风险管理[10]。
罗美昔布是一种选择性环氧合酶-2抑制剂,用于治疗骨关节炎和急性疼痛。由于其肝毒性而被撤出市场或不批准上市。Singer对罗美昔布肝损伤患者和对照人群进行了全基因组关联筛选和验证研究,结果显示,罗美昔布肝损伤与HLA-DRB1*15∶01、HLA-DQB1*06∶02、HLA-DRB5*01∶01、HLA-DQA1*01∶02显著相关,其中HLA DRB1*15∶01相关性最强。进一步评估这4个等位基因作为预测标志物的性能,结果显示,HLA DQA1*01∶02对罗美昔布肝损伤的预测性能最强,阴性预测值为99.0%,灵敏度为73.6%[11]。该研究表明,通过基因鉴定出肝损伤易感个体而排除罗美昔布治疗有望改善罗美昔布的安全性,提示HLA基因检测或许可助力罗美昔布重新上市。
希美加群用于治疗血栓栓塞,在给药35天以上的患者中,6%~13%的患者出现肝转氨酶升高。北欧人群肝损伤发病率比亚洲人群更高,2006年因肝毒性而终止了希美加群的临床开发。Kindmark对74例希美加群肝损伤和130例耐受患者进行全基因组关联和大规模候选基因分析发现,HLA-DRB1*07和DQA1*02与希美加群诱导的转氨酶升高有关;他们还发现21例希美加群肝损伤患者中有2例淋巴转化试验阳性,高浓度的希美加群及其代谢物能抑制抗原肽与HLA-DRB1*07∶01结合[12],这项研究从药物基因组学角度揭示了无免疫病理临床特征的肝脏不良反应可能是由免疫引起的,为药物性肝损伤的发病机制研究提供新的线索。
综上,HLA等位基因与多个药物引起的肝损伤有关,鉴定HLA基因型或许可以指导个体化精准用药,改善患者用药安全;揭示特定药物性肝损伤的风险遗传标志物或许可为该药物的批准上市提供决策依据。
2.1.1.2 HLA与生物药
在过去20年中,生物药已成为治疗各种自身免疫性疾的重要药物[13]。研究显示,在美国,英夫利昔单抗、免疫检查点抑制剂引起的DILI的案例越来越多[14]。
英夫利昔单抗是一种靶向抑制TNF-α的单克隆抗体,适用于克罗恩病、溃疡性结肠炎、类风湿性关节炎、银屑病和牛皮癣等自身免疫性疾病的治疗。由于观察到肝损伤事件,FDA于2004年要求其说明书上增加肝毒性警告。在冰岛,使用英夫利昔单抗患者,每120人就有1例发生肝毒性[15]。LiverTox数据库将其标记为肝损伤可能性分数A,表明其肝损伤风险明确。研究发现,HLA B*39∶01是与英夫利昔单抗诱导的DILI相关性最强的等位基因[16]。该研究估计了HLA-B*39∶01检测的群体效益发现,6名HLA-B*39∶01携带者避开英夫利昔单抗治疗可预防1例肝损伤;若患者在给药前进行HLA筛选,预计避免1例英夫利昔单抗相关DILI发生需要267例接受基因检测[16]。研究发现,对29例进行HLA基因分型,与deCODE遗传学数据库对比显示,HLA-DQB1*02∶01和HLA-DRB1*03∶01与肝损伤风险增加相关,而HLA DRB1*04∶04与肝损伤风险降低相关[17],不同HLA等位基因在该药肝损伤中的作用不同。该研究中没有英夫利昔单抗患者携带HLA-B*39∶01,可能是这一位点在不同人群中分布不同,HLA-B*39∶01与药物性肝损伤的相关性不强,可能与自身免疫性疾病易感有关。尽管如此,这两项研究病例较少,未来仍然扩大样本量验证研究HLA基因型对英夫利昔单抗相关肝毒性的影响。
免疫检查点抑制剂(ICI)改变了癌症治疗格局,但其肝毒性发生率在2%~25%不等[13]。大多数情况下,肝损伤表现为肝细胞损伤,最近有报道高达30%的患者出现混合型和胆汁淤积型[14]。已有多项关于HLA与ICI相关免疫不良事件相关性研究[18],如HLA-B*27∶05与ICI诱导的自身免疫性脑炎风险增加相关,HLA-DQB1*03∶01与ICI诱导结肠炎相关。Sung等发现HLA-B*35∶01等位基因与ICI与免疫相关不良反应风险增加和不良反应的发生率有关[19]。然而,关于HLA与ICI引起肝毒性的研究较少。
综上,TNF-α单克隆抗体、ICI是主要的药物性肝损伤的生物药,然而HLA与这些药引起的肝损伤相关性研究仍然有限。
2.1.1.3 HLA与中草药和膳食补充剂
中草药和膳食补充剂是导致中国和韩国等亚洲国家DILI的主要原因。草药和膳食补充剂引起的肝损伤病例在西方国家的报道也逐渐增加,约占药物性肝损伤病例的20%[20]。何首乌(PM)是中药引起肝损伤的首要原因,其诱导的肝损伤(PM-DILI)具有免疫介导特异质药物性肝损伤特征。本课题组对11名PM-DILI患者进行了MHC区域靶向测序,发现其HLA-B*35∶01频率显著高于中国汉族健康人群。在15名PM-DILI患者、33名其他DILI患者和99名人群对照中进行的独立验证研究显示,HLA-B*35∶01等位基因是PM-DILI的特异性易感基因。前瞻性队列研究表明,HLA-B*35∶01阳性携带者服用何首乌后转氨酶水平升高的发生率高于非携带者[21]。此外,一项针对73例PM-DILI患者、118例其他药物诱导性肝损伤患者和191例健康对照的研究也证实了rs1055348,一个HLA-B*35∶01的标签,与PM-DILI有特异性相关,可能是预测PM-DILI的生物标志物[22]。这些研究表明,将药物基因组学引入中药肝损伤的研究,可以为解开中药安全之谜提供新的见解。
绿茶提取物因其减肥、增强能量和促进健康的功能,在美国广受欢迎。然而,相关的肝损伤报道也在不断增加。美国药物性肝损伤网络数据库中收录了40例绿茶引起的肝损伤病例,绿茶提取物已成为草药和膳食补充剂引起肝损伤的主要原因,在所有病例中排名第六。Hoofnagle等对36例绿茶引起的肝损伤患者进行了HLA基因检测,结果显示,与病例对照组(192例其它膳食补充剂肝损伤患者、1113例常规药物肝损伤患者)及15094例来自电子病历和基因组学研究网络队列的对照人群相比,4个HLA等位基因与绿茶肝损伤显著相关,其中HLA-B*35∶01和HLA-C*04∶01最强。在绿茶肝损伤病例中,HLA-B*35∶01阳性携带率比对照组高5~7倍,携带HLA-B*35∶01的患者发病时间短、ALT水平更高,严重程度评分更高[23]。最近,Line在携带HLA-B*35∶01的健康志愿者外周血单个核细胞中证实了绿茶提取物主要成分表没食子儿茶素-3-O-没食子酸酯可以激活T细胞[24],进一步支持了HLA-B*35∶01参与绿茶引起的肝损伤。
姜黄和藤黄果都可引起肝损伤。对10例姜黄相关肝损伤病例进行HLA分型发现,10例中有7例患者携带HLA-B*35∶01,其频率明显高于人群对照[25]。此外,从22例藤黄果相关的肝损伤病例中也观察到,HLA-B*35∶01在藤黄果相关的肝损伤病例中的频率显著高于其他草药和膳食补充剂引起的肝损伤患者和常规药物相关肝损伤患者[26]。
日本汉方是药物性肝损伤的主要原因,12.6%的DILI病例归因于此。研究显示,19例汉方相关DILI中有12例携带HLA-B*35∶01,其频率显著高于健康日本人和其他药物引起的肝损伤患者;分析汉方成分发现,含有黄芩、大黄、栀子和甘草的汉方引起的肝损伤与HLA-B*35∶01显著相关[27],表明HLA-B*35∶01是日本汉方相关肝损伤的风险因素。
综上,草药和膳食补充剂相关肝损伤病例日益增多,逐渐成为药物性肝损伤的主要原因。HLA-B*35∶01与何首乌、绿茶提取物、姜黄、藤黄果、日本汉方引起的肝损伤都相关,提示其可能是多种草药和膳食补充剂或天然药物相关肝损伤共同标记物。这些草药或膳食补充剂化学成分复杂,物质结构差异大,但其肝损伤的发生均与HLA-B*35∶01这一共同的等位基因相关,基于HLA-B*35∶01的肝损伤物质基础研究,揭示共性规律,成为未来研究的重点。
2.1.2 HLA基因多态性介导特异质药物性肝损伤的机制
HLA介导的抗原呈递和识别是刺激T细胞活化和适应性免疫反应所必需的。药物性抗原如何刺激T细胞活化的机制假说有多种,半抗原假说是在特异质药物性肝损伤研究中最为经典而深入的模型[28]。该假说认为,药物或其活性代谢产物作为半抗原,与体内肝脏蛋白共价结合形成药物-蛋白加合物,经抗原呈递细胞加工处理产生药物修饰抗原肽,HLA将其识别为“外来抗原”并呈递与T细胞受体结合形成HLA-抗原肽-T细胞受体复合体进而激活T淋巴细胞释放细胞因子和细胞裂解因子杀伤肝脏细胞。这一假说中T细胞活化依赖于药物代谢和抗原加工过程,激活时间慢,很好地解释了特异质药物性肝损的延迟发生特点;如氟氯西林和阿莫西林-克拉维酸钾与抗原呈递细胞孵育16~48h后才显著促进T细胞增殖和释放细胞因子[29-30]。
随着特异质药物性肝损伤机制研究愈加深入,科学家也提出了另外两种药物抗原激活T细胞的假说:药物与免疫受体相互作用模型(phar macological interaction with immune receptor,P-I)和改变肽库模型。P-I假说认为,药物或其代谢物直接与HLA分子或T细胞受体非共价结合而激活T细胞。氟氯西林可刺激HLA-B*57∶01阳性健康志愿者外周血单个核细胞中CD8+T细胞反应,机制研究发现,HLA-B*57∶01限制性介导氟氯西林以非共价结合方式(P-I)直接促进T细胞活化[31]。该研究也解释了特异质药物性肝损伤的个体易感性。改变肽库模型认为,药物结合到HLA分子的抗原结合槽改变了结合槽的化学性质和HLA分子呈递的肽库。目前只有阿巴卡韦通过这一机制引起T细胞免疫应答进而导致超敏反应[32]。
2.2 抗原呈递和抗原肽处理相关基因
ERAP1和ERAP2是参与抗原肽前体修剪的酶,在抗原加工和修饰N端肽至HLA-I类最佳装载大小起主要作用,可能影响特定HLA-I基因编码的蛋白表达。研究表明,ERAP突变体在HLA-相关疾病(如强直性脊柱炎)中具有保护作用。Carr等首次在撒哈拉以南非洲奈韦拉平皮疹的患者中发现,HLA-C*04∶01携带者对皮疹的易感性与ERAP2的保护作用有关[53]。2020年,Pavlos比较了HLA-B*57∶01携带者服用阿巴卡韦超敏反应与耐受患者的免疫与非免疫基因变化情况,发现超敏反应患者仅携带ERAP1低活性修剪同种异型的可能性明显低于耐受者,进一步支持ERAP1低活性修剪同种异型对HLA-B*57∶01携带者的保护作用[54]。Ni coletti对444例阿莫西林-克拉维酸引起的肝损伤(AC-DILI)患者和10397例对照人群进行了全转录组关联研究和全基因组关联分析显示,AC-DILI与ERAP2肝脏表达降低显著相关,ERAP2突变体rs1363907(G)与AC-DILI风险有关;结果在另一人群队列中得到了验证。由rs1363907、rs2476601、·HLA-B*15∶18、HLA-A*02∶01、HLA-DRB1*15∶01组成的遗传风险评分模型对AC-DILI风险具有较高的预测性能[10]。最近对16例接种COVID-19mRNA疫苗后出现肝炎的患者进行测序分析,未发现HLA与疫苗肝炎有关;但ERAP-2突变体(rs1263907)和ERAP1Hap6单倍型在疫苗肝炎患者显著增高[55];表明宿主对疫苗相关抗原的免疫反应可能与肝毒性相关。综上,特定ERAP基因型可能对HLA相关药物不良反应有保护作用,未来研究其他药物性肝损伤的ERAP基因多态性或许可改善HLA基因对肝损伤结局的预测能力。
2.3 杀伤细胞免疫球蛋白样受体(KIRs)
KIRs与HLA-I配体相互作用在调控自然杀伤细胞反应中起着关键作用。Stephens等首次在102例阿莫西林-克拉维酸肝毒性患者和226例对照志愿者进行KIR分型,发现两组之间KIR分布无明显差异,患者常见的受体-配体组合是2DL3+表位C1和3DL1+Bw4基序,而2DL1+表位C2和3DL1+Bw4基序在对照组中占主导作用,但无组间差异,表明KIR与阿莫西林-克拉维酸肝毒性关系不大。2017年在30例药物性肝毒性儿童患者中发现,所有患者都携带K2DP1、K3DP1、K3DL3、K3DL2和K2DL4;KIRK2DS5患儿服药后出现肝毒性的可能性更小。与对照患者相比,KIR单倍型与药物肝毒性无明显关系。最近,Urrutia-Maldonado对22例化疗后肝损伤患者和24例耐受患者进行HLA和KIRs基因分型,结果显示,携带KIRK2DS2的患儿化疗后发生肝毒性风险是其他儿童的4倍;携带KIR K2DS2和C1配体患者风险是其他儿童的10倍[56]。这些研究表明,KIR等位基因可能影响HLA相关药物的免疫反应。由于PΩ-1处氨基酸性质决定了KIR3DL1的结合,推测氟氯西林修饰肽可能影响KIR3DL1与HLA的结合,进而影响KIR的功能[57-59]。然而,药物修饰肽如何影响KIR的结合引起免疫反应尚不清楚。
2.4 T细胞受体(TCR)
TCR是一种T细胞膜蛋白,通过与HLA-抗原肽结合诱导T细胞增殖和活化[60-61]。90%以上的TCR由α链和β链组成,每条链包含可变区(V区)和恒定区(C区)[62-63]。CDR3的可变区(V)、多样性区(D)和连接区(J)基因片段的缺失、插入和重排造成TCR的多样性,在适应性免疫反应中至关重要,影响自身免疫性疾病、感染及药物超敏反应的个体差异[64]。自20世纪90年代以来,特异性TCR在药物性皮疹中的使用偏向性被观察到,包括苯巴比妥、磺胺甲恶唑、复方新诺明和青霉素等,提示这种TCR使用受限可能是药物超敏反应的特征[65-69]。在以HLA相关的卡马西平(CBZ)诱导的Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN)模型研究中,主要克隆型VB-11-ISGSY在84%的SJS/TEN患者中存在,而在CBZ耐受者中则无。该克隆型在活动期患者外周血中的表达是恢复期的5~10倍[70]。TCRβCDR3克隆型“ASSLAGELF”在CBZ诱导的SJS/TEN患者中特异性表达,但在耐受组或健康志愿者中极少见,与临床分期相关[71]。结果表明,TCR克隆型可用于区分CBZ诱导的SJS/TEN的发生,并作为临床分期的生物标志物。虽然药物诱导的肝损伤与HLA基因多态性相关,但一些携带风险HLA等位基因的患者仍未出现肝损伤。TCR在药物诱导的特异质肝损伤中病理机制仍不清楚。高通量测序研究显示,何首乌诱导的肝损伤患者与耐受者之间在TCR组库的CDR3数量、克隆种类及氨基酸序列等方面存在显著差异[72]。该研究为揭示药物性肝损伤机制提供了新线索。
2.5 共刺激/抑制信号基因
T细胞活化受到3条信号通路的影响[58],信号1是抗原呈递细胞表面的HLA-抗原肽复合物与TCR的相互作用进而引起T细胞免疫应答,决定免疫应答的抗原特异性。信号2是由抗原呈递细胞表面的共刺激分子与T细胞表面相应配体相互作用,如CD28与CD80/CD86,PD-1与PD-L1/L2及CTLA-4与CD80/CD86等;共抑制分子和共刺激分子同时调节T细胞活化,维持免疫耐受与激活的平衡。此外,研究表明,炎症细胞因子也在T细胞活化起辅助作用。只有信号1和信号2共同作用时,T细胞才会被激活;若仅有信号1而无信号2,则导致耐受或无能[59]。
2.5.1 PD-1
共刺激分子和共抑制分子基因多态性可能会影响HLA相关的药物性不良反应发生。尽管缺乏与药物肝损伤直接研究,体外研究表明,阻断PD-L1/CTLA-4信号促进亚硝基磺胺甲恶唑特异性T细胞增殖[60]。在HLA-B*57∶01转基因小鼠中发现,耗竭CD4+T细胞可增强树突状细胞成熟,诱导CD8+T细胞活化,增敏阿巴卡韦的超敏反应,而阻断CD80则抑制CD8+T细胞活化[61]。此外,CD4+T细胞耗竭和PD-1阻断后给予阿巴卡韦,可诱导小鼠出现超敏反应信号,如皮肤毒性、CD8+T细胞活化[62-63]。另一项研究发现,CD4+T细胞耗竭和PD-1阻断后给予氟氯西林可诱导HLA-B*57∶01转基因小鼠产生肝炎和CD8+T细胞活化[64]。这些研究表明,CD4+T细胞以及PD-1在HLA-B*57∶01相关的阿巴卡韦或氟氯西林引起的免疫耐受发挥作用,未来探讨PD-1基因多态性有助于理解HLA限制药物不良反应的机制。
2.5.2 CTLA-4
CTLA-4是诱导免疫耐受的关键要素,是T细胞介导免疫反应的主要负性调节因子。研究表明,CTLA-4基因多态性可影响肝损伤的发生。Agarwal对155例1型自身免疫性肝炎患者和102例对照人群进行CTLA-4基因分型,发现CT LA-4基因1号外显子328碱基对片段中第49位含有A-G替换多态性,G等位基因在患者显著高于对照组;GG型与HLA-DRB1*03∶01可能协同增加发病风险。此外,CTLA-4G等位基因可能对酒精性肝损伤更易感,GG纯合子对酒精性肝硬化易感,表明CTLA-4A49G多态性与酒精性肝病易感性和严重程度有关。Guo对90例肾移植受者药物性肝损伤病例和774例肾移植受者无药物性肝损伤病例进行基因分型,结果发现rs231775与药物性肝损伤相关;CTLA-4单倍型ACGG在药物性肝损伤组中的频率高于无药物性肝损伤组[65];提示CTLA4单倍型ACGG与中国肾移植受者药物性肝损伤发生有关,rs231775GG基因型可能是免疫抑制药物引起肝损伤的危险因素。然而,该基因与药物性肝损伤的相关性较弱,需要在更大人群中验证。
2.5.3 蛋白酪氨酸磷酸酶非受体型22(PTPN22)
PTPN22是一种淋巴特异性磷酸酶,调节T细胞活化。SNPrs2476061与多种自身免疫性疾病相关[73]。针对201例阿莫西林-克拉维酸诱导的药物性肝损伤(AC-DILI)病例的全基因组关联研究发现,rs2476601与AC-DILI弱相关[13]。另一项2048例DILI病例的研究确认rs2476601的相关性,OR为1.62,并使HLA-A02∶01和DRB115∶01携带者的风险增加一倍。该位点也与其他药物引起的肝损伤相关[74],并在一项大量人群研究中用于建立AC DILI的遗传风险评分模型[14]。PTPN22被视为MHC区域外的DILI风险基因,其与HLA联合应用可提升药物性肝损伤的诊断和预测能力。
2.6 细胞因子基因多态性
细胞因子失衡参与了药物性肝损伤的发生,TNF-α和IL-1β促进肝损伤,而IL-4和IL-10发挥肝脏保护作用。目前报道与药物性肝损伤有关的细胞因子基因主要有IL10、IL-4、IL-6、TNF-α,见Tab.2。
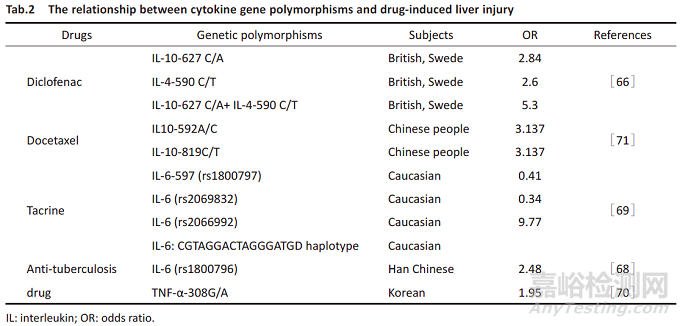
2.6.1 IL-10
IL-10是一种由巨噬细胞、单核细胞和辅助性T细胞产生的抗炎细胞因子,能够通过抑制炎症因子的分泌来保护肝脏。IL-10基因表达受启动子区多态性影响,包括-1082A/G、-819T/C、-592A/C和-627C/A。其中,-627A、-592A和819T与表达降低相关,而-1082G与表达增加相关。研究表明,IL-10基因多态性与DILI的风险和预后有关。例如,双氯芬酸诱导的肝毒性患者中,-627A等位基因频率显著高于健康对照(OR为2.8),而携带-627A和-590T的患者风险进一步增加(OR为5.0)[75]。多西他赛治疗的乳腺癌患者中,-592AA和-819TT基因型也增加了肝损伤风险[76]。一些研究发现,IL-10基因多态性与DILI的临床结局相关,但目前的研究因样本量小和缺乏前瞻性设计而存在局限性,因此其在DILI诊断和预后中的价值需进一步验证。
2.6.2 IL-4
IL-4可促进B细胞和Th2细胞分化,及诱导IgE的产生。其启动子区存在-590C/T单核苷酸多态性。体内外研究证实,IL-4-590T等位基因与提高其转录水平和促进IgE分泌有关。研究表明,携带IL-4-590T等位基因的患者在服用双氯芬酸后肝损伤的发生率更高。IL-10和IL-4突变基因在患者中出现的频率更高[66]。另一项研究发现,这些等位基因在DILI病例中的频率与对照人群相比无显著差异[67]。此外,我国的一项研究也未发现IL-4基因rs2243289、rs2243250和rs2070874与抗结核药物诱导的肝毒性相关。因此,除了双氯芬酸引起的肝毒性外,IL-4的遗传变异可能在药物性肝损伤中的作用较弱。
2.6.3 IL-6
IL-6是一种重要的抗炎细胞因子,调节抗炎和促炎的平衡。研究显示,IL-6缺陷小鼠对扑热息痛诱导的肝损伤更易感;IL-6可以通过调控IL-6/SATA信号通路保护肝脏免受抗结核药物的损伤[68]。对41例抗结核药物引起的肝损伤儿童患者和116例对照人群进行SNP分型显示,IL-6基因rs1800796的G等位基因显著增加肝损伤风险[68]。胆碱酯酶抑制剂药物他克林的肝损伤是其退市的主要原因之一,研究表明,接受他克林治疗的阿尔茨海默病患者中,IL-6基因中的rs2066992和VNTR与转氨酶水平升高有关[69]。这些发现表明,IL-6的基因变异可能会增加他克林和抗结核药物引起的肝损伤,但需要更大的人群进一步验证。
2.6.4 TNF-α
TNF-α是一种由单核细胞、巨噬细胞和活化的T细胞分泌,可促进DILI的发生发展。其表达受其基因多态性的影响,尤其是TNF-α启动子区-308(G/A)位置的A等位基因。研究显示,TNF-α基因多态性与对乙酰氨基酚等药物的肝损伤无显著相关。抗结核药物引起的肝炎患者A等位基因在频率显著高于耐受者,表明其可能与抗结核药物引起的肝损伤有关[70]。此外,氟氯西林肝损伤患者的全基因组关联研究发现,TNF-αrs361525和rs1799964显著相关[5]。综上,TNF-α基因变异可能影响特定药物引起的肝损伤,但需进一步验证。
3免疫遗传在临床实践中的转化与挑战
基因检测筛查HLA-B*57∶01成功降低了阿巴卡韦超敏反应发生率[72],FDA推荐在开具阿巴卡韦处方前筛查HLA-B*57∶01以避免不良反应。这一里程碑事件推动了药物基因学在药物安全性领域的发展。2008年首个全基因组关联研究证实了希美加群引起的肝毒性与HLA-DRB1*07和DQA1*02强相关[12],为揭示药物性肝损伤机制提供了全新的视角。目前已有25个以上药物引起的肝损伤被报道与特定HLA等位基因有关。然而,药物性肝损伤并非单基因病,其低发生率导致风险基因的阳性预测值很低。因此,临床上应用HLA基因筛查预测药物性肝损伤效果有限。HLA-B*57∶01携带者服用氟氯西林后的肝损伤风险增加80倍,是影响药物性肝损伤最大的风险基因之一。每10万人服用氟氯西林患者中约有8.5例发生肝损伤。HLA-B*57∶01的阳性预测值为0.12%,需筛查13500多人才能预防1例肝损伤[73],提示其在预防氟氯西林肝损伤方面缺乏成本-效益优势。
由于单个药物引起的肝损伤发病率低,HLA的阳性预测值低。有学者提出将与药物性肝损伤相关HLA基因型构建成一个HLA组合(panel),提高预测值和应用范围[74];如将现有报道的与药物性肝损伤相关的HLA等位基因组合起来并建立检测方法,那么在患者给药前进行HLA等位基因组合筛选可能有助于提高患者用药安全。2023年一项欧洲的研究显示,包含12个基因的panel在患者给药前基因检测中显著降低了药物不良反应发生率,提示HLApanel可能是可行的预防方法[75]。
HLA等位基因的阴性预测值较高,表明其可用于药物性肝损伤的诊断和因果关系评估[76];在患者服用多种潜在肝毒性的药物时,HLA检测可辅助医生精准找到致病药物,从而避免再次暴露导致更严重的肝损伤。
HLA检测还可以用于区分药物性肝损伤和自身免疫性肝病[77],如米诺环素引起的肝损伤和特发性自身免疫性肝炎存在相似的血清标志物如抗核抗体和抗平滑肌抗体,HLA-B*35∶02基因型可有效诊断米诺环素相关肝损伤[78]。
尽管HLA等位基因影响显著,本文总结了其他与药物性肝损伤相关的免疫基因,如ERAP1、PTPN22、TCR等。这些基因与HLA组合可提高肝损伤风险预测。在阿莫西林-克拉维酸引起的肝损伤中,HLA-A*02∶01和HLA-DRB1*15∶01同时出现,肝损伤风险增加3.77倍,若PTPN22突变体同时存在则风险增至6倍。若同时存在HLA-A*02∶01、HLA-DRB1*15∶01、PTPN22突变体、杂合子ERAP2,则肝损伤风险增加17倍。此外,将以上4个等位基因和HLA-B*15∶18建立的遗传风险评分对阿莫西林-克拉维酸引起的肝损伤具有较高的预测性能[10]。
药物代谢的个体差异可能改变具有免疫原性的母药或代谢物的暴露。许多代谢酶遗传多态性可能与特异质药物不良反应有关,如CYP2B6与噻氯匹定肝毒性有关。CYP2B6*1H和*1J单倍型与其表达增加有关,联合HLA与CYP2B6分析显示,携带CYP2B6*1H或*1J与HLA-A*33∶03的个体对噻氯匹定肝毒性易感性最高,风险增加38.82倍[79]。此外,CYP2C9与苯妥英超敏反应有关。CYP2C9*3突变体显著降低代谢能力。2018年研究发现,HLA-B*13∶01、HLA-B*15∶02和HLA-B*51∶01与苯妥英皮肤不良反应显著相关。CYP2C9*3或单个HLA-B等位基因只能解释30%的不良反应;联合检测CYP2C9*3、HLA-B*13∶01、HLA-B*15∶02、HLA-B*51∶01显著提高了预测能力,灵敏度从30.5%提升到71.9%。多基因检测的临床有效性发现,4个等位基因同时检测可提高受试者工作特性(ROC)曲线下面积和约登指数[80];表明多个基因检测在识别苯妥英皮肤不良反应中具有显著优势。近期研究报道,编码谷胱甘-S-转移酶的基因GSTT1野生型与抗逆转录病毒药物引起的肝损伤风险增加2.04倍,联合GSTT1野生型与HLA B*35∶05可将抗逆转录病毒药物引起的肝损伤风险增加2.28倍[81],提示Ⅱ相代谢酶变异也可能影响HLA相关药物性肝损伤。综上,代谢酶遗传变异可能影响HLA相关药物肝脏或皮肤不良反应差异。联合药物代谢酶相关基因检测可能提高HLA等位基因对特异质药物性肝损伤的预测价值。
4小结与展望
HLA等位基因是与药物性肝损伤最相关的易感基因,已有超过25种药物性肝损伤与其有关。由于HLA等位基因的阳性预测值低,给药前的HLA筛查在预防药物性肝损伤中的价值有限,但其阴性预测值较高,使其在诊断和因果评估中具有重要意义。近年来,免疫相关基因如抗原加工、T细胞受体和细胞因子等的多态性也与药物性肝损伤相关,这些基因可增加HLA介导的损伤风险。未来,结合这些基因与HLA的分析可能加深对药物性肝损伤机制的理解,并推动其临床应用,以提升用药安全。

来源:Internet


