您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-08-28 15:29
刚刚,国家药监局器审中心发布了《基孔肯雅病毒核酸检测试剂技术审评要点(试行)》,全文如下:
基孔肯雅病毒核酸检测试剂技术审评要点
(试行)
本审评要点旨在指导注册申请人开展基孔肯雅病毒核酸检测试剂的设计开发工作,准备产品注册申报资料,同时也为技术审评部门提供参考。
本审评要点是对基孔肯雅病毒核酸检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本审评要点适用于基孔肯雅病毒核酸检测试剂注册申请和变更注册申请的情形,其他未尽事宜应当符合《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家药品监督管理局公告2021年第122号)等相关法规的要求,同时建议参考《定性检测体外诊断试剂分析性能评估注册审查指导原则》、《体外诊断试剂主要原材料研究注册审查指导原则》等适用的技术文件要求。
二、注册审查要点
(一)产品技术要求及检验报告
注册申请人应当在原材料质量和生产工艺稳定的前提下,根据产品研制、前期评价等结果,依据国家标准(如有)、行业标准及有关文献资料,结合产品特性,按照《医疗器械产品技术要求编写指导原则》(2022年第8号)的要求编写产品技术要求。该类产品作为第三类体外诊断试剂,应当以附录形式明确主要原材料以及生产工艺要求。
基孔肯雅核酸检测试剂如有国家标准品,技术要求中应体现国家标准品的相关要求,并使用国家标准品对三批产品进行检验。
基孔肯雅病毒核酸检测试剂的检出限水平应符合国家相关指南文件规定,申报产品对国家灵敏度标准品(如有)的检测结果应与声称的检出限水平相当。
如有适用的国家标准、行业标准,产品技术要求的相关内容应不低于相应的要求。
(二)分析性能研究
注册申请人应采用在符合质量管理体系的环境下生产的试剂盒进行分析性能研究,提交具体研究方法、试验方案、试验数据、统计分析结果等详细资料。
如申报产品适用不同的机型,需要提交采用不同机型进行性能评估的资料。如申报产品包含不同的包装规格,需要对各包装规格进行分析或验证。
如果试剂同时适用于血清和血浆样本类型,可选择具有统计学意义数量的样本进行不同样本类型一致性的同源比对研究。
分析性能评估所用样本的基本信息均需明确,例如样本来源、样本类型、采集和处理方式、稀释方式、定值过程及数据等。
分析性能评估用样本一般应为真实样本,如需稀释,应采用阴性样本进行稀释。
建议着重对以下分析性能进行研究。
1.样本稳定性
2.核酸(RNA)提取/纯化性能
在进行核酸检测之前,建议有核酸提取/纯化步骤。该步骤的目的除最大量分离出目的RNA外,还应有相应的纯化作用,尽可能去除PCR抑制物。对配合使用的所有核酸提取试剂进行提取核酸纯度、浓度、提取效率的研究,并与质量较好的核酸提取试剂进行平行比对。若产品适用两种或以上核酸提取试剂,则每一种核酸提取试剂均需配合检测试剂进行抗干扰、精密度和检出限的验证。
3.精密度
应对精密度指标,如标准差或变异系数等的评价标准做出合理要求。应考虑运行、时间、操作者、仪器、试剂批次和地点等影响精密度的条件,设计合理的精密度试验方案进行评价。精密度评价试验应包含核酸提取步骤。设定合理的精密度评价周期,例如为期至少20天的检测。对检测数据进行统计分析,获得重复性、实验室内精密度、实验室间精密度、批间精密度等结果。
应至少包含3个水平:阴性样本、临界阳性样本、中/强阳性样本,并根据产品特性设定适当的精密度要求,例如:
阴性样本:待测物浓度为零浓度,阴性检出率应为100%(n≥20)。
临界阳性样本:待测物浓度略高于试剂盒的检出限,阳性检出率应≥95%(n≥20)。
中/强阳性样本:待测物浓度呈中度到强阳性,阳性检出率为100%且Ct值的CV≤5%(n≥20)。
4.分析特异性
4.1交叉反应
4.1.1生物信息学分析
分析应当包括人基因组和其他近缘病毒、引起发热、关节疼痛、出疹等相似症状的病原体。
4.1.2样本验证
采用灭活的临床样本或添加了灭活病原体培养物的阴性临床样本进行验证,样本基质应与预期检测样本类型一致,交叉反应研究用样本主要考虑以下几方面:
4.1.2.1发热伴出疹相关病原体
登革病毒(DENV-1~DENV-4)、辛德毕斯病毒、盖塔病毒、黄热病毒、寨卡病毒、麻疹病毒、风疹病毒、乙型脑炎病毒*、水痘-带状疱疹病毒*、单纯疱疹病毒*、细小病毒B19*、人类疱疹病毒6*、人类疱疹病毒7*、肺炎衣原体*、志贺氏菌*、淋球菌*、溶血性链球菌*、立克次体*。
注:“*”项为选择性验证的病原体,可在其中选择不少于9个进行验证。
4.1.2.2可能在血液样本中存在的其他常见病原体
乙型肝炎病毒、丙型肝炎病毒、EB病毒、人巨细胞病毒。
4.1.2.3高浓度人类基因组DNA
病毒培养液的浓度单位可采用TCID50或PFU/mL,细菌培养物浓度单位可采用CFU/mL。建议在病毒和细菌感染的医学相关水平进行交叉反应的验证。通常,细菌感染的水平为106 CFU/mL或更高,病毒为105 PFU/mL或更高,也可采用其他合理的方法对病原体浓度进行定值,提交相关依据。
申请人应提供所有用于交叉反应验证的病毒和细菌的来源、种属/型别信息和浓度确认等试验资料。
4.2干扰
4.2.1干扰物质研究
应根据所采集样本类型,针对可能存在的内源/外源物质干扰情况进行验证,验证推荐物质见表1。建议申请人在每种干扰物质的潜在最大浓度(“最差条件”)条件下进行试验,检测包含临界阳性水平在内的基孔肯雅病毒样本。对结果进行合理的统计分析,对比添加干扰物质前后的Ct值差异。检测的潜在干扰物包括样本中的原有物质及在样本采集和处理期间引入的物质。
表1 用于干扰试验的物质
|
抗病毒药:如利巴韦林 |
|
解热镇痛药:如对乙酰氨基酚 |
|
抗生素:如阿莫西林 |
|
激素类药物:如地塞米松 |
|
抗凝剂:如肝素 |
|
内源性干扰物质:血红蛋白、甘油三酯、白蛋白、胆红素等 |
4.2.2病原体干扰研究
应充分考虑临床上容易与基孔肯雅病毒合并感染的病原体(如登革病毒等)及“4.1.1”中经生物信息学分析显示存在较高同源性的病原体,在高浓度的情况下对低浓度(例如检出限浓度)基孔肯雅病毒核酸检测的影响,进行干扰研究。
5.检出限
5.1检出限的确定
建议采用至少3个样本系列稀释于与适用样本一致的基质中,进行检出限的确定。每个浓度梯度重复检测,记录不同浓度检出的结果,采用适当的模型(如Probit分析)和分析方法,将具有95%阳性检出率的最低浓度水平作为确定的检出限。
5.2检出限的验证
选择另外3个不同来源的样本在检出限浓度水平进行验证,应达到95%阳性检出率。
如检测试剂包括多个可单独报告的检测靶标,应分别进行检出限研究。
6.包容性
6.1应当采用生物信息学分析方法对产品检测的包容性进行研究,对所有已公布的基孔肯雅病毒核酸序列进行序列比对分析,并对靶标范围内的序列差异是否影响申报产品检出能力进行分析验证。
6.2验证至少10个不同来源的临床阳性样本。研究应包括检出限和重复性的验证。
6.3基因型覆盖
应对基孔肯雅病毒主要基因型,包括西非型、东中南非型(包含印度洋分支)、亚洲型及其他流行变异株进行包容性研究。研究可采用毒株或临床样本,如果样本难以获得,亦可采用假病毒。
7.企业参考品验证
根据主要原材料研究资料中的企业参考品设置情况,采用三批产品对企业参考品进行检验并提供详细的试验数据。
(三)主要原材料研究
1.应详述引物和探针的设计原则,提供引物、探针核酸序列、模板核酸序列及两者的对应情况。提供检测靶标的详细确定依据。
2.企业参考品制备
申请人应根据产品性能验证的实际情况自行设定企业参考品,包括阳性参考品、阴性参考品、检出限参考品、精密度参考品。企业参考品应采用临床样本或者使用病毒培养物加入阴性样本制备,不宜采用质粒、假病毒、基因组提取/纯化物等核酸制备。企业参考品的设置建议如下:
阳性参考品应包含不同浓度水平基孔肯雅病毒阳性灭活毒株或临床样本。
阴性参考品则主要涉及对特异性的验证情况,建议至少包括登革病毒、麻疹病毒等相似症状病原体,生信分析显示同源性较高的病原体和干扰样本。
检出限参考品应包含95%阳性检出水平或略高于检出限水平的阳性灭活毒株或临床样本,如100%阳性检出水平。
精密度参考品应至少包含两个浓度水平,其中包含弱阳性水平。
(四)其他
主要原材料研究的其他内容、生产工艺、反应体系、稳定性、阳性判断值等研究资料,可参考其他病原体核酸检测试剂指导原则进行研究。
(五)临床评价
1.临床试验机构
建议申请人在相关流行病学多发区域选择临床试验机构,应是经备案的医疗器械临床试验机构(包括各级疾病预防控制中心)。临床试验机构数量应不少于3家,且具有分子生物学方法检测的优势,实验操作人员应有足够的时间熟悉检测系统的各环节(仪器、试剂、质控及操作程序等),熟悉评价方案。在整个试验中,试验体外诊断试剂和对比方法/试剂均应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
2.临床试验设计
2.1 对于新的基孔肯雅病毒核酸检测试剂
2.1.1 与临床参考方法的比较
申请人可采用核酸序列测定方法(临床参考方法)作为对比方法,验证试验体外诊断试剂检测结果与核酸序列测定(如:一代测序)结果之间的一致性。
临床试验资料中应对测序方法进行详细的介绍,并提交性能验证数据,证明测序方法与试验体外诊断试剂的可比性。同时,还应提交测序引物和测序所扩增区段的生信分析资料,以确定测序区段对于基孔肯雅病毒核酸序列的特异性。
如测序试验委托其他机构完成,还应提交由临床试验机构委托第三方机构/实验室开展相关试验的测序服务合同/协议。受托机构/实验室应具有相应检测能力和资质。
2.1.2 与临床参考标准的比较
除上述比对试验外,还应考虑试验体外诊断试剂与临床参考标准进行对比。临床参考标准即按照相关管理部门发布的《基孔肯雅热防控技术指南(2025年版)》和《基孔肯雅热诊断卫生行业标准(WS/T 590-2018)》文件进行病例诊断的方法。
2.2 对于已有同类产品上市的情形
如有已上市同类产品,临床试验可选择已上市的同类产品作为对比试剂,对比试剂的选择应考虑样本类型、产品性能等方面与试验体外诊断试剂具有良好的可比性。
申请人亦可以参照上述2.1部分进行临床试验设计。
3.临床试验入组人群
临床试验的入组人群应为产品的预期适用人群,该产品的适用人群为基孔肯雅热的疑似病例,申请人在进行临床试验时应依据相关管理部门发布的《基孔肯雅热防控技术指南(2025年版)》和《基孔肯雅热诊断卫生行业标准(WS/T 590-2018)》文件中对“疑似病例”的定义入组病例。
另外,临床试验建议纳入一定数量的弱阳性样本。弱阳性样本应采用合理方法确定,一般将Ct值小于cutoff值3~5个Ct值的样本定义为弱阳性样本,应采用对比试剂或临床诊疗过程中所用的适当的方法确定弱阳性。
4.临床试验样本类型
临床样本的采集建议按照《基孔肯雅热防控技术指南(2025年版)》等文件进行。
该类试剂可能涉及的样本类型包括血清和血浆。针对血清和血浆样本,如非临床研究数据证明两种样本类型之间几乎不存在差异,则临床试验中可将两种样本类型进行汇总统计。
5.临床试验样本量
与对比方法/试剂比较研究的临床试验样本量应满足统计学要求,可采用适当的统计学方法进行估算。临床试验可依据试验体外诊断试剂相对于对比方法/试剂的阴阳性符合率分别估算最低阴阳性样本例数。
临床样本量的估算建议采用如下样本量公式计算,
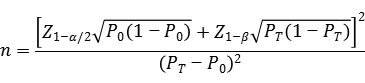
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平和把握度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为试验体外诊断试剂评价指标预期值。
其中,阴阳性符合率的临床可接受标准(P0)建议不低于90%。获得临床试验数据后,证明产品相对于对比方法的阴阳性符合率(置信区间下限)不低于预设的临床可接受标准(P0)。当评价指标P接近100%时,上述样本量估算方法可能不适用,应考虑选择更加适宜的方法进行样本量估算和统计学分析,如精确概率法等。
与临床参考标准的比较研究,建议参考与对比方法/试剂比较研究部分的样本量估算方法,并设定合理的临床可接受标准。
6.临床试验结果的统计分析
临床试验结果一般以四格表的形式进行总结,并据此计算试验体外诊断试剂与临床参考标准比较时的灵敏度和特异度及其95%置信区间,或与对比方法/试剂比较时的阳性/阴性符合率及其95%置信区间。应将试验体外诊断试剂检测结果与临床参考标准的一致性、试验体外诊断试剂与对比方法/试剂检测结果一致性分别进行统计分析。
临床试验报告中应对入组受试者的基本情况进行分析,包括受试者年龄、性别的分布情况,以及临床诊断背景等,确认入组样本具有较好的代表性。
临床试验中所有不一致结果均应结合患者的流行病学背景、临床症状、临床诊断以及疾病治疗、转归等信息进行充分的分析。临床试验结果应能够证明产品临床性能满足临床要求。
7. 境外临床试验数据的认可
境外临床试验数据应符合《接受医疗器械境外临床试验数据技术指导原则》和《使用体外诊断试剂境外临床试验数据的注册审查指导原则》的相关要求。提交完整的临床试验方案、报告和伦理审查意见,以及该数据适用于中国患者人群的论证资料、境内外临床试验质量管理差异的对比资料和临床试验质量管理差异对于临床试验结果影响的论证资料。
注册申请人应根据上述临床试验技术审评要求,论证境外临床试验数据的充分性。
8. 临床证据的形式要求
申请人应按照《体外诊断试剂注册与备案管理办法》《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》等法规文件要求提交各机构伦理审查意见、临床试验方案、临床试验小结、临床试验报告以及临床试验数据库。
临床试验数据汇总表作为临床试验小结的附件提交。数据表中应包括检测病例的编号、年龄、性别、样本类型、临床诊断背景信息、试验体外诊断试剂检测结果(含各基因的Ct值)、对比方法/试剂的检测结果(各基因的Ct值)和临床诊断结果等。临床应用的数据集中每一病例编号应能够溯源。
(六)产品说明书
产品说明书格式应满足《体外诊断试剂说明书编写指导原则》的要求。产品说明书中技术内容应与注册申报资料中的相关研究结果保持一致,如某些内容引用自参考文献,应以规范格式进行标注,并单独列明文献的相关信息。其中,有关说明书的【预期用途】建议如下:
本试剂盒用于体外定性检测基孔肯雅热病疑似病例、其他需要进行基孔肯雅热感染诊断或鉴别诊断者的xx样本中基孔肯雅病毒核酸。
有关“疑似病例”等人群的定义参照《基孔肯雅热防控技术指南》等文件执行。
该产品在使用上应当遵守《基孔肯雅热防控技术指南》等文件的相关要求。
开展基孔肯雅病毒核酸检测,应符合《基孔肯雅热防控技术指南》等的要求,做好生物安全工作。
本试剂盒检测结果仅供临床参考,不得作为临床诊断的唯一标准。建议结合患者临床表现和其他实验室检测对病情进行综合分析。

来源:中国器审


