1、紫杉烷类药物介绍
紫杉烷类历史
紫杉烷类药物主要分为紫杉醇和多烯紫杉醇两种。1962年,紫杉醇从太平洋红豆杉树皮中提取,FDA于1992年批准,适应症为卵巢癌、乳腺癌、非小细胞肺癌、艾滋病相关卡波西肉瘤。1981年,多烯紫杉醇(多西他赛)从欧洲红豆杉针叶中提取, FDA于1996年批准,适应症为乳腺癌、非小细胞肺癌、去势抵抗前列腺癌、头颈部鳞状细胞癌。该类药物具有广谱抗癌活性, 目前已成为治疗卵巢癌、乳腺癌和非小细胞肺癌等多种实体肿瘤的一线药物。其抗肿瘤作用机制:紫杉烷类药物通过与微管蛋白结合并促进微管蛋白聚合来发挥细胞毒性,这种对微管蛋白聚合动力学的破坏导致细胞周期阻滞在G2/M期,进而导致细胞凋亡。
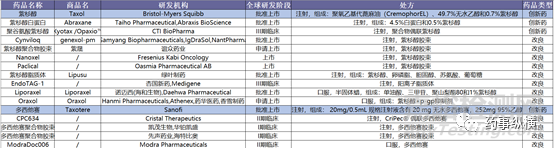
已上市及在研紫杉烷类药物
紫杉烷类药物缺点
紫杉烷类水溶性低,是P-糖蛋白(P-gp)的底物,口服经过胃肠道被P-gp外排而减少其胃肠道渗透性,为典型BCS Ⅳ类药物。同时许肿瘤细胞也会过表达P-gp,导致耐药,低溶解性、低渗透性、易耐药是紫杉烷类的显著缺点。
2、紫杉烷类化学结构进化
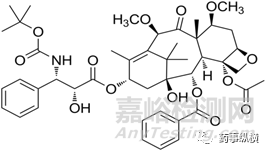
紫杉醇和多烯紫杉醇均为一代紫杉烷类,当肿瘤患者化疗药耐药后,肿瘤细胞过表达P-gp,P-gp过表达被认为是紫杉类耐药的主要原因。为克服一代紫杉烷类耐药问题,科学家筛选出二代活性药物——卡巴他赛,在多西他赛耐药肿瘤模型中,卡巴齐他赛仍具有很强的抗肿瘤活性。2010年FDA批准卡巴他赛用于mCRPC。
图1 卡巴他赛结构式
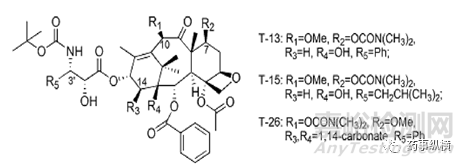
为提高口服生物利用度,科学家通过合成不同的紫杉醇类似物,将此类药物合成为非P-gp底物结构,并且增加其水溶性。T-26具有良好的口服生物利用度,结构如下图,是一种潜在的口服抗肿瘤活性的候选药物。
图2 T-26结构
紫杉烷类药物结构上的优化是从以下三个方面进行的:a)克服一代紫杉烷药物耐药,b)增加水溶性,c)增加生物利用度。
3、紫杉烷类药物递送途径优化
注射途径优化之路
紫杉醇
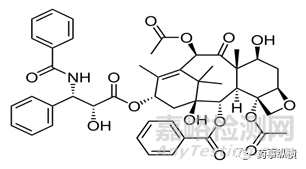
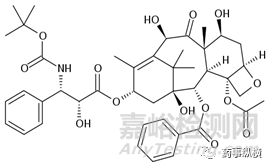
紫杉醇(PTX)是紫杉烷家族的一员,是治疗许多肿瘤常用化疗药物之一。紫杉醇对多种癌症均具有抗肿瘤活性,包括乳腺癌、卵巢癌、肝癌、非小细胞肺癌、头颈部肿瘤、泌尿系统恶性肿瘤等。最初普通紫杉醇注射剂紫杉醇(商品名Taxol ®),为增溶加入辅料聚氧乙烯蓖麻油,聚氧乙烯蓖麻油低浓度用于其他药物处方中,如异丙酚、环孢霉素A和安定中,但紫杉醇制剂中所用蓖麻油的用量是这些药物用量的5倍多,这会带来严重过敏反应。因此,所有接受Taxol®的患者必须预先用皮质激素,H2拮抗剂和抗组胺预防可能产生的致命过敏反应。同时聚氧乙烯蓖麻油直接影响肺和血管内皮细胞,引起呼吸困难和血管舒张。普通紫杉醇制剂药代动力学变异性较大,且较短输液时间(<3h)会导致非线性药代动力学发生,而且紫杉醇可能被困在血浆聚氧乙烯蓖麻油胶束的疏水内部,从而使其难以分布到肿瘤内部,这些都是普通紫杉醇注射剂的缺点。
图3紫杉醇结构式
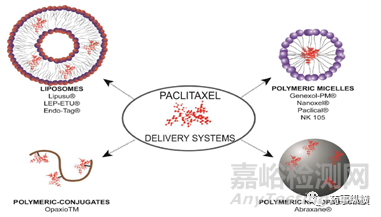
针对普通紫杉醇注射剂的缺点,多种新型纳米载药系统改良药出现,纳米载药系统优点有:a)改善药物的水溶性、化学稳定性、有效性和安全性,b)延长静脉注射后药物的生物分布时间,c)减少副作用。在肿瘤适应症,纳米载药系统因其EPR效应更具有优势,能将药物集中靶向到肿瘤内部。针对普通紫杉醇不良反应大、输注时间长、药代动力学差异大和难以到达肿瘤部位等缺点,不同的纳米载体紫杉醇相继上市:白蛋白结合型紫杉醇Abraxane®,脂质体Lipusu®,聚合物胶束:Genexol®、Nanoxel®、Paclical®,聚合物结合型紫杉醇OpaxioTM等。Abraxane®是第一个经FDA批准上市的紫杉醇纳米药物,临床试验结果表明,这种纳米颗粒制剂与紫杉醇的治疗效果相当,即使Abraxane®在OS方面没有显示出优势,但他无需预用药而增加病人顺应性。目前上市的紫杉醇改良药集中在减小毒副作用上,在提高疗效上,纳米载药等新剂型还有很长的路要走。
图4紫杉醇纳米载体
多西紫杉醇
紫杉醇水溶性极低,得到多烯紫杉醇, 溶解度得到一定提高。但是多烯紫杉醇仍然属于难溶性药物, 无法进行口服制剂开发,开发的注射剂中需加入增溶剂进行增溶。针对多西紫杉醇的纳米递送途径,主要为多西紫杉醇胶束。
图5多西紫杉醇
注射改口服途径
针对紫杉醇胃肠道渗透性低的问题,通过与p-gp抑制剂联用,用于口服紫杉醇,方便病人服用,满足巨大临床需求。Oraxol就是利用这一原理,目前该药处于申请上市阶段。
Liporaxel则是紫杉醇的另一种口服处方,乳化制剂,处方组成包括单油酸、三甲苷、聚山梨酯80,辅料可使药物吸附于胃肠道,使药物能够通过胃肠道被吸收,目前该药已批准上市。
成功实施紫杉烷类药物传递策略将对未来的化疗药产生重大影响。首先,它将有助于消除这些药物的全身毒性,其次,它将提高肿瘤部位的药物生物利用度,从而允许使用较低的药物剂量。
4、结语
紫杉烷类药物从发现到现在近60年,其肿瘤治疗地位仍然无法撼动,除了得益于其独特的作用机制,科学家在结构上和递送系统上的创新优化不断延长其临床使用生命周期。使得一类理化性质较差的药物得以应用并造福于肿瘤患者。
参考文献:
ang, Y., Chung, H., Hong, J. et al. Absorptionmechanism of DHP107, an oral paclitaxel formulation that forms a hydratedlipidic sponge phase. Acta Pharmacol Sin 38, 133–145(2017).
Bernabeu E, Cagel M, Lagomarsino E, et al.Paclitaxel: what has been done and the challenges remain ahead[J].International journal of pharmaceutics, 2017, 526(1-2): 474-495.
HAO Tian-yun, WEI Yuan-feng, QIAN Shuai,ZHANG Jian-jun, GAO Yuan. Advances in strategies of improving solubility andpermeability of taxanes[J]. Acta Pharmaceutica Sinica, 2018, 53(1): 54-61.
Sun B, Straubinger R M, Lovell J F. Currenttaxane formulations and emerging cabazitaxel delivery systems[J]. NanoResearch, 2018, 11(10): 5193-5218.
Jing Y R, Zhou W, Wang X Y. T-13 and T-26,the novel taxanes with improved oral bioavailability in rats[J]. ScientificReports, 2020, 10(1): 1-4.
Skorik Y A, Golyshev A A, Kritchenkov A S,et al. Development of drug delivery systems for taxanes using ionic gelation ofcarboxyacyl derivatives of chitosan[J]. Carbohydrate polymers, 2017, 162:49-55.