您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-09-02 21:53
记忆合金肋骨接骨板通常采用镍钛形状记忆合金材料制成,利用其形状记忆特性,即在一定的条件下从临时形状恢复到原始形状的特性,实现肋骨骨折内固定。本文适用于《医疗器械分类目录》中按照第三类医疗器械管理的记忆合金肋骨板,对于非记忆合金肋骨接骨板和其他记忆合金产品(如胸骨内固定器械)也可参考。
记忆合金肋骨接骨板的结构与组成
提供产品各型号关键部位的结构图。在图示中标识关键尺寸信息及测量位置,例如记忆合金肋骨接骨板长度(L)、高度(H)、厚度(δ)、环抱臂内径(Φ)、环抱臂分布(环抱臂间距L1和数量S1-S4等)、弧度(α)、宽度(W)、镂空部位尺寸(如适用)等。明确产品各型号的关键尺寸及公差。开发者可结合申报产品特点选择关键尺寸参数进行规定以充分表征产品结构设计特征。
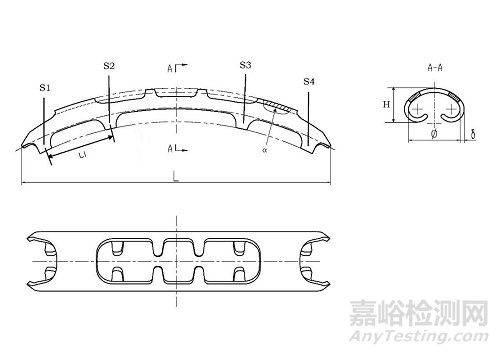
记忆合金肋骨接骨板结构图及其尺寸示例
记忆合金肋骨接骨板的材质
明确产品各组件的材料牌号及其符合的国家标准、行业标准、国际标准,材料牌号的描述需与其符合的标准一致。
记忆合金肋骨接骨板产品的主要风险
开发者需对产品全生命周期实施风险管理,充分识别产品的设计、原材料、生产加工过程、表面处理、后处理、产品包装、灭菌、运输、贮存、使用等产品全生命周期内各个环节的安全特征。从生物危险、化学危险、产品性能有关的危险等方面,如患者过敏、植入物断裂、相变温度漂移、与配合用手术工具的不匹配、环抱臂在低温撑开过程中发生损坏等,对产品进行全面的风险分析,并详述所采取的风险控制措施。
记忆合金肋骨接骨板的主要性能指标
产品技术要求性能指标一般包括:记忆合金肋骨接骨板关键尺寸(如记忆合金肋骨接骨板长度、环抱臂最大内径、厚度等)及公差,硬度,表面质量(外观、表面粗糙度、表面缺陷),形状回复力,形状回复率,相变温度,无菌(如适用),环氧乙烷残留量(如适用)。
记忆合金肋板的研究要求
1.化学/材料表征研究
针对记忆合金肋骨接骨板使用的记忆合金材料(如镍钛合金),需明确材料符合的标准并提供符合对应标准中的相应规定的研究资料,如化学成分、冶金结构、机械性能等,并开展后续加工过程对材料性能影响的研究。必要时,对最终产品化学/材料性能进行表征。
2.物理和机械性能研究
开发者需根据产品在临床使用中的受力情况,结合产品的结构设计、尺寸等因素,分别选取最差情况开展性能研究,并提供最差情况的确定依据。必要时,可以通过有限元分析最差情况并提交报告。
2.1弯曲性能研究
记忆合金肋骨接骨板在临床实际使用过程中,主要抵抗来自呼吸产生的肌肉牵拉力。为防止弯曲断裂,开发者需设计试验模型以评估记忆合金肋骨接骨板在受力时抵抗弯曲的能力,开展记忆合金肋骨接骨板弯曲性能的研究。研究需考虑产品的结构设计、尺寸规格、预期适用情形及其受力模式等影响因素,提供试验方法、参数设定(如加载模式、载荷大小、试验配置等)等的确定依据,分析论证试验结果的可接受性。
2.2抗滑动性能研究
记忆合金肋骨接骨板在临床实际使用过程中,需要抵抗呼吸产生的往复循环牵拉力。为防止出现轴向滑动,开发者需设计试验模型以评估记忆合金肋骨接骨板在受力时抵抗轴向滑动的能力,开展记忆合金肋骨接骨板抵抗轴向滑动性能的研究。研究需考虑产品的结构设计、尺寸规格、预期适用情形及其受力模式等影响因素,提供试验方法、参数设定(如加载模式、载荷大小、试验配置、工装设计等)等的确定依据,分析论证试验结果的可接受性。
2.3疲劳性能研究
记忆合金肋骨接骨板需要长周期重复承受人体呼吸收缩、扩张肺的收张力和肌肉牵拉力。为避免出现疲劳断裂或松脱,开发者需设计试验模型以评估记忆合金肋骨接骨板的疲劳性能。研究需考虑产品的结构设计、尺寸规格、预期适用情形及其受力模式等影响因素,提供试验方法、参数设定(如加载模式、载荷大小、循环次数、试验配置等)等的确定依据,分析论证试验结果的可接受性。
2.4相变温度、形状回复力、形状回复率性能研究
记忆合金肋骨接骨板需验证其“形状记忆”功能,开发者需设计试验模型以评估记忆合金肋骨接骨板整体及单臂(反复弯折后)的相变温度、形状回复力、形状回复率性能。研究需考虑产品的结构设计、尺寸规格、预期适用情形及其受力模式等影响因素,提供试验方法、参数设定(如原始尺寸、撑开尺寸、恢复后尺寸、撑开和回复次数、试验配置等)等的确定依据,分析论证试验结果的可接受性。
3.生物学特性研究
产品的生物学评价需涵盖终产品,按照GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》中的系统方法框图及《国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知》中的审查要点进行风险评价,需充分考虑产品疲劳前后镍离子析出(可参考YY/T 1823《心血管植入物镍钛合金镍离子释放试验方法》)的影响。生物学评定终点一般包括细胞毒性、致敏、刺激或皮内反应、材料介导的致热性、急性全身毒性、亚急性毒性、慢性毒性、亚慢性毒性、植入反应、遗传毒性和致癌性,必要时根据GB/T 16886系列标准进行生物学试验。
4.磁共振兼容性研究
申报产品若预期在磁共振(MR)环境中使用,建议开展MR环境下的行为属性的相关验证,根据YY/T 0987系列标准对产品在MR环境下的磁致位移力、磁致扭矩、射频致热、伪影等项目进行评估。需根据研究报告,列出MR试验设备、磁场强度、比吸收率(SAR)等试验参数及温升、位移力、扭矩及伪影评估结果,研究报告相关信息在说明书中予以明示。
如开发者未对申报产品进行MR环境下行为属性的相关验证,需明确该产品尚未在MR环境下对该产品的温升、移位状况及伪影进行测试评估,需在说明书的警示中注明相关内容,提示其存在的风险,由临床医生与医疗机构综合判断临床使用风险的可控性。
5.清洗和灭菌研究
5.1清洗
明确生产工艺中涉及的各种加工助剂(如切削液等)的质量控制标准。明确产品的清洗过程,提供经清洗过程后加工助剂残留控制的验证资料。对生产加工过程使用的所有加工助剂等添加剂均需说明使用剂量、对残留量的控制措施和接受标准以及安全性评价报告。
5.2灭菌研究
描述用于保证产品无菌的质量保证体系,明确灭菌工艺(方法和参数)和无菌保证水平(SAL)。产品的无菌保证水平(SAL)需达到10-6。
5.2.1生产企业灭菌
对于经辐照灭菌的产品,需明确辐照剂量及相关的验证报告,具体的剂量确定依据可参照GB 18280系列标准。
对于经环氧乙烷灭菌的产品,需提供灭菌结果确认和过程控制报告,具体可参照GB 18279系列标准。
5.2.2最终使用者灭菌
对于非灭菌包装的终产品,需明确推荐采用的灭菌方法并提供确定依据,并提供验证资料。采用其他灭菌方法的需提供方法合理性论证和工艺确认及过程控制报告。
6.动物试验研究
需按照《医疗器械动物试验研究注册审查指导原则第一部分:决策原则》决策是否需开展动物试验研究。如开展动物试验研究,需按照《医疗器械动物试验研究注册审查指导原则第二部分:试验设计、实施质量保证》进行,并遵循3R原则。需关注动物模型建立的科学性和合理性,以及对临床的借鉴意义。一般对于工作机理明确、设计定型,生产工艺成熟,且不改变常规用途的记忆合金肋骨接骨板产品不需要进行动物试验研究。
7.稳定性研究
申报产品需参照《无源植入性医疗器械稳定性研究指导原则》开展产品稳定性研究。稳定性研究一般包含货架有效期、使用稳定性和运输稳定性,其中货架有效期和运输稳定性研究包含器械本身性能稳定性和包装性能稳定性两方面。
7.1 货架有效期
医疗器械货架有效期的验证试验通常可分为加速稳定性试验、实时稳定性试验两类。无论加速稳定性试验还是实时稳定性试验,开发者均需在试验方案中设定测试项目、测试方法及判定标准。测试项目仅需评估产品随时间老化的相关性能,包括器械自身性能测试和包装系统性能测试两方面。其中器械本身性能稳定性需提供老化前后产品关键性能(如相变温度、形状回复率、形状回复力等)的验证对比资料。包装系统性能测试(如染色液穿透试验、气泡试验、材料密封强度试验等)目的是验证包装系统对微生物的屏障性能,即无菌状态/微生物限度要求的保持。对于灭菌产品,需要明确灭菌方式与产品的包装材料、包装工艺及方法的适配性。
若开发者开展其他医疗器械的货架有效期验证,需开展其与本次申报产品在原材料、灭菌方法、灭菌剂量、包装材料、包装工艺、包装方式及其他影响阻菌性能的因素方面具有等同性的证明研究。不同包装、不同灭菌方式的产品需分别开展验证。
7.2 运输稳定性
开展运输稳定性验证研究,证明规定的运输条件不会对医疗器械的特性和性能造成不利影响。运输稳定性验证应依据适用的国内、国际标准和验证方案进行,如:产品包装的跌落试验、振荡试验等。

来源:嘉峪检测网


