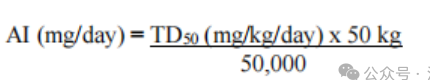以下亚硝胺杂质的相关总结,主要是参考FDA的文件《Control of Nitrosamine Impurities in Human Drugs Guidance for Industry(人用药物中亚硝胺杂质的控制行业指南)》和《Recommended Acceptable Intake Limits for Nitrosamine Drug Substance-Related Impurities (NDSRIs) Guidance for Industry(亚硝胺类药物杂质(NDSRIs)推荐可接受摄入量限度行业指南,RAIL 指南)》进行的,对亚硝胺杂质的分类、形成脉络、相关杂质的控制限度、以及可能的控制措施进行了一个总结。目前国内还颁布了《化学药物中亚硝胺类杂质研究技术指导原则(试行)》,在CDE的审批过程中,也与对该项进行过多次发补,故也是我们药品开发过程中需要重点关注的内容。
01亚硝胺杂质的分类:
现在普遍存在的亚硝胺类杂质,主要是分为两种结构类别,一类是小分子亚硝胺类杂质,还有一类是亚硝胺药物物质相关杂质(NDSRIs)。
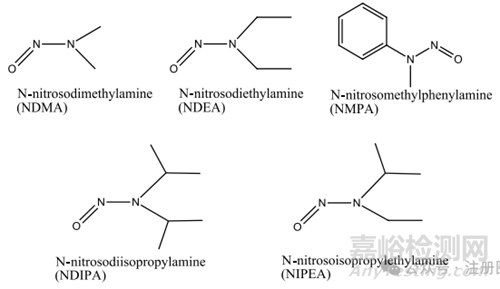
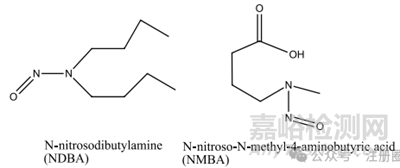
1.1 小分子亚硝胺类杂质:该类杂质与药物的结构相关性不高,可能存在与多种药物中。目前主要包含N-亚硝基二甲胺(NDMA)、N-亚硝基二乙胺(NDEA)、N-亚硝基甲基苯胺(NMPA)、N-亚硝基二异丙胺(NDIPA)、N-亚硝基异丙基乙胺(NIPEA)、N-亚硝基二丁胺(NDBA)和 N-亚硝基-N-甲基-4-氨基丁酸(NMBA),结构式详见图1。
▲图1-小分子亚硝胺杂质结构图
1.2 NDSRIs:该类杂质与药物活性成分(API)的结构相关的亚硝胺类杂质(化学结构中一般含有API或者API的片段,对于每一种API来说都是不一样的),一般是API在合成、储存过程中产生。与小分子亚硝胺的典型区别在于是否与药物中的活性成分的结构相似性。
02亚硝胺杂质形成的原因
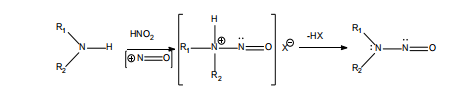
亚硝胺[(R1N(-R2)-N=O)]是一类亚硝基与胺基结合形成的化合物,如图2所示,这些胺类[仲胺(二级胺)、叔胺(三级胺)和季胺(四级胺)]的化合物与亚硝酸(一般是酸性条件下的亚硝酸盐)之间进行亚硝化反应,生成亚硝胺类的杂质。还有一种情况是1,1-二取代肼类化合物,该类化合物可以被氧化,从而形成亚硝胺。
▲图2-形成亚硝胺的代表性反应(二级胺)
在前体胺(二级、三级、四级胺或者亚硝酸盐都被称为前体胺)存在的情况下,若将叠氮化物作为引入四环唑或者叠氮基团的引入剂,当采用亚硝酸作为残留叠氮化物的猝灭剂的时候,亚硝胺类杂质的产生风险会被提高。
2.1 在药物活性成分中,小分子亚硝胺类杂质存在的原因
① 合成过程中,当原材料、中间体、API(或者API的降解产物)、试剂或者催化剂中出现二级胺、三级胺或者四级胺,又同时存在亚硝酸(或者亚硝酸盐与酸性条件)时,就会形成亚硝胺类杂质。
② 酰胺溶剂在有些条件下会发生降解,就会产生二级胺(例如,高温条件下N,N-二甲基甲酰胺会被降解为二甲胺)。二级胺(二甲胺)也可能作为杂质存在于酰胺溶剂中。三级胺或者四级胺作为试剂,也可能会引入二级胺。
③ 供应商采购的原材料也可能带来亚硝胺或者它的前体。比如:溶剂运输过程中,杂质在存储容器之间的转移;API起始材料或者中间体在生产时,与其他工艺产生的亚硝胺杂质的较差污染等,也是我们需要关注的点。
④ 回收使用的溶剂、试剂和催化剂也可能作为亚硝胺杂质的来源,因为回收使用的物料很可能会用于不同的生产工艺,可能带来亚硝胺杂质的交叉污染。
⑤ 缺乏工艺优化和控制措施(例如在高温干燥和气流粉碎工艺中,空气中的氮氧化物与活性成分中可能存在的二级胺、三级胺或者四级胺反应,就会为亚硝胺的形成创造可能的条件)。
2.2 非药物活性成分来源的药物产品中的亚硝胺
① 辅料中引入(多种常用辅料中含有亚硝酸盐、饮用水中也可能含有亚硝酸盐)
② 包装容器和制造设备也可能引入亚硝酸盐或者亚硝胺类杂质(因此在包材的可提取物或浸出物的研究中需要对此类杂质进行评估)
2.3 NDSRIs存在于药物产品的根本原因
NDSRIs可在药物产品的制造过程中或成品药物产品的储存期间产生。现在已知的根本原因有:
① 亚硝化杂质(如辅料中的残留亚硝酸盐或药物产品中存在的其他亚硝酸盐),在某些条件下导致含有二级胺、三级胺或者四级胺的活性成分亚硝化产生NDSRIs。
② 从活性成分本身带入的NDSRIs。(一般情况下,高水平的NDSRIs更多与药物产品相关,因为其通常是由药物活性成分与药物产品中存在的亚硝酸盐杂质之间的反应产生的,基于该原因,也会导致存储期间的亚硝胺杂质的增加)
03亚硝胺杂质的控制限度
基于亚硝胺杂质是可能或者疑似的人类致癌物,故我们需要对其进行风险控制,常用AI(可接受摄入量)来进行风险评估。ICH M7(R2)中定义的AI限度是基于药物物质(活性成品)和药物产品中致突变杂质的每日暴露量的保守假设,是在一生中(70年)使每100000名受试者中增加一例癌症风险的近似水平。
特别注意:而ICH发布的行业指南《Q3A新药原料中的杂质》(2008年6月)以及《Q3B(R2)新药制剂中的杂质》(2006年8月)则适用于用于治疗晚期癌症的药品中存在的亚硝胺杂质。
确定AI限度值可以用以下方法进行确认:
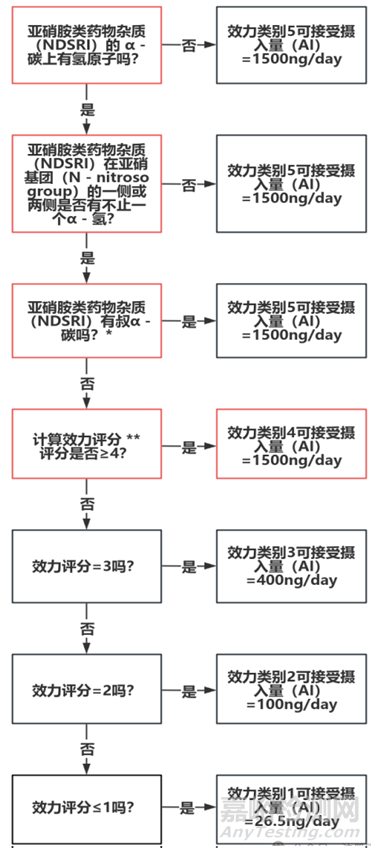
3.1 当特定亚硝胺化合物的可靠致癌性数据和其他安全信息(包括细菌致突变性数据)不可用时,FDA推荐使用预测致癌效力分类方法确定AI的限度。
FDA公布的RAIL指南中的预测致癌效力分类方法主要是适用于N-亚硝基基团两侧各带有碳原子的NDSRIs,其中碳不直接与杂原子双键相连(即N-亚硝基酰胺、N-亚硝基脲、N-亚硝基胍和其他相关结构除外)。此外,预测致癌性潜力分类方法不适用于氮亚硝基团位于芳香环内的N-亚硝基化合物(例如,亚硝化的吲哚)。对于含有2个亚硝化基团的NDSRIs,应使用预测致癌效力类别最高的组来确定整个分子的推荐AI限度。
该方法假设许多亚硝胺的致突变和高致癌反应是由代谢激活的α-羟基化机制引起的。因此,直接增加或减少激活机制有利的结构特征,或者通过其他生物途径增加亚硝胺清除率的结构特征,都会对致癌活性产生相应的影响。
FDA基于NDSRIs的预测致癌效力分类方法,推荐了以下的AI限度。
▲表1- 五类预测致癌性效力分类及其对应的NDSRIs推荐Al限度
|
效力类别
|
推荐的AI(ng/天)
|
说明
|
|
1
|
26.5
|
建议的AI限值(26.5 ng/天*)等同于基于最强效且经过充分测试的亚硝胺类物质—N-亚硝基二乙胺(NDEA)的类别特定限值。此类别中的 NDSRIs被预测为具有不高于亚硝胺杂质类别特定限值的致癌活性。
|
|
2
|
100
|
推荐的100ng/天的Al限度代表了两种有效的,经过严格测试的亚硝胺,N-亚硝基二甲胺(NDMA)和4-(甲基亚硝胺)1-(3-吡啶基)-1-(丁酮)(NNK),它们的推荐的Al限度分别为96ng/天和100ng/天。归类为2类的NDSRIs的致癌效力预计不高于NDMA和NNK。
|
|
3
|
400
|
此类别中的NDSRIs与类别2相比,致癌活性较低,例如,由于存在弱去激活结构特征。设定推荐的AI限度是为了反映致癌效力比第2类降低4倍的化合物。
|
|
4
|
1500
|
此类别中的NDSRIs可能通过α-羟基化途径进行代谢激活,但预计致癌活性较低,例如,由于该途径受到空间或电子影响,或者由于优先考虑清除途径。根据ICH M7(R2)的毒性关注阈值(TTC),建议的AI限度为1500ng/天。
|
|
5
|
1500
|
第5类的NDSRIs,由于空间位阻或缺乏a-氢,预计不会通过a-羟基化途径代谢激活,或者预计形成不会和DNA反应的不稳定的物质。根据ICH M7(R2)的TTC,推荐的Al限度为1500ng/天。
|
对于在美国市场销售的产品,即使其他监管区域推荐不同的限度,FDA推荐类别1的AI限度为每天26.5纳克。
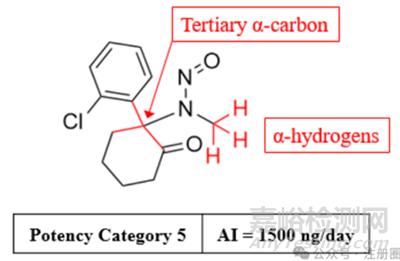
▲图3-预测NDSRI致癌性类别及确定相关推荐Al限度的流程图(叔-α-碳定义为一个处于sp3杂化状态的α-碳)
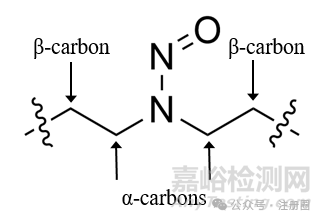
▲图4-在NDSRI上的α-和β-碳原子结构
如上所述,推荐的AI限度适用于当在药品中的单个NDSRIs,如果识别出超过一个(NDSRIs和小分子亚硝胺类杂质),并且检测结果的总和超过了基于最严格的亚硝胺杂质推算出来的限度,就需要和FDA进行充分沟通(如果涉及药物短缺的情况,更应该充分评估后采取适当的行动)。
关于如何对亚硝胺杂质的效力进行评分,可以采用以下方法:
▲表2-每个α-碳上氢原子的数量(数量少的排在前面)及相应的α-氢评分。每个α-碳上氢原子的数量,从最少的开始例子=a-氢评分0,2
|
每个α-碳上氢原子的数量,从最少的开始
|
例子
|
=a-氢评分
|
|
0,2
|
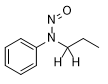 ![]() ![]()
|
|
|
0,3
|
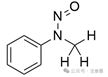 ![]() ![]()
|
2
|
|
1,2
|
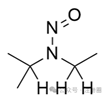 ![]() ![]()
|
3
|
|
1,3
|
 ![]() ![]()
|
3
|
|
2,2
|
 ![]() ![]()
|
1
|
|
2,3
|
 ![]() ![]()
|
1
|
备注:示例仅用于说明,并非详尽无遗。
$甲基α-碳不是乙基部分的一部分时,评分为3分。如果甲基α-碳是乙基部分的一部分,则应评分为2分。
▲表3-无活性特征列表及关联评分
|
无活性的特性
|
例子
|
单个无活性特征评分
|
|
分子上任意位置的羧基
|
 ![]()
|
+3
|
|
吡咯烷环上的N-亚硝基
|
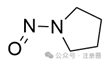 ![]()
|
+3
|
|
含有至少一个硫原子的六元环中的N-亚硝基
|
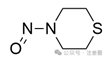 ![]()
|
+3
|
|
五元或六元环上的N-亚硝基*
|
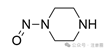 ![]()
|
+2
|
|
吗啉环上的N-亚硝基
|
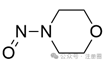 ![]()
|
+1
|
|
七元环上的N-亚硝基
|
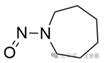 ![]()
|
+1
|
|
无环N-亚硝基两侧连续的5个非氢原子链(环或无环)。每个环上不超过4个原子即可在同一条链上
|
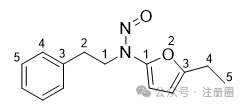 ![]() ![]()
|
+1
|
|
吸电子集团**仅与N-亚硝基团的α-碳原子相连(无论环状或非环状)
|
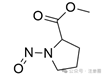 ![]()
|
+1
|
|
吸电子集团**与N-亚硝基团两侧的α-碳原子相连(无论环状或非环状)
|
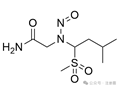 ![]()
|
+2
|
|
羟基连接到N-亚硝基团单侧的β-碳原子***上(无论是环状还是非环状)
|
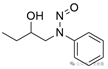 ![]()
|
+1
|
|
羟基连接到N-亚硝基团两侧的β-碳原子***上(无论是环状还是非环状)
|
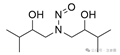 ![]()
|
+2
|
为了计算无活性特征评分,需要对NDSRI结构中列出的所有存在的无激活特征进行单个评分的总和。表格中的每个无激活特征行只能被计算一次。对于NDSRIs的N硝基基团位于多个环内的情况,应仅应用与最小匹配环对应的特征评分。示例旨在说明,并非详尽无遗。
*排除了N-亚硝胺基位于吡咯环、包含至少一个硫原子的六元环或吗啉环(分别计数)的情况。
**排除了羧酸(单独计数)和酮(数据冲突)、以及芳基(单独计数)。额外吸电子基团示例仅限于Cross KP和Ponting DJ在2021年发表于Comput Toxicol期刊上的(N-亚硝胺活性的结构-活性关系的发展)一文中描述的“β-碳吸电子基团”。
***β-碳电子必须处于sp3杂化状态(碳原子通过单键与其他原子相连),以便此特性适用。
▲表4-有活性特征列表及关联评分。
|
有活性的部分
|
例子
|
单个有活性部分得分
|
|
与α-碳键合的芳基(即N-亚硝基上的苯基或伪苯基取代基)
|
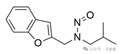
|
-1
|
|
与β-碳键合的甲基(环或无环)
|
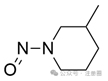
|
-1
|
计算有活性的特征评分,需对NDSRI结构中列出的所有存在的有活性特征的单个评分进行求和。表格中的每个有活性特征行仅能计数一次。示例旨在说明性使用,并非详尽无遗。
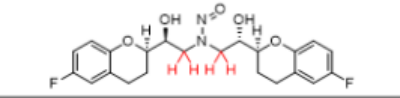
以下是示例1,如何应用预测致癌活性分类方法流程图(图1)到假设的NDSRIs,N-亚硝基-1-奈必洛尔。计算得出N-亚硝基-1-奈必洛尔的分数为4,因此将其归类为类别4,并与每日推荐可接受摄入量限度1500ng相关联。
例1:N-亚硝基-1-奈必洛尔
|
α-氢的计数
|
分数
|
红色突出显示的功能
|
|
2,2
|
1
|
|
|
去活化特性
|
分数
|
红色突出显示的功能
|
|
N-亚硝基两侧与β-碳***键合的羟基(环或无环)
|
+2
|
|
|
在无环硝基的两侧有≥5个连续的非氢原子链(环或无环)。每条链上不超过4个原子可在同一环上
|
+1
|
|
|
不存在活性特征
|
|
|
|
效力值=1+2+1=4
|
效力等级4
|
AI=1500ng/天
|
***β-碳必须处于sp3杂化状态,以便此特性适用
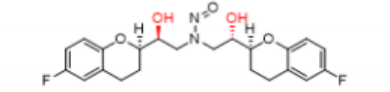
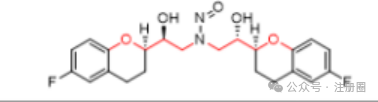
以下是示例2,展示了预测致癌性毒力分类方法流程图(图1)如何应用于假设的NDSRIs,N-亚硝基氯酮胺。N-亚硝基氯胺酮被归类为类别5,与之关联的推荐可接受摄入量限度为每天1500 ng。
例2:N-亚硝基氯胺酮
3.2 确定特定亚硝胺的AI限度的其他方法可以基于数据库和文献搜索可用的致癌性和细菌致突变数据,或使用特定化合物进行体内和/或体外测试。
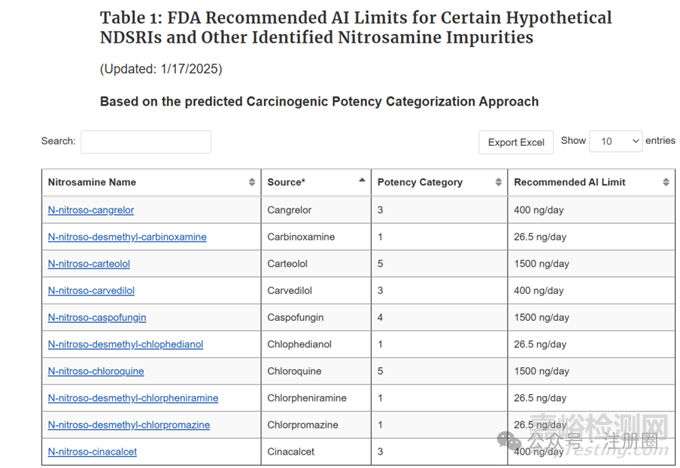
FDA网站上也收录了一些化合物的AI推荐值,详见https://www.fda.gov/regulatory-information/search-fda-guidance-documents/cder-nitrosamine-impurity-acceptable-intake-limits。
▲图5-FDA官网推荐的亚酰胺杂质AI限度(仅示例)
除FDA官网外,也可以通过the Carcinogenicity Potency Database(CPDB)或者the Lhasa Carcinogenicity Database(LCDB)这两大数据库查询亚硝胺杂质的TD50。化合物特异性 AI 限度可基于啮齿动物致癌性效力数据计算,例如在公开文献中确定的导致50%肿瘤发生率的剂量(TD50 值)。导致50%肿瘤发生率的剂量相当于1:2的癌症风险概率水平。
AI限度可以通过以下公式进行计算(50kg为人体体重):
以下以N-亚硝基二甲胺(NDMA)为例说明AI限度的推导过程。NDMA在几种物种中被确定为致突变致癌物,并被美国环境保护署的综合风险信息系统计划列为可能或疑似人类致癌物。根据致癌性效力数据库,NDMA的TD50值为0.0959 mg/kg/天(大鼠)和0.189 mg/kg/天(小鼠)。对于AI限度计算,使用大鼠的较低值(更保守)。与1:100,000癌症风险相关的AI限度(在70年暴露期内)通过将TD50除以50000然后乘以50(考虑50 kg体重的患者)计算得出,结果为0.0000959mg/天的NDMA,约为96ng/天的NDMA。因此,每日终身摄入96ng /天的NDMA对应于理论癌症风险,因此在作为杂质存在时可以代表AI限度。
当一种杂质如ICH M7(R2)附录中所述的致癌性研究数据不可用或质量较差时,FDA推荐使用预测致癌效力分类方法确定AI限度。
3.3 可以使用具有可靠致癌性数据的结构相似替代物进行的交叉分析,这种可替代物要求结合和反应性上与被替代物类似(取代的程度、空间位阻、电子效应、代谢激活的可能性以及生成的代谢物的稳定性、反应性和整体的分子量),并且要求有可靠的致癌数据可用。
① 基于替代物的再交叉评估:应遵循ICH M7(R2) 指南中关于预测致突变潜力的建议,可以执行(定量) 结构-活性关系(Q)SAR分析。通常情况下,替代物应该选择有稳健的致突变性和致癌性数据的亚硝胺杂质,比如:NDMA,N-亚硝基哌啶(NPIP),4-(甲基亚硝基氨基)-1-(3-吡啶基)-1-丁酮(NNK),N-亚硝基吡咯啶(NPYR), 和N-亚硝基吗啉(NMOR)。
② 若需进行致突变性评估,可进行细菌致突变性试验。
3.4 如果以上三种方法都无法确定亚硝胺化合物的AI限度,建议使用26.5 ng/day作为AI限度。
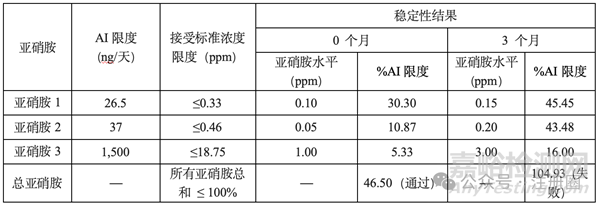
3.5 当药物产品中可能存在多种亚硝胺杂质时,可以使用一种替代的灵活AI限度方法来建立规范。
以下方法可用于建立小分子亚硝胺和亚硝胺类药物杂质(NDSRIs)的规格限度。
当同一药物产品中可能存在多种亚硝胺时,可使用灵活方法控制总亚硝胺杂质的水平,以满足基于1:100000增加癌症风险的推荐可接受摄入量(AI)限度。每个单独的亚硝胺应计算为其AI限度的百分比,使得所有亚硝胺的总和不超过100%。总亚硝胺的计算如下:
其中Xi是每个单个亚硝胺i的含量[以百万分之一(ppm)为单位],AIi是每个亚硝胺的AI限度(以ppm为单位),n不超过3。
以下是一种药物产品中多种亚硝胺杂质总推荐AI限度的灵活方法示例。药物A的最大日剂量为80mg/天:
总亚硝胺是每个单个亚硝胺AI限度百分比的总和。不超过100%意味着理论癌症风险不超过1:100,000。
如果提议的总亚硝胺限度方法不同于上述方法,或者在一种药物产品中检测到超过三种不同的亚硝胺,鼓励制造商和申请人联系 FDA。
04亚硝胺杂质控制的推荐三步缓解策略
4.1 先对API、上市产品以及已批准和待批申请产品中亚硝胺杂质进行风险评估。
4.2 当风险评估的结果显示有可能存在亚硝胺杂质时,应当进行确认测试。(因为亚硝胺杂质一般情况下分子量比较低、有部分的挥发性、并且杂质的毒性比较高),故需要开发有高专属性和高灵敏度的检测方法。
4.3 可以对工艺等进行相应的变更,以减少亚硝胺杂质的产生。并向对应的监管机构提交该变更。
一般而言,对亚酰胺杂质的评估不仅包括小分子亚硝胺内物质,也包含NDSRIs,如果检测到NDSRIs水平高于推荐的AI限度,建议生产商和申请人制定控制策略或/和设计方法,将其控制在可接受水平。
05减轻药物活性成分(API)中亚硝胺杂质的控制措施
一般情况下,在合成路线开发过程中优化API的制造工艺设计,能够尽可能的减少或者防止亚硝胺杂质的形成。包含以下措施:
5.1 尽可能避免可能产生亚硝胺杂质的反应条件。
5.2 如果合成工艺路线中有可能形成亚硝胺的话,就尽可能使用除二级胺、三级胺或四级胺之外的碱,也尽量避免使用酰胺类的溶剂(N.N-二甲基甲酰胺,N,N-二甲基乙酰胺或者是N-甲基吡咯烷酮),在必须使用时,需要进行风险评估。
5.3 用其他的反应猝灭剂代替亚硝酸盐用于叠氮化物的分解,若必须使用,可以考虑将叠氮化物先从反应混合物中分离出来,然后在不接触API、中间体或者拟回收溶剂的情况下,用亚硝酸猝灭叠氮化物(例如反应物和叠氮化钠可以通过有机相和水相分离的情况)
5.4 优化并持续控制反应、工艺和反应条件(如pH值、温度和反应时间)的顺序。
5.5 设计能在后续加工步骤中清除亚硝胺杂质的工艺步骤。
5.6 对反应中涉及的起始物料、中间体、回收材料和水中的亚硝胺杂质均应该进行评估。
对于亚硝胺杂质检测结果高于限度10%的药物活性成分,制造商在放行时应该进行每批检测;对于超过限度的药物活性成分,不允许分销。
06减轻药物产品中亚硝胺杂质的控制措施
6.1 选择可靠的药物活性成分的供应商。关注药物活性成分的合成工艺路线,关注多批药物活性成分中的亚硝胺杂质的检测结果。
6.2 对药物产品,建立恰当的亚硝胺杂质的控制规范。
◆ 对于检测结果超过限度的10%的时候,就应对药物产品中的亚硝胺杂质进行检测(包括稳定性留样的药物产品)。
◆ 当由于API结构、API 合成工艺路线或制造工艺而存在显著的亚硝胺形成风险时,也建议采用控制策略。
◆ 对于有检出,但是未超过规定限度的10%的药物产品,需要对验证批次和对监管批次进行亚硝胺杂质的检测。当其制造过程、辅料、API或者其他关键要素发生变更,可能导致产品生命周期中亚硝胺形成时,也需进行检测。
◆ 超过控制限度的药物产品,在原则上不允许用于分销。
6.3 尽可能对产品处方或者生产工艺进行优化,以减少或预防产品中的NDSRIs形成。
◆ 对辅料进行筛选,选择不含亚硝酸盐或者含亚硝酸盐但是含量低的辅料,降低辅料引入亚硝酸盐的风险。
◆ 设计药物产品时加入抗氧化剂[如抗坏血酸(维生素 C)、抗坏血酸盐(如抗坏血酸钠)、α-生育酚或没食子酸丙酯],少量加入会显著抑制药物产品中NDSRIs的形成。
◆ 修改产品处方的pH环境,从酸性变更为中性或偏碱性。(例如在处方中加入碳酸钠)
07对于亚硝胺杂质测定结果的评估
◆ 若进行风险评估后,证明亚硝胺杂质不会在药物产品或活性成分中存在,就可以不用进行确认性测试。
◆ 若无法完全说明亚硝胺杂质不存在,就需要进行确认性检测(至少三个代表批次),检测结果中,控制限度的10%是一个很关键的值,如果测定结果(含稳定性数据)低于限度的10%,就可以不用在活性成分或者药物产品中建立亚硝胺杂质的控制限度,对于已经批准的药品,测定结果可在年报中汇报;若测定结果(含稳定性数据)高于限度的10%,就需要建立产品的控制标准,并对放行及稳定性产品进行检测,对于已经获批的产品,需要作为变更提交补充资料。
◆ 若检测结果超过控制限度,就需要进行配方、制造工艺或者包装的变更,来减缓相应的亚硝胺杂质的产生。如果有制造商或供应商有更合理的限度设定,可以与FDA进行沟通。
注:亚硝胺杂质的检测方法也可在FDA网站上进行查阅。https://www.fda.gov/regulatory-information/search-fda-guidance-documents/cder-nitrosamine-impurity-acceptable-intake-limits