您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-06-05 13:55
01.研究背景
皮肤是人体最大的器官,具有保护、感知与调节机体的功能。由于皮肤与外界环境直接接触,因而更容易受到物理的、化学的和/或生物的损伤。使用敷料进行皮肤伤口护理最早可追溯自4000年前的古埃及人。传统的伤口敷料,例如纱布、绷带和脱脂棉等,仅仅起到吸收渗液和隔离的作用。而且,由于较强的吸水性和较差的保水性,这些敷料吸收渗液后很容易变干、变硬,不利于伤口的愈合;此外,直接与创面接触的敷料层易于与新生皮肤肉芽组织长成一体,揭除时不可避免地会造成二次损伤。现代伤口敷料由多种天然的和/或人工合成的聚合物制成,形式多样,包括但不限于薄膜、泡沫和凝胶等。现代敷料不但具有传统敷料的隔离和吸收多余伤口渗液的功能,还可使伤口保持一定的湿度,从而促进伤口愈合(依据湿性伤口愈合理论)。此外,现代敷料对创面的粘附力较低,有利于定期更换,避免二次损伤。
对于难愈性慢性皮肤伤口而言,除了要具有隔离、吸收渗液和保持伤口湿润功能外,赋予水凝胶更多的先进功能比如抗菌、黏附/止血、抗氧化、药物递送、刺激响应性、导电性、以及最近兴起的伤口监测等尤为重要。先进功能水凝胶敷料的制备除了需要考虑选择合适的凝胶化材料,制备方法和策略也很关键。综述文章“Functional Hydrogels as Wound Dressing to Enhance Wound Healing”,系统地总结了科学研究和临床应用中先进功能水凝胶敷料的常用制备策略。
02.伤口愈合的基本过程
伤口愈合是恢复皮肤完整性及其功能的过程,它通常包括4个连续的、相互重叠的阶段,即止血(仅对于有出血的伤口)、炎症、增殖和重塑(图1)。不同的阶段有不同的细胞行为,涉及不同的细胞类型。
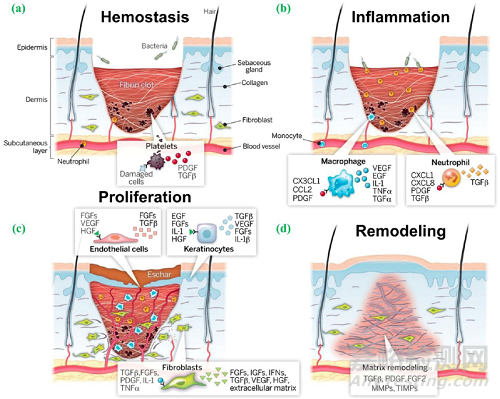
图1. 伤口愈合的4个阶段,即止血、炎症、增殖和重塑阶段。
03.先进功能水凝胶的制备策略
文中总结了多种先进功能水凝胶敷料的制备策略。水凝胶的先进功能主要包括抗菌、抗氧化、自愈合、黏附/止血、药物递送、导电性、刺激响应性和伤口监测等(图2)。下面将对各种先进功能的水凝胶敷料的制备策略逐一进行简要描述。
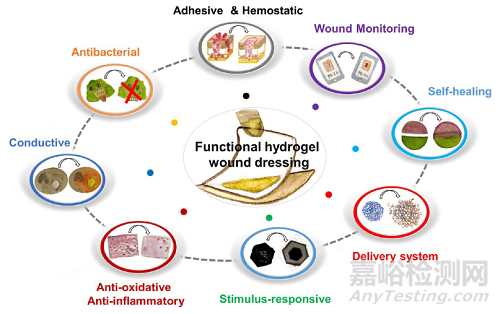
图2. 水凝胶敷料的先进功能。
3.1抗菌水凝胶敷料制备策略
细菌感染是伤口愈合中最常见且不可避免的挑战。目前临床上治疗感染性伤口的首选策略仍然是使用抗菌药物,包括抗生素如阿莫西林、环丙沙星及其他抗菌药物如聚维酮碘、醋酸氯己定。为了解决细菌耐药性的问题,科学家们一直在努力寻找新的抗菌策略,形成了以下3种抗菌敷料制备策略:1)将水凝胶与具有广谱抗菌作用的金属离子如银离子、锌离子和铜离子等结合,来达到抗菌的效果;2)将水凝胶与具有光热效应的金属材料和碳基材料如碳纳米管和石墨烯等进行组合,通过光热效应来实现抗菌目的;以及3)使用带有正电荷的材料,或在支架材料上偶联带正电荷的多肽序列来制备抗菌水凝胶敷料。壳聚糖因具有正电荷而被广泛应用于抗菌敷料的开发。正电荷可与带负电荷的细菌细胞膜结合,通过破坏细菌细胞膜从而杀死细菌(图3)。

图3.常见的抗菌水凝胶敷料制备策略。
3.2黏附和止血水凝胶敷料制备策
止血是伤口愈合的早期阶段。作为一种基础功能,止血通常涉及对伤口进行封闭,因此常与黏附功能结合起来。黏附水凝胶可以牢牢地贴在伤口部位,防止出血的同时,还起到隔离和防止感染的作用。其制备策略之一为,使用具有一定粘附特性的多糖材料如葡萄聚糖、海藻酸钠和壳聚糖等进行制备。壳聚糖带有正电荷,可通过静电相互作用黏附到生物组织上。此外,较常见的黏附水凝胶制备策略为嫁接具有黏附特性或疏水相互作用的功能基团到支架材料上,赋予其组织黏附功能。常见的具有黏附特性的官能团包括醛基、巯基和多巴胺,它们可以与生物组织中广泛存在的氨基发生席夫碱反应,实现组织黏附。长链烷基可以通过疏水相互作用实现组织黏附(图4)。除了依赖水凝胶的黏附作用止血,止血还可以通过壳聚糖、季氨、阳离子多肽等带正电荷的材料与带负电的血细胞间的静电相互作用,促进血液凝固。添加钙离子,一种凝血因子,也是止血水凝胶敷料制备的一种策略(图5)。
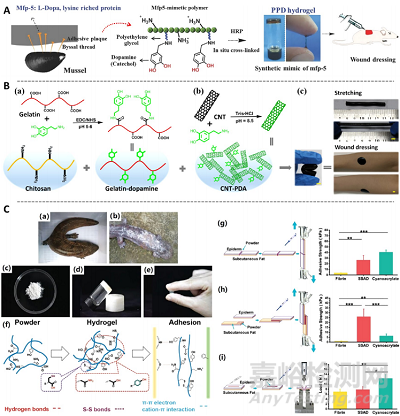
图4. 组织黏附水凝胶敷料制备策略。
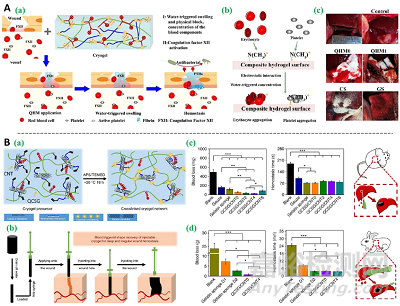
图5. 止血水凝胶伤口敷料制备策略。
3.3抗氧化和抗炎水凝胶敷料制备策略
炎症是伤口愈合的第二个阶段,主要涉及多种免疫细胞如巨噬细胞和中性粒细胞等的募集,该阶段的作用是杀死细菌和清除细菌碎片。过度炎症会引起创面高氧化应激和活性氧(包括超氧阴离子,过氧化氢,羟基自由基和一氧化氮)水平的升高,随后通过触发链式反应来破坏细胞,如脂质过氧化,或DNA和蛋白质的氧化,延迟伤口愈合。抗氧化剂可以中和高反应性的自由基,避免自由基对机体造成损伤。抗氧化水凝胶敷料制备时一般通过添加抗氧化的活性物质来达到抗氧化的作用。多酚抗氧化剂是一类常见的天然抗氧化剂,包括茶多酚,白藜芦醇、花青素和姜黄素等,常被用于制备抗氧化水凝胶敷料。多巴胺因其含有的儿茶酚基团亦具有良好的抗氧化作用,含有多巴胺的水凝胶显示了良好的抗氧化性。其他活性物质包括蜂蜜、芦荟、阿拉伯胶、丝胶、阿魏酸、栎精(槲皮素)、白芨多糖、黄芪甲苷和多巴胺样酚类化合物没食子酸(gallic acid)等均具有抑制炎症的作用。导电材料聚苯胺(polyaniline)和苯胺四聚体(aniline tetramer)亦被证实具有优异的DPPH自由基清除能力(图6)。
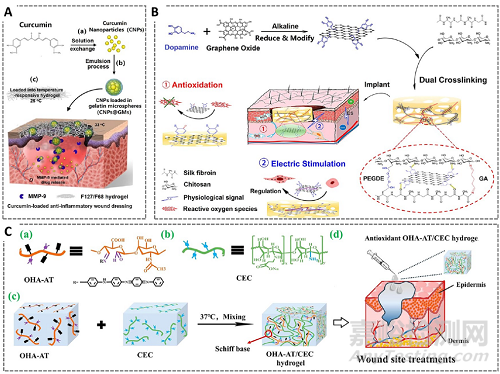
图6. 抗氧化和抗炎水凝胶敷料制备策略。
3.4可控药物递送水凝胶敷料制备策略
水凝胶的多孔结构使其天然地适于作为药物载体进行可控药物递送。抗生素是最常用的递送药物,而随着对伤口愈合机制的深入了解,可递送的物质已经扩展到活细胞、生长因子、细胞因子和趋化因子等。脂肪来源的干细胞(ADSCs)是常用的负载于水凝胶中用于促进伤口愈合过程中血管再生的细胞类型。研究发现,负载于水凝胶中的ADSCs可以表达各种促血管生成的生长因子如PIGF、VEGF和TGF-β。此外,水凝胶也可负载骨髓间充质干细胞(BMSCs)、人脐带间充质干细胞、成纤维细胞、表皮细胞和内皮祖细胞等用于伤口愈合。将生长因子负载于水凝胶中也是常用的水凝胶敷料制备策略。EGF和FGF是两种最常用的制备水凝胶敷料的生长因子。其中,FGF对血管再生、炎症控制、伤口愈合和神经再生等方面均有重要作用,但其较短的半衰期严重限制了它的应用。通过静电相互作用,生长因子可在一定时间长度内存储在水凝胶中,并可控按需释放,有效调节愈合进程,促进伤口愈合效果。此外,FGF-2、VEGF、KGF、血小板衍生的生长因子BB、白细胞介素-8、巨噬细胞炎症白-3α、基质衍生因子-1(SDF-1)和重组人粒细胞/巨噬细胞集落刺激因子(rhGM-CSF)也被装载到不同水凝胶中,并被证实可以促进肉芽组织形成、血管再生和再上皮化,从而促进伤口愈合。另外,药物递送水凝胶敷料还可用于递送气体包括O2(改善慢性缺氧创面)和NO(血管舒张作用)、miRNAs和其他功能物质如多肽和蛋白质等(图7)。
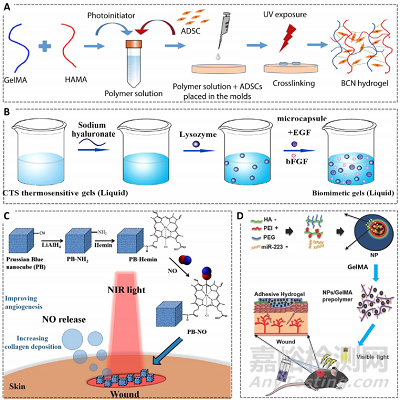
图7.可控药物递送水凝胶敷料制备策略。
3.5自愈水凝胶敷料制备策略
水凝胶敷料形成的物理屏障是防止伤口外部细菌感染的重要手段。然而,当暴露在外部张力或组织活动中时,一般的水凝胶容易断裂或破碎。自愈水凝胶可以在断裂的情况下自己愈合,恢复结构完整性。大多数自愈水凝胶是基于组分动态化学策略制备的,其中涉及到水凝胶交联网络形成过程中的动态和可逆化学键。自愈水凝胶根据其愈合机制可分为物理自愈水凝胶和化学自愈水凝胶。物理自愈水凝胶通过在分子、低聚物或聚合物链之间形成动态的非共价相互作用(包括疏水相互作用、宿主−客体相互作用、氢键、结晶、聚合物−纳米复合材料相互作用和多种分子间相互作用)来重建网络。三肽Phe-Gly-Gly酯衍生物和瓜环之间可通过宿主−客体非共价相互作用形成超分子水凝胶。得益于超分子水凝胶的动态特性,它可以在接触FDA批准的药物美金刚胺后溶解,使其很容易从伤口上清除(图8A)。相比于非共价交联的物理自愈水凝胶,化学自愈水凝胶目前应用更广泛,它们通过动态共价键,包括苯硼酸酯、二硫、亚胺、酰肼、可逆自由基反应和可逆Diels−Alder环加成,形成重建网络。其中,基于席夫碱(亚胺)结构的动态共价键是最常采用的化学自愈水凝胶伤口敷料制备策略。席夫碱结构是氨基和醛基相互作用形成的。例如,酰肼改性透明质酸和末端苯甲醛修饰的F127三嵌段共聚物可形成具有动态席夫碱结构和物理胶束的双交联水凝胶,具有快速凝胶和剪切变薄性能(图8B)。此外,基于金属配位和多巴胺动态结构的自愈水凝胶也是常用的制备策略。
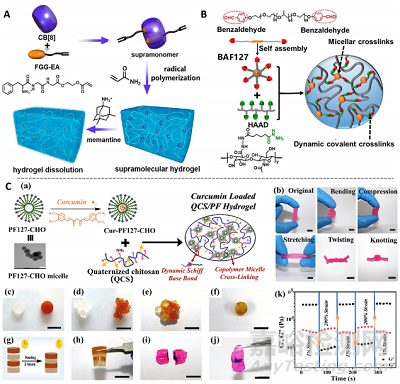
图8. 自愈水凝胶伤口敷料制备策略。
3.6 刺激响应水凝胶敷料制备策略
刺激响应性水凝胶能响应外部环境(如温度、pH值、光)的变化,产生不同程度的大小或形状变化。温敏水凝胶是一种常用的刺激响应伤口敷料制备策略。人体正常生理温度为37 ℃左右,而用于制备水凝胶伤口敷料的热敏材料一般具有低于生理温度的临界溶液温度(LCST),保证了其在正常体温下的凝胶行为。可注射的低温流动水凝胶前体溶液在生理温度下注入伤口后,可迅速转化为非流动水凝胶状态,大大简化了水凝胶的使用,使治疗过程简单、易于实现。通常用于制备温敏性水凝胶的材料有N-异丙基丙烯酰胺(NIPAM)单体及其聚合物PNIPAM(LCST约为32 ℃)、聚乙二醇(PEG)、聚异腈多肽(PIC)、甲基纤维素和羟丁基壳聚糖。PNIPAM水凝胶的疏水性随温度的升高而增加,导致溶胀率的降低。因此,基于PNIPAM的热敏药物释放水凝胶敷料在生理温度下发生疏水收缩,然后挤出多余的水,加速药物的释放,但在室温下没有药物被释放。PEG是一类常用的温敏水凝胶制备材料。其中,PF127包含亲水和疏水段,具有良好的热响应。将生长因子如bFGF在4 ℃下溶解于肝素-PF127混合溶液中,然后将混合后的溶液注射到伤口上,液体在37 ℃下立即凝胶化,成功装载生长因子。pH响应水凝胶是另一种常用的刺激响应伤口敷料制备策略。正常皮肤的pH维持在4−6的范围内。一旦皮肤受伤,伤口pH值在止血和炎症阶段会略有下降,而在增殖阶段pH会升高,最终修复伤口的pH将恢复正常水平(5.5−6.5)。然而,对于炎症异常持续的慢性伤口,如感染、烧伤、褥疮和糖尿病,pH值将始终保持碱性。利用这个特性,可以用含有抗炎作用的单宁酸的水凝胶来处理早期阶段的伤口,其酸性环境会促进单宁酸的释放,从而抑制细菌生长,促进伤口愈合。类似地,研究者们也制备了利用碱性环境促进药物释放的水凝胶敷料,用来处理碱性的慢性伤口。此外,pH响应水凝胶还可以用于实时监测伤口状态(详见3.8部分)。第三种常见的响应性水凝胶敷料制备策略为光响应策略,其最大的优势是容易控制。光响应水凝胶已在光热抗菌部分(3.1部分)提及,除了可以通过光热效应引起温度升高,光还可以引起物质的释放,如光基试剂孔雀石绿甲醇碱(MGCB)可在光照条件下释放氢氧根离子,引起pH值变化(图9)。
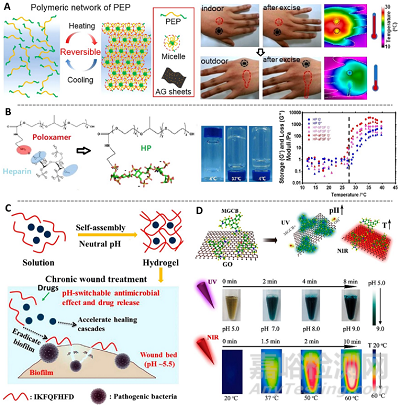
图9. 刺激响应水凝胶敷料制备策略。
3.7 导电水凝胶敷料制备策略
伤口愈合期间,创面带有的正电荷与周围整个皮肤带有的负电荷结合,形成所谓的皮肤电池。并且,创面处的内源性电场也被认为是一个导致细胞向创面定向迁移的信号。研究表明,向放置在创面上的电极施加外部电流(模拟创面的内源性电流)有利于巨噬细胞、中性粒细胞和角质形成细胞的迁移,并进一步加速伤口的闭合。利用皮肤的这个特性,同时考虑到进行外源性电刺激需要使用大规模的电子设备的局限性,制备导电水凝胶敷料正在成为一种非常有前景的策略。研究已证实,具有类似于皮肤电导率的电活性敷料,有利于伤口的再生和修复。制备导电水凝胶常用的导电材料包括聚苯胺、苯胺四聚体、碳纳米管、氧化石墨烯、聚吡咯、纳米银、聚噻吩及其衍生物PEDOT。多个研究表明,含有这些导电材料的电活性水凝胶敷料均能促进伤口愈合(图10)。例如,多巴胺修饰透明质酸和具有多巴胺涂层的还原氧化石墨烯通过儿茶酚基团的氧化偶联,形成了复合导电水凝胶,具有多种功能包括抗氧化、组织黏附和止血、导电、光热抗菌和药物缓释能力。此外,由甲基丙烯酸缩水甘油酯功能化季氨化壳聚糖(QCSG)、GelMA和氧化石墨烯(GO)制备的多重抗菌水凝胶,具有包括内在抗菌、光热抗菌和药物缓释抗菌等多重抗菌能力,并能有效抑制耐甲氧西林金黄色葡萄球菌(图10)。
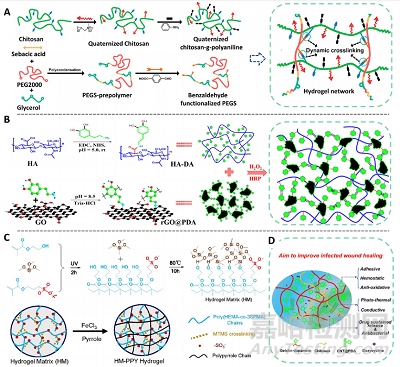
图10.导电水凝胶敷料制备策略。
3.8 伤口监测水凝胶敷料制备策略
伤口愈合是一个高度复杂的过程,伤口环境也在不断发生着变化,而实时地监测伤口环境的变化对适时地改变伤口处理策略是非常重要的。常见的伤口监测水凝胶敷料制备策略主要涉及可对温度、pH和/或葡萄糖水平等进行监测的传感器的整合。根据伤口环境的变化,将能响应这些变化的治疗策略如温敏药物释放等设计到水凝胶敷料中,可以实现更加精准的伤口控制和治疗。例如,有研究者将pH响应变色介孔树脂珠掺杂到海藻酸盐纤维上,并通过3D打印构建含有多孔pH传感器阵列的水凝胶。这种水凝胶可以通过测量颜色变化,提供伤口的实时数据如细菌感染和抗生素释放。
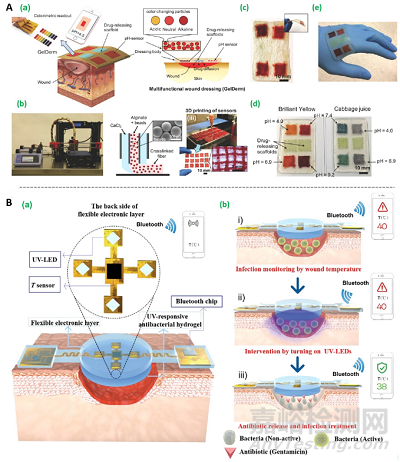
图11. 伤口监测水凝胶敷料制备策略。
04.总结与展望
作为最近几十年来广受关注的材料,水凝胶在伤口敷料领域的研究和应用逐年增加。随着材料科学的发展,伤口愈合机制的深入了解,以及临床需求的不断深化,水凝胶的功能也从原来的单一物理覆盖发展为现代的多功能复合,呈现出越来越智能化的趋势。该综述涵盖了科学研究和临床应用中水凝胶敷料的各种先进功能,包括抗菌、黏附和止血、抗炎和抗氧化、物质递送、自愈合、刺激响应、导电性、伤口监测以及实现这些功能的水凝胶制备策略。我们借此对先进功能水凝胶伤口敷料及其制备策略有了较全面的了解。同时也应该明白,从科学研究到临床应用是一条非常艰难的道路,需要科学家、企业家和临床医生不断的努力才有可能成功。
来源:Internet


