您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-23 17:21
环氧乙烷(EO)是一种广泛使用的化学灭菌剂,EO灭菌是医疗器械领域常用的灭菌方式之一。
在灭菌过程中,气态EO过物理和化学方式与微生物细胞内的生物大分子(如蛋白质、核酸等)发生反应,从而导致细胞的结构和功能的损伤,进而达到灭菌的效果,灭菌范围极广。加之EO具有穿透性强、灭菌温度低、对产品基本无损(相对于辐照灭菌)等特点,成为目前医疗器械尤其是一次性使用医械的主流灭菌方法之一,在国内外均有广泛使用 。
由于灭菌过程是一个特殊过程,过程确认是无菌保证的重要环节。EO灭菌确认有半周期法、部分阴性法等不同方法,各方法侧重点不同,但均会涉及到微生物挑战器械、EO残留、产品族分类等基本问题。在确定EO对医疗器械灭菌的适宜性时,重要的是在产品正常使用中EO、2-氯乙醇(ECH)和乙二醇(EG)残留水平对患者产生的最小风险。因此,EO灭菌残留量显得十分重要。
医疗器械环氧乙烷灭菌残留量测试常用标准
● ISO 10993-7:2008 Biological evaluation of medical devices Part 7: Ethylene oxide sterilization residuals —— 国际标准
● GB/T 42398-2023--医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量 —— 国家推荐标准,等同转化ISO 10993-7:2008
● EN ISO 10993-7:2008 Biological evaluation of medical devices - Part 7: Ethylene oxide sterilization residuals (ISO 10993-7:2008) —— 欧洲标准
● GB/T 14233.1-2022 医用输液、输血、注射器具检验方法 第1部分:化学分析方法 —— 国家推荐标准
● YY 0290.8-2008《眼科光学 人工晶状体 第8部分:基本要求》——医药行业标准
●《江苏省医疗器械环氧乙烷残留量(气相色谱法)注册自检现场检查指南(试行)》—— 地方标准
医疗器械产品开展EO灭菌残留量检测的注意考量点
1、检测分为两部分:浸提部分和仪器测定;
2、浸提部分根据标准还有样品的实际使用情况确定产品的浸提条件(浸提模式、取样方式、浸提时间、温度和加浸提溶剂的量等),仪器测定部分是固定的;
3、如果有特殊需求(如指定检测时间、指定检测部位),在标准允许的情况下可以满足,如果和标准冲突需要记录偏离并加以证明;
医疗器械产品开展EO灭菌残留量允许限量
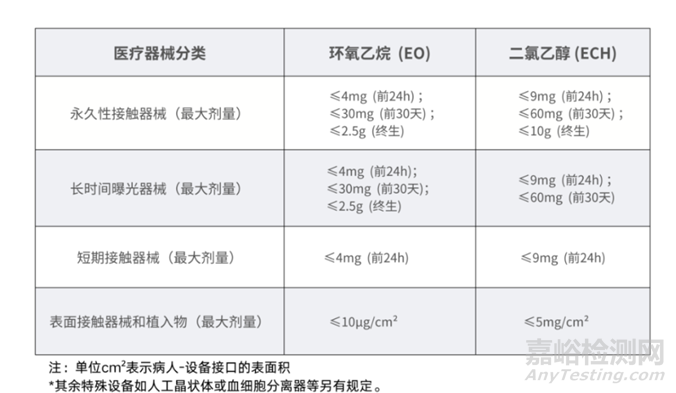

来源:Internet


