您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-07-05 09:02
|
品种 |
适应症 |
企业 |
批准日期 |
国产/进口 |
|
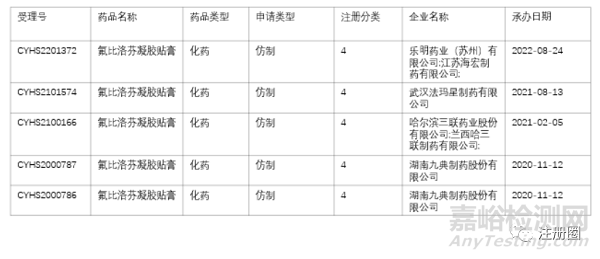
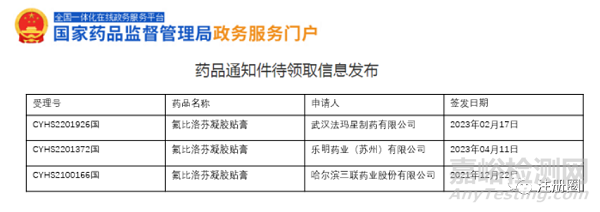
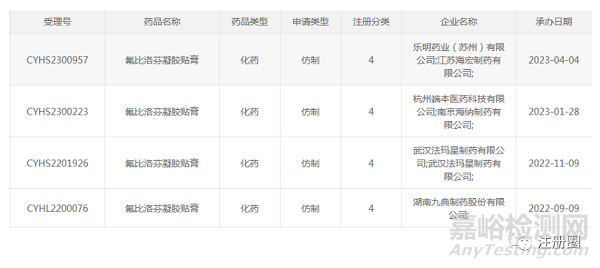
氟比洛芬凝胶贴膏 |
下列疾病及症状的镇痛、消炎: 骨关节炎、肩周炎、肌腱炎、腱鞘炎、腱鞘周围炎、肱骨外上髁炎(网球肘),肌肉痛、外伤所致肿胀、疼痛 |
MIKASA SEIYAKU CO.,LTD |
2016年 |
进口 |
|
氟比洛芬凝胶贴膏 |
下列疾病及症状的镇痛、消炎: 骨关节炎、肩周炎、肌腱炎、腱鞘炎、腱鞘周围炎、肱骨外上髁炎(网球肘),肌肉痛、外伤所致肿胀、疼痛 |
北京泰德 |
2010年9月 |
国产 |
|
利多卡因凝胶贴膏 |
用于缓解带状疱疹后遗神经痛,用于无破损皮肤 |
2018年6月 |
国产 |
|
|
吲哚美辛凝胶贴膏 |
用于缓解局部软组织疼痛,如(1)运动创伤(如扭伤、拉伤、肌腱损伤等)引起的局部软组织疼痛。(2)慢性软组织劳损(如颈部、肩背、腰腿等)所致的局部酸痛。(3)骨关节疾病(如颈椎病、类风湿性关节炎、风湿性关节炎、肩周炎等)的局部对症止痛治疗。 |
青州尧王制药 |
2018年 |
国产 |
|
吲哚美辛巴布膏 |
同上 |
湖北兵兵药业 |
2011年8月 |
国产 |
|
洛索洛芬钠凝胶贴膏 |
用于骨关节炎,肌肉痛,外伤导致肿胀的消炎镇痛 |
湖南九典 |
2017年 |
国产 |
|
酮洛芬凝胶贴膏 |
以下疾病和症状的镇痛/抗炎:腰痛(肌肉或筋膜性腰痛、变 形性脊椎病、椎间盘疾病、腰椎挫伤)、变形性关节炎、肩周炎、肌腱炎、腱鞘 炎、肌腱周围炎、肱骨外上髁炎(网球肘等)、肌肉痛、创伤后肿胀和疼痛。(2) 类风湿性关节炎的局部镇痛 |
2023年 |
国产 |
|
|
复方水杨酸甲酯巴布膏 |
对于跌打、扭伤、腰痛、肩痛、神经痛、肌肉痛、风湿痛、撕裂伤痛、类风湿痛等疾病具有治疗作用 |
JEIL HEALTH SCIENCE INC. |
2020年9月 |
进口 |

来源:注册圈


