您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-10 17:18
BSI发布欧盟MDR临床评价白皮书,本白皮书由Amie Smirthwaite撰写,Amie是RQM+的临床服务全球副总裁。在加入RQM+之前,Amie在BSI作为临床法规负责人工作多年,也是欧盟委员会临床试验和临床评价专家组的成员,对MDCG指南的发布有很多贡献。Amie还是现任的ISO/TC194和ISO/TC 150的成员。本文针对白皮书进行翻译和整理,希望能帮助中国企业和行业更好的理解欧盟临床评价的要求。
注:本文不代表BSI立场,少数内容没有进行完整的翻译,如有疑问,请参见英文白皮书(下载链接参见文末)。
1Introduction and background
介绍和背景
欧盟对医疗器械监管法规在过去10-15年发生了很大的变化,特别是临床评价的要求,这源自于一系列的医疗器械的失效和事件。这使得很多监管当局和临床专家认为,医疗器械的临床证据没有得到充分的审查。
其中最早的变化来自2007年对MDD(AIMD)第五版的修订,这次修订对临床评价和上市后资料的收集影响巨大。其中包括:
新的“临床数据Clinical Data”定义引入,以及明确了可接受的临床证据Clinical Evidence的来源。
将证实满足基本要求Essential Requirements所包括的临床评价要求,从设计和构造部分移到通用部分,这意味无论医疗器械的设计和预期用途是什么,所有的医疗器械都需要进行临床评价。
对附录7/X临床评价进行了重大修订,包括:
所有的III类和植入的器械都需要进行临床试验,如果不进行临床试验需要有充分的理由。
临床评价必须包括在技术文件中
临床评价必须和上市后监督所获取的资料相关联,并动态更新。
上市后临床跟踪PMCF如果不适用的时候,需要有文件化的充分的理由。
在第五版指令(Directive 2007/47/EC)发布之后,欧盟发布了一系列的指南和法规,旨在改善医疗器械临床评价的质量和审查的要求,见下表(未详尽)。
年
文件
对临床评价审核的影响
2009
MedDev 2.7/1 rev 3
对临床评价过程、数据的评价和分析,以及结论的有效性提供了更详细的内容和要求(指南从19页增加到46页)
2010
NBOG CL 2010-1
公布更详细的检查表,用于主管当局去审核公告机构的能力,以及如何去进行临床评价审核。
2013
Implementing Regulation
920/2013
开始增加公告机构在进行临床评价符合性审核时需要有临床经验的要求
2014
NBOG BPG 2014-2
2016
MedDev 2.7/1 rev 4
对指南进一步扩充,强化了临床数据的质量和完整性的要求,以及结论的科学有效性(指南从46页增加到65页)
2017
Regulation (EU) 2017/745
新的欧盟法规(MDR)整合了临床评价指南MedDev 2.7/1第四版的几乎所有要求。
NBOG BPG 2017-2
进一步增加和明确了公告机构进行临床评价审核时所需相应临床经验的要求。
2020
MDCG 2020-5
MDCG 2020-6
指南更加强化了临床评价指南MedDev 2.7/1 第四版,以及欧盟MDR法规Article 61和附录14 A部分关键的临床评价的要求。
MDCG 2020-13
公布公告机构临床评价审核报告的模板,以及明确最基本的内容要求。
这些累积的变化形成和强化了目前的实践,特别是影响过程有效性和得出结论的参数(Parameters):
临床评价的策划和范围
数据的收集方法
数据的评价和分析
数据对比(Data Mapping)、受益风险评估和基于“充分临床证据”的结论。
过往有很多关于系统评价方法的文章和和解读。但本白皮书重点关注临床评价的目的,以及一些容易被制造商忽视,但对临床评价策划和范围有非常重要的要求。
2Purpose of a clinical evaluation
临床评价的目的
根据MDR Article 61(1)制造商需策划、实施并记录临床评价,并保证:
制造商需要基于临床数据和充分的临床证据,去证实器械按照预期使用,符合GSPR的要求…,并评价非预期的副作用,以及受益-风险比例可接受性…
Confirmation of conformity with relevant general safety and performance requirements … under the normal conditions of the intended use of the device, and the evaluation of the undesirable side-effects and of the acceptability of the benefit-risk ratio … shall be based on clinical data providing sufficient clinical evidence
这个很好的体现了在Article 2(48)对临床数据clinical data的定义,也隐含了临床评价的目的:验证按照制造商预期使用的时候,医疗器械的安全和性能,包括临床受益。
然而,这不包括完整的内容,结合MDR Article 61和附录XIV,以及来自MDCG 2020-5 和2020-6的澄清,临床评价还必须:
清楚的确认器械的预期用途和相关的临床受益,以及使用条件和特殊的禁忌症,并且这些需要临床证据的支持。
建立基于相同患者人群和治疗适应症的其它治疗方法的现有技术水平(SOTA)可达到的结果,并以此确定目标器械的安全、性能和受益-风险的基准(Benchmark)。
说明使用数据来源,适当时,包括使用等同和非临床数据的理由。
不仅得出安全、性能、受益-风险的结论,还包括完整的证据和理由去支持:
所有的适应症(包括哪些广泛预期用途描述所隐含的)
所有潜在的患者人群,包括高风险和弱势群体
所有器械的变种及结合
适当时,和附件或其它器械的结合使用
器械的使用寿命
通过制造商风险管理过程所确定的风险
剩余风险的可接受性
简而言之,临床评价的目的是,通过客观及科学有效证据去证实,医疗器械按照预期使用,能达到其预期的临床受益(直接或者间接的),并且相对于现有的治疗和诊断方案的受益-风险结论是可接受的。
3Overview of the clinical evaluation process
临床评价过程概述
欧盟MDR法规附录14规定了临床评价流程的要求。这些过程很大程度和AIMDD、MDD,以及扩充的第四版MEDDEV 2.7.1指南保持一致:策划、数据收集、数据评价、数据生成(如果需要)、数据分析和结论,并在售后阶段持续的收集数据,保持和更新临床评价报告。
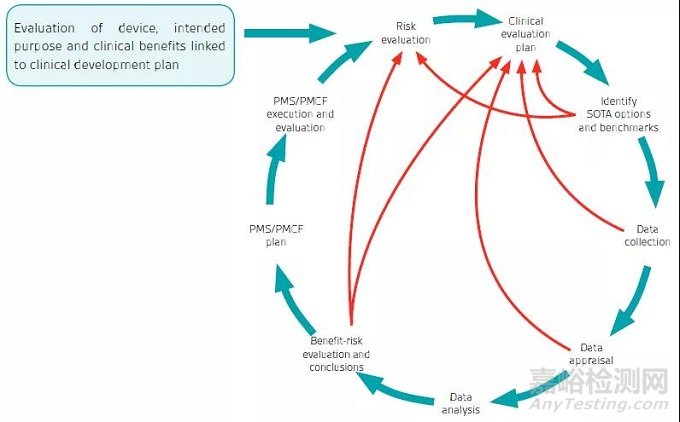
虽然评价流程常是一个清楚、有序、一步接一步的过程,但实际上,在临床评价的循环之中包括很多相互关联而产生的反馈环。这些关联反馈环包括:
现有公认技术水平(SOTA)评价的输出,可能显示在进一步收集售后数据之前,就要对风险评估或者临床评价计划进行更新。
可能在数据收集阶段,没有识别到相关的数据,也需要对临床评价或临床评价计划进行重新评估。
通过数据评价,可能明显的提示没有充分的文献去进行数据分析,这也可能需要更新临床评价计划。
临床评价的结论可能提示需要更新临床评价计划,比如需要更多的上市前的临床试验,或者改变使用适应症,或者调整风险分析和相关风险管理文件。
临床评价流程和潜在关联反馈环 - 图1:
4Clinical evaluation planning
临床评价的策划
策划是临床评价的关键。去证实一个器械能达到它预期的性能、临床受益和安全标准,第一步需要去确定这些参数Parameters。制造商需要解释这些参数如何测量和如何满足(如:相关的终点Endpoints是什么)。因此,必须从一个清晰并充分详细的器械预期用途的描述,以及预期用途相关的标准治疗规范standard of care开始(否则引用“现有技术水平SOTA”)。
4.1 Intended purpose, indications, contraindications 预期用途、适应症、禁忌症
器械预期用途和适应症的定义是第一个关键步骤,它影响后续评价的各个方面:它确定了临床评价的目标、相关文件检索的范围、风险评估的范围、挑选现有公认技术水平器械和替代治疗方案的准则、以及最终临床证据充分性的评价。
欧盟AIMDD和MDD指令都有预期用途的定义,但没有提及适应症,而只有一次引用到禁忌症。这导致很多制造商将预期用途简单理解成“器械所进行的活动”或者“器械如何使用的”,没有考虑到其它参数,如预期患者人群、治疗适应症、疾病严重程度和阶段等。例如:腰椎融合器的预期目的理论上可以定义为"在与自体和/或同种异体骨移植材料一起使用时,提供稳定并允许或实现两个相邻腰椎体之间的融合"。然而,如果没有对腰椎融合器适应证的定义,就很难证明一个令人满意的受益风险结论。比如,当权衡因 IV 级脊柱滑脱而导致顽固性疼痛和残疾的患者的益处时,与脊柱手术相关的风险可能是可以接受的,而轻度至中度退行性椎间盘疾病患者,可能对侵入性较小的治疗选择会更好。预期目的陈述必须明确无误,并且仅包括那些已经证明有正面的受益风险结论的适应症。
虽然MDR Article 2(12)使用了和指令一样的“预期用途”的定义,但附录I第23.4条指出预期用途包括适应症,见如下:
使用说明书必须包括以下所有内容:
(b)器械的预期用途,以及清晰的适应症、禁忌症、目标患者人群、以及适当的预期使用者规范。
根据MDCG 2020-6里对“适应症“的定义,并不是所有的医疗器械都有适应症:
适应症或使用适应症:可以由医疗器械对临床状况进行诊断、预防、监测、治疗、缓解、补偿、替换、修改及控制。它和预期用途有不同,是指器械的效果。所有的医疗器械都有预期用途,但并不是所有的医疗器械都有适应症(如:消毒灭菌的器械)
‘indication’, ‘indication for use’: refers to the clinical condition that is to be diagnosed, prevented, monitored, treated, alleviated, compensated for, replaced, modified or controlled by the medical device. It should be distinguished from ‘intended purpose/intended use’, which describes the effect of a device. All devices have an intended purpose/intended use, but not all devices have an indication (e.g. medical devices with an intended purpose of disinfection or sterilisation of devices).
然而,当一个器械有适应症时,确认符合附录1 GSPR的要求,必须包括和适应症相关的临床数据,附录14第1a部分明确临床评价计划必须包括“一个清晰的适应症和禁忌症,以及预期目标人群的规范“。
基于现有医学技术水平,使用一个指示清单和参数规格去判定器械的不同适应症和预期用途的受益-风险比例的可接受性
an indicative list and specification of parameters to be used to determine, based on the state of the art in medicine, the acceptability of the benefit-risk ratio for the various indications and for the intended purpose or purposes of the device
因此,针对多数医疗器械,一个泛泛的预期用途申明并不能满足MDR的要求。
制造商可能并不清楚预期用途、适应症和禁忌症需要详尽的程度。如:对于缝合线来说是否需要明确其所有的可使用的解剖部位?经导管主动脉瓣置换需要明确的主动脉瓣狭窄等级及严重程度?CT扫描是否需要明确可用于支持诊断的每种疾病的状况?
一个非常有用的原则,不是只考虑器械的预期用途、设计原理和作用机理,还有标准治疗方案,以及和风险相关的适应症和应用。未知和潜在风险越多,预期用途的描述就需要更详细。
4.2 Intended/expected clinical benefit 预期临床受益
4.2.1 Regulatory Context 法规背景
一个和预期用途及适应症相关的重要考虑是临床受益。MDR Article 2(53)给出了临床受益的定义
器械对个人健康的正面影响,可表述的有意义的,可测量的,病人相关的临床结果,包括诊断结果,或对病人管理或公共健康的正面影响。
the positive impact of a device on the health of an individual, expressed in terms of a meaningful, measurable, patient-relevant clinical outcome(s), including outcome(s) related to diagnosis, or a positive impact on patient management or public health.
MDR Article 2 (44)临床评价的定义不仅包括对安全和性能,还包括临床受益的确认。换而言之,制造商只证实器械能安全的达到预期用途是不充分的,还需要证实使用器械是有意义的,有可量化的临床受益。这点在附录14里面进行了强化,要求临床评价计划包括:
“一个具体的,包括相关和具体的临床结果参数,针对患者的预期临床受益的详细描述,以及分析所有相关临床数据,从而得出安全、临床性能和临床受益结论的临床评价。a detailed description of intended clinical benefits to patients with relevant and specified clinical outcome parameters’, and the clinical evaluation to ‘analyse all relevant clinical data in order to reach conclusions about the safety and clinical performance of the device including its clinical benefits“。
4.2.2 Direct vs indirect clinical benefits 直接和间接临床受益
临床受益包括直接的临床受益和间接的临床受益。有些时候,一个器械的临床受益是间接的,也就是器械本身不会直接对病人产生正面的影响,但它能帮助一个手术的完成,一个治疗的实现,或配合另外一个器械去实现它的预期用途。白皮书给出了如下的例子:
用于化疗药物输液的静脉输液管路,它并不能直接治疗癌症。
关节置换术中使用的切割导向器,能帮助准确的骨头切割,这能改善植入物的临床效果,但它并不能直接减少疼痛或增加运动的范围和能力。
输送导管可以将支架输送到具体部位,但不能直接治疗冠心病及症状。
针对这些器械确定临床受益是一个非常难的工作,白皮书给出了一些思路和示例,请参见英文白皮书。
4.2.3 Board or generic clinical benefits 广泛和通用的临床受益
有些器械使用非常广泛,去确定和所有预期用途有关的临床受益不是非常现实和有帮助。比如:手术刀可以用于肿瘤切除,这会有很多直接的临床受益,但是欧盟从来没有要求制造商去列出需要使用手术刀的所有手术。同样的,CT扫描仪可用于各种不同的成像应用,缝合线可用在各种软组织中的缝合。一般来说,对于这些类型的器械,受益是它们执行其预期的功能(隐含着它们这样做有临床受益)。至于一些具有间接临床受益的器械,将"相关临床结果"解释为证明该设备安全,并按预期运行所需的证据是可接受的,但需要结合设计验证、符合标准和上市后监测数据。但是,对于器械有特定风险,应谨慎行事。比如,存在高风险较的特定预期用途,或者需要特定设计特性,而这些特征不是器械的通用功能,则这些用途可能需要明确禁忌症,或者有相关的临床证据(具有相关的临床结果),以证明该器械适用于这些特定适应症。
4.3 Clinical claims 临床宣称
“宣称Claim“并没有在MDR里面直接定义,但从上下文里面隐含了这个术语如何使用。在大多数情况下,“宣称“和预期用途、安全、性能和临床受益(如临床宣称)所关联。如:
Article 2(52)“临床性能”的定义:器械有能力去实现按照制造商所宣称的预期用途。
Article 7 包含制造商不能使用和器械预期用途、安全和性能相关的,误导使用者和患者的宣称。
附录15 第2.1条要求临床试验必须按照确认或者否认制造商针对器械安全、性能和受益-风险所做宣称而进行。
临床宣称不仅是器械预期去做的,还包括制造商所提供的信息,比如它能达到多好和多安全。该术语并不是去限制推广宣称或者优越性的宣称,按照Article 2(12)预期用途的定义,可以包括这些。
预期用途:是指根据制造商提供在标签、说明书、或者在推广销售材料、或者申明、以及和制造商在临床评价中所描述的预期的器械使用
‘intended purpose’ means the use for which a device is intended according to the data supplied by the manufacturer on the label, in the instructions for use or in promotional or sales materials or statements and as specified by the manufacturer in the clinical evaluation.
最重要的是确保临床评价要包括对临床宣称的确认。要避免没有充分临床证据的隐含的临床宣称,这可能受到挑战。比如:预期用途没有排除儿科患者,那么临床证据需要包括该器械也适用于儿科患者。某些设计特性可能隐含特殊的性能和临床受益,即使制造商并没有明确申明这些,比如:
一个带有抗菌涂层的血管通路,隐含该器械有相对没有此涂层的血管通路更好的减低感染的风险,即使制造商没有明确的宣称它。
膝关节置换包括了一个旋转平台的设计,这隐含了相对于固定平台有更好的运动性,需要有和改进功能相关的临床受益。
小尺寸导管隐含可进入更小直径的血管,或者减低对血管的损害,这将有对预期用途和临床受益直接的影响。
最佳的方法是确保预期用途是完整和准确,不包含这些隐含的宣称。另外非常重要的是解释这些特殊设计的意图,特别是一个产品类别包括不同变种类型。需要提供一个对这些器械的清晰关联和异同的说明,包括预期用途、安全要求、临床受益、证实达到预期的临床证据的来源。
4.4 Duration of use 使用寿命
一个非常容易犯的错误是如何考虑使用寿命。虽然我们常假定临床跟踪必须覆盖医疗器械的使用寿命,但有很多例外,包括超过器械寿命的跟踪是必须的例子。见表2.
器械名
使用寿命
影响跟踪时长的考虑
椎体融合器
病人寿命
典型的骨骼重建需要在手术后18-24个月内完成,但很多临床受益在3-6月就可以体现。18-24个月的数据(包括期间恰当的随访间隔)应该对于初次的CE认证是充分的,因为在个时间点,大家的认识是临床的结果能反应长效的受益和风险。然而,有些不良事件会在融合之后的数年之后才出现,这也会影响受益-风险的结论。因此,在售后监督过程中,对结果进行更长期的跟踪会更合适。
房颤射频消融
短暂的
虽然器械的寿命就是手术的时长,但手术的成功并不能完整体现这种治疗器械的安全和临床受益。可能目前对这种器械的跟踪期限没有共识。因此,跟踪的时限必须根据该治疗期望持续的有效时间,以及相对于SOTA治疗方案比较去证实一个正面的受益风险结论而确定。
糖尿病溃疡新型敷料
7天
虽然单个敷料的使用期限是7天,但会使用新鲜的敷料进行替换,故此累计的使用时间可能是几周。和上面房颤射频的例子类似,随访的期限必须根据伤口治愈的累计时间,以及相对于现有公认的治疗方案所期望证实得出一个正面的受益和风险结论而定。
髋关节
患者寿命
髋关节理想的寿命是病人的寿命,10年是大家通用的去证实长效安全的跟踪周期。这是基于有些机构的指南(如NICE: National Institute for Health and Care Excellence),以及关节登记系统(如Swedish Hip Arthroplasty Registry and UK National Joint Registry)的报告结果。对于新的置换关节,一个更短的周期是可能被接受的(当然,需要有理由证实,这种长效的结论是怎么基于短期的跟踪而得出的)。
5Establishing the SOTA and benchmarks for safety and performance
对安全和性能建立SOTA和基准
5.1 Purpose of the SOTA evaluation 现有技术水平评价的目的
在临床评价的策划和临床评价报告的完成时都需要考虑现有技术水平(SOTA)。欧盟MDR附录14第1a条款要求其作为临床评价策划的一部分。
基于现有医学技术水平,使用一个指示清单和参数规格去判定器械不同适应症和预期用途的受益-风险比例的可接受性
an indicative list and specification of parameters to be used to determine, based on the state of the art in medicine, the acceptability of the benefit-risk ratio for the various indications and for the intended purpose or purposes of the device.
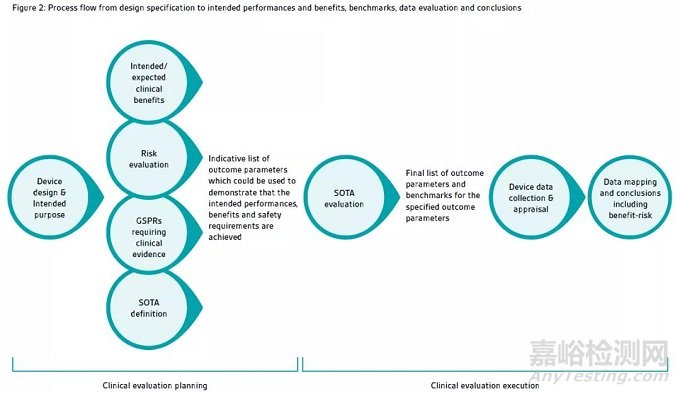
“Indicative”如何翻译和理解?在SOTA评估完成之前,参数很难完整确定,因此,在最开始的临床评价策划的阶段,不同的用于证实器械安全、性能或者临床受益的结果参数可能已经确认。对SOTA进行评估,以确保这个指示清单更加精炼,并且建立基准。这是SOTA分析主要目的:针对已知患者人群,确认可接受的标准。并能将该器械和安全、性能、受益风险决定的证据和这些结果参数和基准进行比较,去证实他们是否达到满意的结果。见图2.
针对医疗器械临床评价中SOTA的定义,不能和字典里面的定义相混淆。牛津英文词典里面,SOTA定义成使用最现代和最先进的技术和方法,在现阶段是最好的。然而 IMDRF/GRRP WG/N47 和 MDCG 2020-6有如下的定义(和ISO 14971:2019风险管理的标准里面的定义稍有差异):
根据相关科学、技术和经验的综合考虑,在特定时间内对产品、工艺和患者管理所应达到的技术能力水平和可接受的临床实践。
备注:现有技术水平体现了当前和普遍接受的技术和医学的良好实践。现有技术并不一定意味着是最先进的技术和解决方案。这里描述的现有技术水平有时被称为“普遍公认的技术水平”。
Developed stage of current technical capability and/or accepted clinical practice in regard to products, processes and patient management, based on the relevant consolidated findings of science, technology and experience.
Note: The state-of-the-art embodies what is currently and generally accepted as good practice in technology and medicine. The state-of-the-art does not necessarily imply the most technologically advanced solution. The state-of-the-art described here is sometimes referred to as the ‘generally acknowledged state-of-the-art’.
SOTA,当适用于医疗器械临床评价的时候,也可以和“标准治疗方法 Standard of care”意思相同。
5.2 Devices with direct clinical benefits 有直接临床受益的器械
对于有治疗适应症和直接临床受益的器械,临床评价的目的是证实该器械的受益风险结果和SOTA治疗方案一致或者更优。因此,SOTA必须和器械的特定的患者人群以及治疗适应症相关。如:植入神经调节器只用于严重的持续性神经疼痛,并且是对保守治疗方案无效的,故此相对于非甾体类抗炎药治疗或者物理治疗有效果的就没有意义了。另一方面,经皮电刺激器(TENS)适用于治疗未严重分级的腰痛、筋膜和关节疼痛、交感神经疼痛、膀胱失禁、神经痛、内脏疼痛、手术后疼痛,故此,更广泛的替代治疗方案必须包括在SOTA的评估中。
有些时候,有可能引用临床或者其它最佳实践指南去确定临床性能的基准。如:NICE技术评价指南推荐完整髋关节相对于初次置换生存10年的翻新率是5%。如果能够证实该指南也适用于欧洲临床和法规,它可以引用作为结果参数的基准。
5.3 Devices with indirect, broad or generic clinical benefits 间接和广泛临床受益的器械
按照MDR 附录14第1(a)条款,如果SOTA的目的是建立相关和明确的临床结果参数的基准,那么相对于间接的、有广泛和通用的临床受益的器械如何考虑?对于这种器械,临床结果参数有时可以理解成按照临床安全和性能推理得出的非临床的参数。这种理解在MDCG 2020-6里面得到体现。
虽然临床数据应支持直接临床受益,但间接临床受益可通过其他证据证明,例如
临床前和台架测试数据(例如,符合产品标准或通用规范)
真实世界数据,如登记系统、保险数据库记录所生产的信息
和该器械一起使用的其它器械所得的直接临床数据(如:支架的数据支持导丝的安全和性能)
…while direct clinical benefits should be supported by clinical data, indirect clinical benefits may be demonstrable by other evidence such as:
pre-clinical and bench test data (e.g. compliance to product standards or common specifications)
real world data such as registries, information deriving from insurance database records, etc.
data from another device that is used with the subject device which does have direct clinical data (e.g. data from a stent used to justify safety and performance of a guidewire)
根据这些例子,基于SOTA的基准可以通过不同的方法建立,包括:
技术标准、有性能测试要求的药典和最佳实践指南
风险管理和设计过程确认的输出
评估同类器械的经验,包括文献和不良事件数据库
投诉趋势和指征的分析
总之,基准的建立必须基于并考虑器械的预期用途、创新、风险。
6. The rest of the clinical evaluation process 临床评价的其它流程
如果已经建立了一个完善的临床评价计划,明确了相关结果参数,并根据SOTA建立了恰当的基准,临床评价的流程相对直接和容易。
在本文开头介绍,对于系统评价、文件检索方法、数据的评价和分析已经大量的文章和解读,本文不再做过多的重复。
重点是创建一个符合法规的临床评价报告,了解如下的内容会非常有帮助。
6.1 Data collection 数据的收集
各种各样的数据来源可以用于支持证实产品的安全、性能和临床受益,MDCG 2020-6附录3罗列了临床证据的12个等级。
针对几乎所有的器械,一定程度的文件检索是需要的;对风险非常低,有标准治疗方案的器械,文献检索的目的是确认有没有影响SOTA的风险评价、性能和临床受益的新的信息。
然而,需要指出的是,在MEDDEV 2.7.1第四版里面描述的可接受文献检索来源仍适用于MDR,包括
通过WHO国际临床试验登记平台(ICTRP)和 ClinicalTrials.gov公布的试验
植入器械登记系统的报告
以及相对于SOTA的评价
Meta分析和健康技术评估(HTA)协会和网络的评估
专业医学学会发布的专家文件
包括临床性能和临床安全的协调性标准和其它标准
在欧盟MDR下,未来的信息来源可能包括:
欧盟数据库EUDAMED临床试验模块公布的临床试验
包含临床性能和临床安全的通用规范
CECP专家组公布的观点和意见
6.2 Data appraisal and analysis 数据评价和分析
MDR附录14第1c条要求制造商对所有相关的临床数据进行评估,以判定他们对建立器械安全和有效性的适宜性。
换而言之,制造商需要评价每个数据的质量,并且和该器械预期用途、临床受益和相关风险的相关和可以接受性。
数据评价的准则可以包括:
试验设计的总体质量(适用时)
数据呈现的质量和完整性
潜在的偏差(bias)
按照临床评价计划里面确定的证据要求的数据的适用性
数据对该器械的适用性和如何使用
评价并不仅仅是确定相关的数据是否包括还是不包括在临床评价之内,还包括相关证据的等级,该证据的等级权重对支持已给结论非常重要。在有些时候,可能有完全相反的结果和数据,森林图(Forest plots)工具可以用于解决这种明显的差异。虽然这些试验设计是由专家和统计学专家参与的,最重要的是这些活动背后的假设和方法是能确保得出的结论是有效的。
6.3 Data mapping and conclusions, including benefit-risk evaluation 数据匹配和结论,包括受益-风险评估
一旦数据评价已经完成,需要将它和通过SOTA评估和临床评价计划里面所确定的结果参数和基准进行对比。一个非常重要的方面是确保数据具有适当的等级,以确保它所得出的结论和器械预期用途和临床评价计划里面所需要的等级相一致。数据的等级需要充分并支持得出安全、性能、受益风险的结论,并且能覆盖所有的器械的变种、结合、治疗适应症、患者人群,支持制造商的所有宣称。
在有些情况下,一个器械可能不能满足所有基于SOTA评价所得出的基准,在这种情况下,差异可以通过如下的方式来考虑:
根据已经满足的临床安全、性能和受益参数,来缩减适应症的范围。
提供接受其它来源数据的理由去支持结论(参见MDCG 2020-6 附录3)
提供量化的受益风险(如证实一个风险已经显著的改善,而相对于一个受益只很少的降低;或者相对一个没有满足的需求,而对应病人没有其它治疗方案的选择)
通常情况下,任何受益风险的结论的理由和推理,必须有适当的上市后临床跟踪PMCF支持,并且收集的数据能够支持该结论。
6.4 Frequent notified body findings 公告机构常见的发现
公告机构对临床评审核常见的问题包括:
临床评价的目标太泛泛,没有明确和可测量的目标
明确和可测量目标的基准没有根据现有技术水平而建立
预期用途的描述不完整,临床适应症不清楚
临床证据不支持完整的预期用途
临床数据不能分别满足预期患者人群、治疗适应症、器械的型号和结合,以及明确和可测量的目标
临床证据的差距没有充分的说明
受益风险结论不能澄清和SOTA的关联
器械的剩余风险没有恰当的识别
PMCF的计划没有考虑器械的剩余风险
没有按照附录14第6.2b条的要求,确定特定方法和程序的PMCF,是不可接受的
在临床评价的开始阶段,建立恰当的范围和目标,能够避免公告机构提出这些潜在的问题发现。清晰的针对具体和可以测量目标(SMOs)和基准(Benchmarks)进行比对,也是非常有帮助的。有时候制造商会担心,进行这样的比对,会将问题和数据差距明显的暴露出来,从而导致不必要的发现,但实际上,完全相反,公告机构的评审专家需要清楚的记录并提供接受制造商结论的理由,透明和准确,带有恰当理由的受益-风险结论,会降低发现的数量和减少认证的耽搁。
7. Acronyms
8. References and related guidance
请参见英文白皮书。

来源:bsiHealthcare


