您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-17 17:26
A.多远才算远?
强制降解(也称为破坏实验)是一种实验形式,用于确定给定系统或实体的稳定性。 它涉及超出正常运行能力的测试,通常是一个断点,以便观察结果。
强制降解研究有助于开发稳定性指示分析方法,以更好地了解活性药物成分(API)和药物产品(DP)的稳定性,并提供有关降解途径和降解产物的信息。为了满足开发和监管需求,本章提供了何时以及如何进行研究的路线图,设计坚固科学研究的有用工具,以及如何记录和交流结果的指导。
强制降解研究的主要目的是有效的制造在原料药和成品生产,处理和正常储存条件形成的降解物质(由国际协调会议(ICH)规定)。过度破坏会摧毁降解物或产生不切实际的降解物,而且可能无法产生重要的降解产物。以下章节中会对破坏程度的限制进行讨论。
在开始正式稳定性研究之前,应采用强制降解样品开发具有稳定性指示功能的方法。 分析样品的API峰纯度(共洗脱杂质),专属性和质量平衡。还应该尽量确定在API和DP的降解途径和机制。
B. 监管要求
根据ICH新药物杂质指南,降解产物定义为药物分子随时间和/或通过例如光,温度,pH或水的作用或通过与辅料和/或直接接触的容器/封闭系统反应而发生的化学变化。(也称为分解产物)。
从监管角度来看,强制降解研究提供的数据支持以下方面:
鉴定可能的降解产物
降解途径和药物分子的内在稳定性。
验证稳定性指示分析方法
与强制降解研究有关的监管指导中涉及的具体问题包括:
强制降解研究通常使用同一批物料进行。
强制降解研究条件应比加速稳定性测试更剧烈,包括:温度的影响(以10℃增量,例如50℃,60℃等,高于加速试验的温度),湿度(例如75%RH或更高),在适当情况下,对药物进行氧化和光解。测试还应评估药物在溶液或悬浮液中对各种pH值的水解敏感性。光稳定性应该是破坏实验的一个部分。
在加速或长期稳定性中不会形成的降解产物可能不需要分离或确定其结构。
需要考虑质量守恒。
监管指南未具体涉及的问题:
没有具体说明强制降解研究的确切实验条件(温度、持续时间、降解程度等)。
实验设计由申请人自行决定。
可以从美国食品药品监督管理局(FDA)和私营企业获得有关研究性新药(IND)和新药申请(NDA)申请的监管要求的指导。 本节根据现行法规和指南,对监管要求(如美国,欧洲和日本)提供全球视角。
1. IND阶段的要求
在第1或第2阶段的IND申请中,不要求报告强制降解的研究条件或结果。但是,鼓励开展初步研究,以助于稳定性指示方法的开发。建议在API和DP开发的早期进行强制降解试验。可以对API和研究阶段的配方进行热解、水解、氧化和光解的降解试验,评估活性物质的潜在化学行为。指导文件建议将一次性强制降解研究实验的结果列入第3阶段IND中。
2. 上市申请的要求
在NDA阶段需要完成原料药和成品降解的完整研究,包括对显著降解产物的分离和/或表征,以及所进行的降解研究的完整书面说明。
注册时的要求包括:
应准确表征强制降解产物,建立反应动力学。
应尝试对降解产物进行结构解析,即使不成功,也应在NDA中引用。
应确定或至少尝试质量平衡。
应确认主峰纯度。
任何ICH稳定性样品中高于鉴定阈值以上的降解物应予以分离和鉴定。
这些研究的信息应在备案中引用,并应提供:
单独的API和DP的降解途径。
讨论任何可能的多晶型或对映体物质。
与药物有关的降解和辅料干扰之间的区分。
实验部分概述了监管提交建议的测试和条件。
C. 强制降解研究的时机和策略
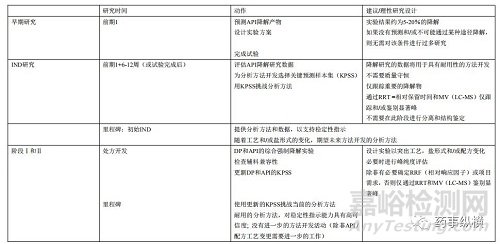
强制降解测试的要求取决于项目需求和化合物的开发阶段。 例如,临床前到第二阶段的项目需要频繁的方法开发,并且样品消耗量非常高。因此,在研究设计时,强制降解应着重于分析方法的可行性,而不是分离和识别降解产物。 随着从阶段2后期到注册阶段,方法开发活动将以优化为中心。降解研究实验的重点应放在降解物的表征和阐明上,以确保完全了解降解途径。表1概述了进行强制降解实验的时间和策略。
表1 强制降解的时间和策略

1. 降解讨论
降解背景讨论是该过程中关键的第一步。在这些初步讨论中,可以共享降解预测,背景知识和获得的历史降解知识。讨论的目的是在基于团队的环境中审查API和DP的潜在或已知稳定性问题以及可能的降解机制,以用作帮助分析师执行强制降解研究的资源工具。举行降解讨论,以促进实现里程碑式的可交付成果,例如稳定性指示方法。参与者可以包括分析化学家,工艺化学家,配方设计师和发现代表。如果API工艺或盐发生变化,DP配方变更以及生产线扩展,则应再次进行讨论。
2. 质量来源于设计的原则
为了建立共识并发展一致性,行业和监管机构经常将质量源于设计(QbD)描述为三个基本的,相互关联的概念:控制策略,设计空间和知识空间。图1描述了一种QbD方法,用于开发设计空间,建立控制策略,并利用图形描绘强制降解研究的知识空间,以说明这些概念元素如何适合强制降解研究的流程。化学指导的实验设计方法有助于针对最可能的反应性官能团和实验条件,专注于使科学家能够缩小相关知识空间(简化工作)。
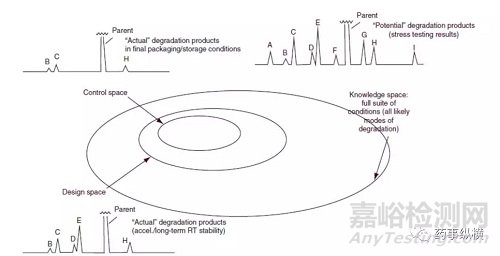
图1质量源于设计模型
当分析师进行预测化学分析时,对强制降解的QbD策略的初步评估通常在开发早期开始。如果做得好,这项练习可以概括分子的潜在降解反应,提供对可能的降解化学的知识空间的洞察,并帮助设计强制降解研究。通过在ICH描述的所有降解条件下进行实际降解研究,进一步阐明知识空间,以产生所有潜在的降解产物。该模型可以应用于API和DP。为了建立设计空间,根据ICH Q9执行前瞻性风险评估。设计空间是可接受的操作空间,在这些边界之外可能存在操作空间的失败。如上面描绘设计空间的色谱图所示,图1中的这个圆圈是指在加速测试条件或长期室温稳定性下产生的实际降解产物。最后,在产品的保质期内,实际包装下,实际室温下,观察到的实际降解产物变少。
3. 降解试验流程图
图2描绘了完整的强制降解过程流程。本章强制降解部分的其余部分将概述该过程每个步骤的关键要素。
备注:KPSS=关键预测样品集用于开发具有合适分离度和检测限的方法
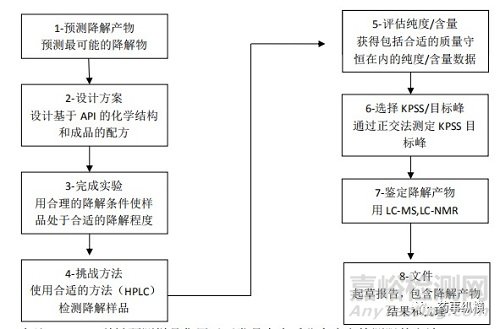
图2 降解研究流程图
D. 降解预测工具
1. CAMEO
CAMEO是一种计算机程序,可根据原料,试剂和条件预测有机反应产物(参见图2,步骤1:预测降解物)。分析涵盖以下关键降解条件:碱性/亲核,酸性/亲电子,自由基,氧化/还原,光化学以及这些反应的机理解释。一般而言,CAMEO算法的设计旨在使产品混合物能够预测比实际观察到的更多的降解产物。这对于限制性太强的规则是优选的,并且拒绝在实际降解或ICH稳定性研究中观察到的关键产物。预测的某些产品也可能会进一步分解。
由于该预测程序存在这些限制,因此根据功能组跟踪历史退化数据以及CAMEO预测数据,为降解研究预测练习提供了更彻底的方法。就CAMEO限制而言,预测通常停留在初级降解产物上,并且可能忽略二级或三级降解物,这可能是实验中实际看到的降解物。 CAMEO在预测某些类型的化学方面特别成功 - 例如,酰胺水解,苄基位点氧化,亚砜和砜形成,亚胺形成和随后的裂解;然而,CAMEO在其他方面极为有限,例如光化学。
CAMEO知道氮是亲核的,并寻找能与之发生反应的东西。在这个例子中,我们已经告诉了CAMEO过氧化氢在该反应当中,CAMEO可以被告知反应中的有什么物质,并且可以处理新的试剂和底物

图3 CAMEO举例
2. DELPHIX系统
DELPHI是由辉瑞公司同事开发的辉瑞专有系统。 DELPHI也是一个具有前瞻性的专有系统。 DELPHI感知并评估子结构,反应位点和官能团的输入分子结构,然后基于已知的一般化学原理和专门的实例规则在给定条件下预测反应产物。与CAMEO相比,DELPHI专门用于预测分子的反应性和降解。而且,与CAMEO相反,DELPHI超越了主要的反应性降解物,进而成为随后的降解物降解物。
3. Zeneth软件
改进的降解预测软件导致简化的降解方案和目标实验是迫切需要的。这将使更有效的方法开发成为可能,并为最小化原型稳定性提供科学依据。LHASA Ltd.为METEOR药物代谢预测系统开发了用于构建这种专家系统的基础设施。 LHASA有限公司是一家致力于促进化学和生命科学数据和知识共享的非营利组织,它还开发和维护了DEREK基因毒性专家系统.DEMEK和METEOR中使用的大部分编程都是可转让的。
LHASA Ltd.在开发下一代降解预测软件Zeneth方面取得了重大进展。已经创建了降级转换字典。通过推理规则考虑反应条件。预测是由化学家,专家等开发的“规则”(而不是通过计算化学结果)。转化与推理规则一起用于预测反应和途径的可能性,并将包括缺乏DELPHI / CAMEO的药物/赋形剂相互作用化学。动力学是间接解决的(例如,“非常可能,可能,中立,不太可能,非常不可能”)。这个软件开发正在顺利进行。
E.试验设计
API和DP的强制降解研究包括符合ICH指南的适当的固态和溶液态破坏条件(例如,酸/碱水解,热/湿度,氧化和光照射)(图2,步骤2和3) .15,16只要需要稳定性指示方法,就应进行强制降解研究(图4)。随着方法,过程或配方的变化,可能需要重复研究。本节后面的表格概述了可用于生成监管提交数据的测试和条件的一般协议。
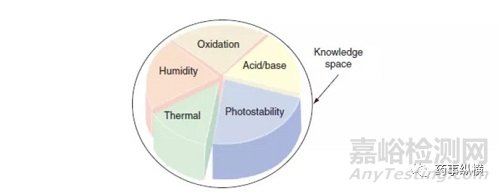
图4为开发完整的qbd知识空间而建议的降解研究的条件
1. 活性药物成分
规定的破坏条件(强度和持续时间)应使API降解约5-20%或表明API可实现的合理的最大降解条件。使用的具体条件取决于API的化学稳定性特征(即,在给定的破坏条件下它的降解速度有多快)。应将破坏样品与未破坏样品(对照)和适当的空白进行比较。在给定的破坏条件下,化合物不一定会降解。在这种情况下,不建议进一步破坏。以下实验指南给出了制药行业中的最佳的建议起始条件和最大破坏条件。
a. 酸
研究应在溶液状态下进行。为了研究酸/碱水解,推荐的pH范围为1-2,使用0.1-1.0 M HCl或H2SO4(表2)。对于在所述酸性溶液中部分溶解或不溶的某些API,可能需要加入适当的共溶剂,或调节溶液pH在酸性范围内以实现溶解;或者,API可以以悬浮液状态进行破坏(表3)。在选择合适的助溶剂时应特别注意API结构(不要将醇类用于酸性条件,因为会发生反应,表4)。二甲基亚砜,乙酸和丙酸在酸性条件下可用作溶剂。另外,取决于API对热的敏感性,可以将样品加热一段规定的时间/温度以加速降解。由于水的蒸发和实时稳定性观察到的机制偏差,建议不要超过70℃。也不建议破坏持续时间超过3周的或大于5-20%的降解。
表2 酸和碱降解条件(原料药)
| 原料药浓度 | 0.1-1.0 mg/mL |
| pH 范围 | 1-2可以不用中和, 12-13 如果没有中和,需要进行中和 |
| pH 调整 | HCl/NaOH (0.1-1.0 M) 用于低和高的范围, 磷酸盐用于中间范围 |
| 联合容积 (对于溶解性差的化合物可能需要) | 乙腈(甲醇或者DMSO也可以作为选择) |
| 备注:选择惰性溶剂避免发生反应。 | |
| 温度 | 室温到70℃(避免大于70℃,因为改变机理不能预测) |
| 时间 | 5-20%的降解,70℃条件下不超过1周,室温下不超过2周 |
| 中和 | 不建议:好处不会出现假象的风险(二次反应或人为因素) |
| 容器 | 带有橡胶隔垫的火石玻璃瓶; 气密性,因此使用助溶剂时无溶剂蒸发 |
表3 酸和碱降解条件(成品溶液)
| 原料药浓度 | 基于处方 |
| pH 范围 | 在目标pH±2单位范围 |
| pH 调整 | HCl/NaOH 用于低和高范围,磷酸盐用于中间范围 |
| 温度 | 最高70℃ |
| 时间 | 5-20% 降解或最长3周 |
表4 助溶剂选择指导
| 助溶剂 | 优点 | 缺点 |
| 乙腈 | 完全可与水混溶。紫外线透明。光化学选择的共溶剂 | 在80℃下易挥发,在酸/碱中水解,在氧气下可形成活性过酸类化合物 |
| 甲醇 | 大多数API可溶于甲醇。紫外线透明 | 对许多官能团具有反应性,特别是在酸/碱中。可能含有微量甲醛; 与胺反应 |
| 二恶烷 | 完全与水混溶,对碱呈惰性。紫外线透明 | |
| 四氢呋喃 | 完全与水混溶,对碱呈惰性。紫外线透明 | |
| 二甲基亚砜 | 可去除的良好通用溶剂,对API呈惰性,与水完全混溶 |
b.碱
碱降解研究也应以溶液状态在pH12-13的范围内进行。碱降解例子包括NaOH,LiOH或KOH(0.1-1mol / L溶液)。对于在碱性溶液中部分溶解或不溶的某些API,可能需要加入适当的助溶剂或调节溶液pH以实现溶解; 或者API以混悬液进行试验。另外,取决于API对热的敏感性,可以将样品加热一段规定的时间以加速降解,最大时间/温度持续时间(应不高于70℃和5-10%降解/最多放置3周)。对于难溶性API,可能需要惰性有机助溶剂,但必须考虑到在给定破坏条件下可能会发生的反应(表4)。甘醇二甲醚,二甘醇二甲醚,三甘醇二甲醚,1,4-二恶烷和DMSO可用于在碱性条件下获得溶解同时保持相对惰性。
c. 氧化
氧化化学可能非常复杂,并且对强制降解实验是非常大的挑战。以下条件探讨以下氧化反应:自氧化,自由基,过氧化物和其他氧化剂,稀释过氧化氢过酸,电子转移金属,光化学诱导氧化(单线态氧介导和自由基介导)。
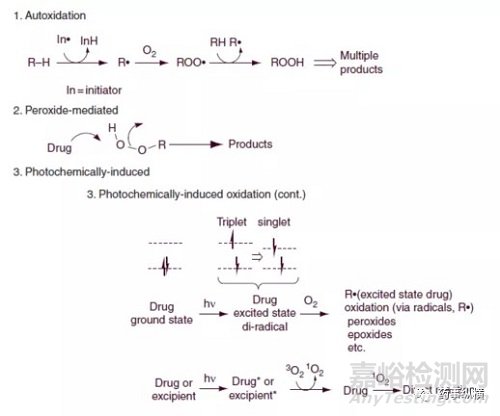
氧化可在氧气氛下或在过氧化物存在下进行(表5)。在自由基引发剂存在下使用分子氧是更现实的模型。通常,自由基引发剂和过氧化物将产生在实时稳定性上观察到的所有主要氧化降解产物。因此,强烈建议在所有开发阶段使用自由基和/或过氧化氢条件。
表5 氧化筛选条件
| 自由基链引发剂 | 引发剂 | AIBN(有机易溶解) ACVA(水易溶解) |
| 原料药浓度 | 0.1-1mg/ml | |
| 引发剂浓度 | 原料药浓度的5-20mol% | |
| 溶剂 | 乙腈/水 | |
| 温度 | 室温-60℃ | |
| 时间 | 5-20%降解或最长14天 | |
| 过氧化氢 | 试剂浓度 | 开始浓度0.3%(如果需要0.02-3%) |
| 原料药浓度 | 0.1-1mg/ml | |
| 温度 | 室温-30℃ | |
| 时间 | 5-20%降解或最长7天 |
对于溶液态自由基应力条件,使用适当的溶剂溶解API,在大气压下加入5-20mol%的自由基引发剂。为了增加氧在溶液中的溶解度,反应可以在用分子氧加压到50-300psi的反应容器中进行; 但是,大多数反应在60℃的大气压下具有足够的氧气溶解度。另外,可以加热系统以加速降解。温度取决于所选的自由基引发剂。对于水溶性API,4,40-偶氮 - 双(4-氰基戊酸)(ACVA),AIBN(偶氮 - 双 - 异丁腈 - 腈)是自由基引发剂的良好选择,半衰期为10小时 在60℃。对于有机可溶性API,AIBN是一种很好的选择,具有与ACVA相似的半衰期。
对于过氧化物条件,可以使用过氧化氢试剂(推荐的起始条件0.3%,v / v)。如前所述,取决于API溶解度,可能需要添加适当的共溶剂。过氧化氢应力测试可用于DP研究,其中氢过氧化物是赋形剂中的常见杂质.24,25固态应力条件可以通过将API(原样)放置在充满氧气顶空与氩气的合适密闭容器中进行类似研究。或氮气控制顶空。另外,取决于API对热的敏感性,可以将样品加热一段规定的时间/温度以加速降解。
对于后期开发化合物,当更多的时间和精力可以集中在机械理解上时,可以应用以下研究氧化条件(表6)。向API溶液中添加金属离子可以表明API是否具有催化氧化的趋势。在API和配方赋形剂中通常发现铁和铜离子。
表6 氧化调查条件
| 过渡金属 | 金属 | 二氯化铜或三氯化铁(单独溶液) |
| 备注:制备样品以提供氧气 | 浓度 | 1.0mM |
| 原料药浓度 | 0.1-20mg/ml | |
| 温度 | 30-40℃ | |
| 时间 | 5-20%降解或最长7天 | |
| 芬顿条件(用于与氧化降解相关的研究) | 金属 | 硫酸亚铁或氯化亚铁 |
| 金属浓度 | 1-5mM | |
| 过氧化物浓度 | 0.3-3%(选择一个) | |
| 原料药浓度 | 0.1-20mg/ml | |
| 温度 | 0℃-室温 | |
| 时间 | 5-20%降解或最长1天 | |
| 单氧(用于与氧化降解相关的研究) | 光敏剂 | 孟加拉红 |
| 光敏剂浓度 | 1.0mM | |
| 原料药浓度 | 0.1-20mg/ml | |
| 温度 | 30-40℃ | |
| 光源 | 氙灯或荧光灯(1000-10000lux) | |
| 时间 | 5-60分钟 |
过渡金属离子还可以在Fenton型反应中还原过氧化物以产生羟基自由基。此外,光还可以影响氧化反应。由光敏剂吸收的光可以与分子氧反应以形成更具反应性的单线态氧物质。
d. 热/湿
利用加速储存温度,通常大于50℃和75%相对湿度,可以评估固态稳定性(表7)。暴露的持续时间取决于API的敏感度。如果强制降温热/湿度条件产生相变,建议在低于产生相变的临界热/湿度的条件下进行。
表 7 热/湿度降解的最优条件
| 容器 | 开放 |
| 样品 | 原料药-使用有代表性的合成路线和物理形式 |
| 成品-使用高规格和低规格的样品 | |
| 温度 | 50-70℃(典型70℃) |
| 相对湿度 | 25-75%(基于早期开发阶段的仪器和资源能力的可选,典型的开始从20-30%RH和75%RH) |
| 备注:相对湿度可以用含饱和盐的干燥溶液来控制 | |
| 来源:Connors, K. Chemical Stability of Pharmaceuticals (2nd ed., Wiley, 1986), p, 19 | |
| 最长时间 | 三周(为后期化合物添加更较长时间(见相对降解率因素)) |
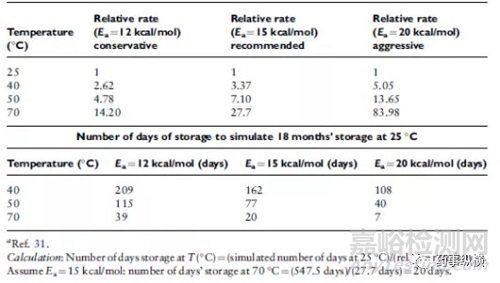
Arrhenius动力学可用于建立适当的温度和最大持续时间的热降解研究。使用适当的活化能量假设,可以估计由研究模拟的受控室温储存的持续时间。表8提供了该转换的指南。通常,建议使用相对保守的15 kcal / mol的活化能假设。先前已经研究并记录了许多药物的活化能量。平均Ea显示为19.8千卡/摩尔。当存在特别关注特殊化合物的稳定性和降解速率时,应建立活化能以允许使用Arrhenius关系在较低温度下更准确地预测降解速率。在70-80℃以上,Arrhenius动力学会偏离期望值更高,在实验设计中应考虑这种偏差的风险。关于DP的加速老化和产品保质期预测的更详细讨论作为参考提供。
表8 降解相对百分因子
e. 光降解
应根据ICH光稳定性指南(表9)进行研究。光稳定性研究的目标是通过紫外线(UV)和荧光条件随时间推移药物发生降解,以确定主要的降解产物。紫外线和可见光是原料药和成品通常暴露的最具能量的电磁辐射。当存在吸收带时,分子吸收光,其在一定程度上与入射光能重叠,并且相关发色团中的价电子被提升到激发态. 光降解条件也可以通过自由基机制诱导光氧化。光激发的分子经历解离并且形成的自由基被分子氧清除。然后,所得的过氧自由基可以进行反应,得到氧化产物的混合物。可能引入药物光反应性的官能团如下:羰基,硝基芳族,N-氧化物,烯烃,芳基氯化物,弱C-H和O-H键,硫化物和多烯。
在药物光稳定性测试中使用两种类型的研究:破坏测试和确认测试。 有目的的降解用于评估物料(未保护的药物物质和DP)的总体光敏性,用于方法开发目的和/或降解途径阐明。确认测试用于确定是否需要保护最终产品免受光照。 ICH协调三方指南涵盖了新药物和产品的稳定性测试,指出光稳定性应该是破坏测试的一个组成部分。指南建议采用系统的光稳定性测试方法,并列出要使用的光源,如下所述。唯一的要求是光源在近紫外和可见光谱区域上是连续的。
选项1.任何设计用于产生类似于D65 / ID65发射标准的输出的光源,例如人造日光荧光灯,结合可见光和紫外线输出,氙灯或金属卤化物灯。 D65是ISO 10977(1993)中定义的国际公认的室外日光标准。 ID65是等效的室内间接日光标准。对于发射320nm以下的显着辐射的光源,可以安装适当的滤光器以消除这种辐射。
选项2.对于选项2,相同的样品应暴露于冷白色荧光灯和近紫外灯。冷白色荧光灯,设计用于产生类似于ISO 10977(1993)中规定的输出; 近紫外荧光灯,光谱分布为320-400nm,最大能量发射在350-370nm之间; UV的很大一部分应该在320-360nm和360-400nm的两个波段中。样品必须暴露于两种来源; 但是,曝光可以是顺序或同时设置。(注意:ISO 10977标准包含这些光源的标准光谱功率分布以及标准窗玻璃的传输)。
指南不推荐只采用一种方式。 目前,我们的方法侧重于选项1以执行强制降解。这些强制降解研究的目标是确定主要的光降解产物,并生成用于HPLC方法开发和验证的关键预测样品。最终目标是尽快开发光稳定性指示HPLC方法。
对于确认性研究,样品应暴露在光线下,提供不低于120万勒克斯小时的总体照度和不小于200瓦特小时/平方米的综合近紫外能量,以便在原料药和成品之间进行直接比较。
根据ICH指南,“尽管强制降解实验的设计由申请人自行决定,但暴露水平应该合理。”
在计划光稳定性实验时应考虑以下因素,并在表9中概述了推荐的条年间。关键问题是竞争性热反应可能使光稳定性有目的的降解研究复杂化。应在温控条件下照射样品,以使热变量最小化。在破坏测试中,将样品放置在靠近光源的位置,以利用光强度的平方依赖性。
表9 光稳定性条件
| 可见光暴露量 | 至少2倍ICH建议的1.2百万LUX小时 |
| 紫外光暴露量 | 至少2倍ICH建议的200 W-h/m2 |
| 在溶液中的API | 推荐用于静脉注射、悬浮液和其他液体剂型 |
| ICH选项 | 1或2(如果使用选项1基于1.2百万LUX小时的暴露;选项2在紫外线区域暴露) |
| 避光控制 | 将容器用铝箔完全覆盖 |
| 容器 | 石英或硼硅酸盐玻璃容器 |
| 时间 | 由仪器决定 |
光测量应使用光度计(可见光测量为照度,紫外光测量为辐照度)。通过物理装置或化学系统进行电子测定,即每光子吸收反应的分子数的计算。对于物理光能计,关键的是对于感兴趣的波长区域校准光能计。例如,选项2(UV辐射计和荧光光度计)需要单独的光度计。 ICH协调稳定性测试三方指南提供了奎宁化学光度计的详细信息,用于监测近紫外荧光灯的暴露。与辐射计测量相比,对于选项2紫外线实验的奎宁系统测量基准测试特别有用。这可以使人们了解辐射计的定位情况(辐射计校准检查)。然而,这种奎宁化学光度计对于选项2或选项1氙光源的荧光区域不准确。阿魏酸钾光度计溶液吸收250-577nm范围内的光子,该光能计可应用于荧光系统。
可以使用选项1和/或选项2条件。根据ICH指南,“尽管强制降解实验的设计由申请人自行决定,但暴露水平应该是合理的。”确认稳定性研究的推荐暴露是总体照度不低于120万lux小时和 集成近紫外线能量不低于200 W h / m2。对于强制降解研究,样品应暴露于ICH暴露长度的至少2倍,以确保样品充分暴露。对于溶液研究,乙腈是推荐的助溶剂。甲醇可以从曝光产生的甲氧基自由基产生更多的伪影降解产物。
对于选项1,可以使用Atlas SuntestTabletop阳光曝光系统进行压力测试.TM对于感兴趣的区域300-800 nm,UV和红外辐射已被过滤器去除。此外,输出类似于阳光(D65 / ID65),这被认为是最坏情况的辐射,是理想的光稳定应力系统。该系统符合ID65“室内标准日光窗玻璃”的要求。最后,SuntestTM氙光源的光谱输出还包含选项2中遗漏的400 nm间隙区域。
另一个特别值得关注的因素是样本深度。 光降解通常发生在固态表面上,薄层物料最适合强制降解分析。 根据ICH光稳定性测试指南,“固体药物应分散在容器中,厚度通常不超过3毫米。”建议为API破坏测试(<1 mm深度)制备薄层。成品的建议如图5所示,以使暴露在光线下的平板电脑的代表性样品成为可能。暴露于整瓶药片并进行分析取样不能准确表示光稳定性问题。
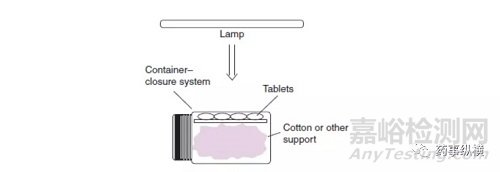
图5 建议的药物产品片剂接触样本展示
2. 成品
不能仅通过API在固态或溶液中的稳定性研究来预测DP降解。非API也可以与API反应或催化降解反应。赋形剂中的杂质也可导致最初在API中观察到的DP降解。对于固体口服DP制剂,通常使用热,光和湿度作为适当的压力条件。如API所示,DP破坏条件应导致API降解约5-20%或代表给定配方的合理最大条件。使用的具体条件取决于DP的化学特性。对于固体DP,关键实验是热,湿度和光稳定性。对于溶液配方,除了热和光稳定性之外,推荐的其他实验包括酸/碱水解和氧化。
对于水溶液制方,显然不需要对热条件进行湿度研究。 建议将破坏样品与未破坏样品和适当的空白进行比较。 对于DP研究,空白样品是合适的安慰剂。破坏的安慰剂样品将提供关于观察到的降解产物是否与API相关或仅与赋形剂降解有关的信息。建议沿着反应途径采取动力学时间点进行API和DP降解研究,以确定初级降解物并更好地了解降解途径。
F. 稳定性指示方法开发
稳定性指示方法被定义为精确定量活性成分而不受降解产物,工艺杂质,赋形剂或其他潜在杂质干扰的分析方法。 精确定量显著降解物的方法也可以被认为是稳定性指示。 开发稳定性指示HPLC方法的第一步即为强制降解。如果早期进行强制降解研究,可以并行进行方法开发和初级降解产物和未知杂质的鉴定。使用该过程,可以在不会延迟项目时间的情况下生成经验证的HPLC分析测定,降解机制和用于归档的杂质/降解物信息。
1. 质量守恒
质量平衡在ICH杂质指南1中定义为“将测定值和降解产物的水平加在一起,看看这些加起来与初始值的100%的接近程度,同时适当考虑分析误差的余量。” 评估质量平衡可以提供相应的信息,以确保所选择的分析策略控制所有重要的降解物(图2,步骤5)。指南认识到由于未知的分析精度和响应因子的差异,很难确定质量平衡。 Nussbaum等人提供了有关帮助分析师获得或接近质量平衡的其他指导。
2. 关键预测样本集
给定化合物的关键预测样品组(KPSS)(图2,步骤6)包含显著降解物加工艺杂质,可包括中间体,原料和副产物,与工艺相关的杂质和已知的降解产物可用作方法开发中使用的参考标准。未知的降解产物在开发稳定性特定方法中也是至关重要的。强制降解研究可能会产生复杂的降解物混合物,但方法开发应仅考虑重要的降解物。虽然项目特定因素可能会影响对及鞥街重要性的判断,但下面的示例描述了考虑到研发阶段通常可以应用的指导原则。我们建议,如果破坏测试样品中的降解物未能超过所描述的任一阈值,则可判断其中的降解物非显著杂质。
实施例1.来自探索性API强制降解研究的降解样品显示25%主成分降解。分析显示主要降解物(16%),第二降解物(3%)和NMT 2%水平的若干其他降解物。 16%的峰值是最大的降解物,占总降解量的60%,并且被认为是显著的。尽管3%组分占总降解量的10%以上,但其含量低于最大降解物的25%,因此判断为非显著。2%或低于2%的组分小于总降解的10%,并且小于最大降解物水平的25%。因此,被认为不重要。
实施例2.强制光降解实验导致10%主成分降解。观察到许多单独的降解物,其中最大的是0.8%。由于没有单个杂质超过10%的总降解,因此被认定没有显著杂质。
图2详细介绍了关键降解杂质样品生成和选择所涉及的过程。然后应该进行工作以酌情识别未知的重要降解物。可以通过液相色谱(LC)/质谱(MS)选择性的验证这些分析物峰的完整性。还可以通过收集目标峰并通过另一种方法(薄层色谱(TLC),GC或第二HPLC系统)对其进行色谱来验证峰的纯度。通常,可以在大规模的基础上生成关键预测样本以用于制备分离。当识别出可能的结构并且可以在几个短步骤中完成化学反应时,小规模合成也是一种选择。
3. 立体化学稳定性
应根据具体情况评估手性原料药在强制降解研究期间的立体化学稳定性。CAMEO分析可以成为评估API中手性中心外消旋化问题的有用工具。如果降解预测表明任何条件都可能出现外消旋化,则应探索立体化学稳定性。应使用手性方法分析具有一个或两个手性中心的API。根据预测数据和化学知识,选择最有可能导致外消旋化的降解条件。如果所选条件不反转或外消旋API,则手性分析不需要是进一步强制降解方案的一部分。
具有三个或更多个手性中心的API最可能转化为非对映异构体并且可以用非手性方法分析。在定量,鉴定和鉴定阈值方面,立体异构体应与任何其他API相关杂质一样对待。建议的程序是选择最后一个时间点或每个条件下5-20%降解的时间点,并寻找外消旋条件,如果在任何破坏条件下没有外消旋化,那么该信息用于证明为什么手性方法不需要成为控制策略的一部分。
4. 物理化学稳定性
药物开发后期出现的多晶型可能需要重新配制,重新开发分析方法和改变制造程序。 除此之外,一些物理形式的变化仅发生在固态。由于这些原因,应在强制降解研究期间监测固体形式变化,包括在封闭和开放容器中对溶剂化物和水合物进行破坏。如果检测到固体形式变化,则新形式的降解率可能会发生变化; 因此,除物理稳定性外,还应评估化学稳定性。
5. 鉴定降解物质
降解产物结构阐明需要多维方法,通常涉及MS和NMR分析(如果需要,还有其他光谱技术,如UV和IR和色谱技术,如2D-LC)。在团队环境中,通过分析,过程,配方和光谱科学家的共同努力,可以极大地促进这种多维方法。(图2,步骤7)通常,重点是仅通过第1阶段临床阶段收集LC / MS数据。在第2阶段临床阶段及以后,使用所关注的强制降解产物的NMR表征,在分离,合成和结构同一性方面投入更多时间。
G. Pharma D3降解数据库
已经创建了一个结构可搜索的降解概况数据库,用于编译API / DP降级数据并在辉瑞公司全球共享降解知识(图2,步骤8).该数据库是基于网络的新型“混合”发布/数据库范例,其中两种化学品都是结构和相关报告存储在称为“药物开发数据库”的结构和可搜索的数据库中,也称为“药物D3”.Pharma D3的使用通过建立与功能组的趋势来实现药物稳定性的主动方法允许增强降解结果的预测。它的开发旨在解决某些关键目标,包括:改善沟通,减少重复劳动,建立积极主动的药物稳定性方法,预测问题并确定数据趋势。
利用降解谱数据库,分析人员可以按结构搜索并生成在每种降解条件下观察到的所有鉴定的降解物的列表结果。该数据库还包含子结构搜索功能,允许分析人员检索具有相似结构的化合物的所有记录。该功能非常强大,因为它能够更好地预测降解反应并更好地利用我们的历史降解研究库。在数据库中跟踪以下数据:化合物编号,笔记本参考,盐形式,母体结构,降解结构,分子量/降解物分子量的变化,降解实验条件,HPLC程序参考,进行降解HPLC筛选分析的条件,参与降解途径的功能组,结构解析数据,报告参考,电子报告链接和降解物的拟议机制(图6)。
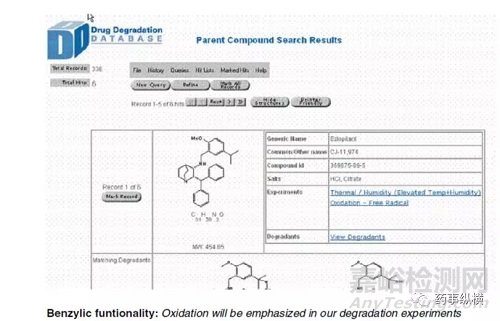
图6 降解数据库筛选截图

来源:DEGRADATION AND IMPURITY ANAL


