方法: 采用正交设计法,以脆碎度、崩解时限、黏冲情况、在酸中60min溶出度的综合评分为指标优化处方。
结果: 最佳压片处方为微晶纤维素20%、硬脂酸镁2%、交联聚维酮7%、兰索拉唑肠溶微丸15%。3批样品脆碎度、崩解时限、含量和含量均匀度均符合要求; 40℃放置6个月脆碎度、崩解时限、含量、有关物质和溶出度均无明显变化。
结论: 使用正交实验优化处方制备的兰索拉唑肠溶口崩片质量稳定、可控。
关键词 兰索拉唑; 肠溶口崩片; 微丸压片; 正交实验; 稳定性
兰索拉唑(lansoprazole)临床主要用于治疗胃及十二指肠溃疡,其疗效较好,不良反应少,抑酸作用是奥美拉唑的2倍[1]。目前,市场上国产的兰索拉唑制剂主要有肠溶片和肠溶胶囊2种剂型,而微丸片只有日本武田公司生产的肠溶兰索拉唑口崩片,商品名为普托平。肠溶制剂主要有单单元制剂和多单元制剂2种,大多数的肠溶片剂都是单单元制剂,因此药物的作用和吸收容易受到消化物迁移的影响,而多单元制剂能弥补这个缺点。但普通的胶囊体积较大,患者不易吞咽,用药的顺应性较低; 再者,有些药物使用时需要调整剂量,而片剂相较胶囊给药更加灵活[2-3]。兰索拉唑口崩片是口腔内快速崩解的质子泵抑制,该药放入口腔后,会在30s内崩解为无数包有肠溶衣的小丸微粒,每个微粒由几层结构组成,这样可以抵抗胃蠕动所造成的挤压,从而保证药效不受影响[4-10]。
本研究是在前期研究的基础上,采用流化床上药技术制备兰索拉唑载药丸芯,流化床包衣技术包隔离衣和肠溶衣,并加其他辅料与肠溶微丸混合压片。以兰索拉唑肠溶微丸、稀释剂微晶纤维素、崩解剂交联聚维酮、润滑剂硬脂酸镁,采用正交设计法,选择片剂崩解时限、脆碎度、黏冲情况和在酸中60min溶出度的综合评分作为评价指标优化处方,最终制备成兰索拉唑肠溶口崩片,同时考察制剂质量及稳定性。
材料与方法
1 药品与试剂
兰索拉唑(桂林华信制药有限公司,批号: 56722035155); 蔗糖丸芯0.250~0.355mm(杭州高成生物营养技术有限公司,批号: 20231001); 碱式碳酸镁(Sudeep Pharma Pvt. Ltd. 公司,批号: 21K/ML/010); 羟丙甲纤维素E5(安徽山河药用辅料股份有限公司,批号: 210126); 尤特奇L30D-55(德国赢创公司,批号: B210403204); 尤特奇NE30D(德国赢创公司,批号: B220501540); 单硬脂酸甘油酯(GAT TEFOSSE SAS公司,批号: 195281); 柠檬酸三乙酯(江西阿尔法高科药业有限公司,批号: 20230401); 红氧化铁(宁波一品生物技术有限公司,批号: 230215); 聚山梨酯80(湖北葛店人福药用辅料有限责任公司,批号: F104C220101); 微晶纤维素(micro crystalline cellulose,MCC) 102(湖州展望药业有限公司,批号: 20221001); 甘露醇(罗盖特公司,批号: E257H); 交联聚维酮XL-10(ISP Chemicals LL公司,批号: 060224033); 阿斯帕坦(湖南九典宏阳制药有限公司,批号: TF67230201); 无水柠檬酸(Merck KGaA公司,批号: K52745002); 草莓香精[曼氏(上海)香精香料有限公司,批号: E21088687]; 硬脂酸镁(安徽山河药用辅料股份有限公司,批号: 200354)。
2 仪器
LBL1型流化床制粒包衣机(重庆市科旭制药机械制造有限公司); BSL25型料斗混合机(重庆瀚威迪科技有限公司); ZP10A型旋转式压片机(北京新龙立科技有限公司); ESJ1004B型天平(沈阳神宇龙腾天平有限公司); YD35型片剂硬度仪(天津市天大天发科技有限公司); KB1型口崩片崩解仪(天津市天大天发科技有限公司); FOCS ZJ2型溶出仪(安捷伦科技有限公司); UV2600型紫外分光光度计(日本岛津公司); S210型pH测定计(赛多利斯科学仪器有限公司); 1260ImfinityⅡ型高效液相色谱仪(美国安捷伦科技有限公司)。
3 肠溶片的制备方法
3.1 载药丸芯
将羟丙甲纤维素E5(15%)分散在80℃纯化水中,加入碱式碳酸镁(10%)和兰索拉唑(29%),搅拌均匀,得上药混悬液。将蔗糖丸芯(46%)置于流化床中,待物料温度达到38℃以上开始喷上药混悬液,喷完后保持同样的参数干燥10min。分别过30和55目筛,收集30~55目的微丸,得载药丸芯。
3.2 隔离衣层将羟丙甲纤维素E5(8.3%)在80℃纯化水中分散搅拌,冷却至澄清; 加入滑石粉(8.3%),搅拌成混悬液。将载药丸芯(83.4%)置于流化床中,待物料温度达到38℃以上开始喷液,喷完后保持同样的参数干燥10min。分别过30和55目筛,收集30~55目的微丸,得隔离衣微丸。
3.3 肠溶衣层将聚山梨酯80(1%)、柠檬酸三乙酯(2%)和单硬脂酸甘油酯(1%)加入纯化水中搅拌均匀,再加入尤特奇L30D-55(12.7%)水分散体中,搅拌均匀,得混悬液。将隔离衣微丸(83.3%)置于流化床中,待物料温度达到25℃以上开始喷混悬液,喷完后保持同样的参数干燥10min。干燥后分别过30和45目筛,收集30~50目的微丸,得到兰索拉唑肠溶微丸。
3.4 肠溶微丸压片及处方优化将兰索拉唑肠溶微丸、MCC102、甘露醇、交联聚维酮XL-10、阿斯帕坦(0.5%)、柠檬酸(1%)、草莓香精(0.5%)和硬脂酸镁置料斗混合机中混合,再使用压片机压片,得肠溶口崩片。
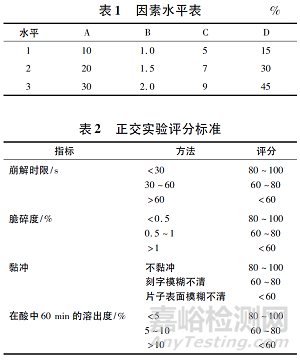
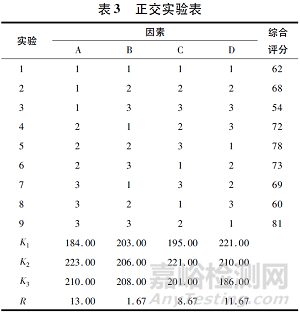
由于肠溶口崩片的压片辅料成分性质不同、在处方中的作用不同,所以各成分的合理配比是制成优良处方的关键。前期研究中,对各辅料在处方中的作用进行了分析,对肠溶口崩片制剂压片工艺影响较大的辅料有MCC、交联聚维酮、硬脂酸镁等。在前期研究的基础上,选取MCC(A)、硬脂酸镁(B)、交联聚维酮(C)、兰索拉唑肠溶微丸(D)作为4个因素,确定正交实验水平(见表1)。以稀释剂甘露醇补足剩余处方量,并根据口崩片制剂应用特点,分别以崩解时限、脆碎度、黏冲情况和在酸中60min的溶出度(见表2),按照L9(34)正交表进行实验,对各指标结果加权后进行综合评分[综合评分=崩解时限评分×0.3+脆碎度评分×0.2+黏冲评分×0.2+在酸中60min溶出度×0.3]。
4 崩解时限测定方法
取本品,按照《中华人民共和国药典》2020年版通则0921进行检查,应在60s内全部崩解并通过筛网,重复测定6片。
5 脆碎度测定方法
取本品约0.65g,吹去片剂脱落的粉末,精密称重,置脆碎度仪圆筒中,转动100次,取出,同法除去粉末,精密称重,减失重量不得超过1%,且不得检出断裂、龟裂及粉碎的片。
6 体外释放度测定方法取本品按照《中华人民共和国药典》2020年版通则0931第二法(桨法)测定,以0.1mol·L-1盐酸溶液为溶出介质Ⅰ,在转速为75r·min-1下进行溶出实验,1h后取溶液25mL,滤过,弃去初滤液10mL,取续滤液作为供试品溶液Ⅰ,立即将37℃磷酸盐缓冲液425mL缓慢加入溶出杯中,迅速用2mol·L-1盐酸溶液或2mol·L-1氢氧化钠溶液调节pH值至6.80±0.05,作为溶出介质Ⅱ,继续溶出45min,取溶液25mL,滤过,弃去初滤液10mL,取续滤液加溶出介质Ⅱ稀释制成1mL中约含兰索拉唑16μg的溶液,作为供试品溶液Ⅱ。另精密称取兰索拉唑对照品60mg,置50mL量瓶中,加甲醇溶解并稀释至刻度,作为对照品贮备液,精密量取对照品贮备液适量,加0.1mol·L-1盐酸稀释至1mL中含2.4μg的对照品溶液,作为对照品溶液Ⅰ。取供试品溶液Ⅰ和对照品溶液Ⅰ,照紫外分光光度法,在332nm波长处分别测定吸光度,计算每片的释放量; 再精密量取对照品贮备液1mL,置100mL量瓶中,加溶出介质Ⅱ稀释至刻度,摇匀,作为对照品溶液Ⅱ,取供试品溶液Ⅱ和对照品溶液Ⅱ,照紫外分光光度法,在286nm波长处分别测定吸光度,计算每片的释放量。
7 含量均匀度测定方法
取本品1片,置100mL量瓶中,加入0.1mol·L-1氢氧化钠溶液30mL,超声使片剂完全崩解并使兰索拉唑溶解,加乙腈65mL,室温放置1h,加乙腈稀释至刻度,摇匀,离心,取上清液滤过,弃去初滤液5mL,精密量取续滤液适量,用0.1mol·L-1氢氧化钠溶液-乙腈(3∶7)稀释制成每1mL中含兰索拉唑12μg的溶液,作为供试品溶液。另取兰索拉唑对照品适量,精密称定,同法操作制成1mL溶液中含兰索拉唑对照品12μg的溶液。照紫外分光光度法,在294nm波长处测定吸光度,计算含量。文章内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明【来源:凡默谷公众号】。
结果
1 压片处方优化结果
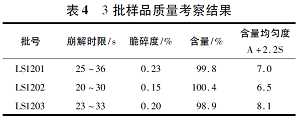
直观分析结果见表3。
各因素对指标影响的大小次序为A>D>C>B,即MCC用量对崩解时限、在酸中的溶出度、脆碎度、黏冲情况影响最显著,R值为13.00; 兰索拉唑肠溶微丸和交联聚维酮用量对肠溶口崩片各性能的影响次之,R值分别为11.67和8.67; 而硬脂酸镁对制剂的影响最小,R值为1.67。最佳组合为A2B3C2D1,即MCC为20%、硬脂酸镁为2%、交联聚维酮为7%、兰索拉唑肠溶微丸为15%。
2 质量考察
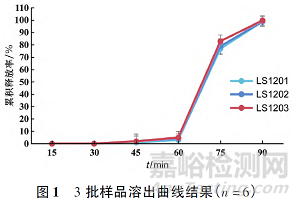
按照优化处方连续制备3批样品,分别测定崩解时限、脆碎度、含量、含量均匀度、溶出曲线,结果见表4和图1。
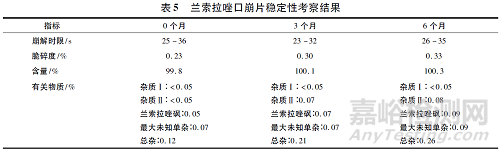
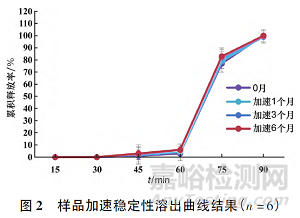
3 稳定性考察
将制得的兰索拉唑口崩片进行铝塑包装,置于40 ℃, 75%RH 条件下6 个月进行稳定性考察,结果见表5 和图2。结果表明,40 ℃放置6 个月样品脆碎度、崩解时限、含量、有关物质和溶出度均无明显变化,产品稳定性较好。
讨论
本研究采用流化床上药法制备载药丸芯,流化床包衣得到肠溶微丸,最后将肠溶微丸与其他辅料混合,压制成兰索拉唑肠溶口崩片。微丸压片在初期考察时出现黏冲现象,可能是由于口崩片中含有大量的甘露醇、疏水性的MCC用量较少导致黏冲,此外,硬脂酸镁用量也会影响黏冲情况。压片过程中,如果肠溶微丸在片中的占比过多,微丸在压片的时候被压碎,会导致在酸中的溶出出现突释现象。口崩片的崩解时限受崩解剂和MCC的影响。
本品为肠溶制剂,在体外释放度方法开发过程中,选用了不同pH的释放介质,模拟药物进入人体消化道后的过程,并对兰索拉唑在各所用释放介质中的紫外吸收进行了考察,结果见图3。兰索拉唑在溶出介质Ⅰ和Ⅱ中的最大吸收波长分别为332和286nm,因此确定了体外释放度的检测波长。
本研究以崩解时限、黏冲情况、脆碎度和溶出度作为指标,通过四因素三水平的正交实验,筛选出了优化后的处方,并用优化后的处方进行连续3批的样品制备。结果表明,以优化后的处方制备的样品溶出度、崩解时限、脆碎度、含量和含量均匀度均符合要求。稳定性考察结果表明,40℃放置6个月样品脆碎度、崩解时限、含量、有关物质和溶出度均无明显变化,产品稳定性良好。