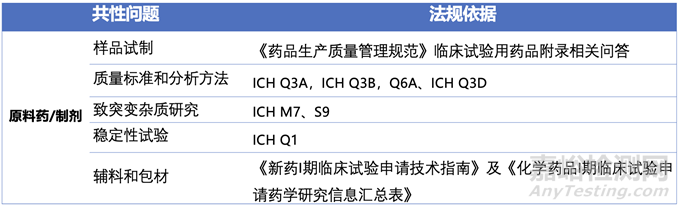
表1汇总了创新药临床I期前药学共性问题,其列出了原料药和制剂中常见的5个问题,前4个问题基本与产品安全性相关。其中样品试制和稳定性试验研究在IND之前是较为常见的共性问题。复盘文章中针对临床I期最为常见的有样品试制条件、质量标准、致突变杂质,以及稳定性数据积累。
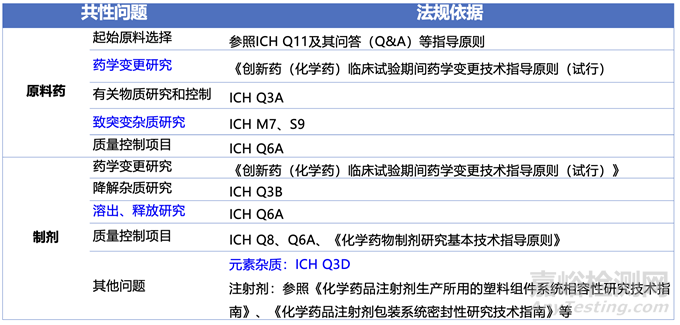
表2汇总了创新药临床III期前药学共性问题。临床III期属于关键临阶段研究,该阶段药学研究中常见的共性问题开始逐渐被看到。原料药中常见的起始物料选择,杂质研究,晶型控制,粒度控制,有关物质方法研究。制剂中关注溶出方法开发、介质选择和区分力。处方工艺这个阶段基本要被锁定,为药品上市积累足够的数据。复盘文章中,最为常见的是杂质限度、基毒杂质评估、晶型研究和溶出方法开发。
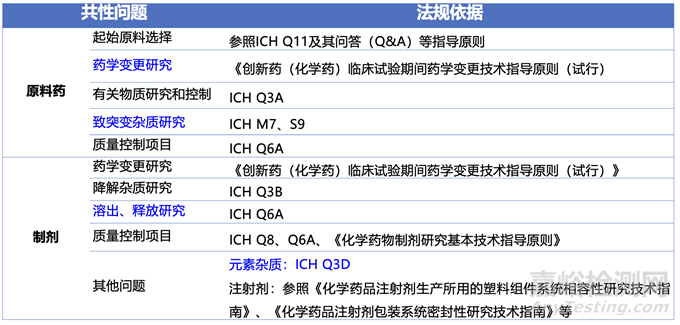
表3汇总了创新药上市前药学共性问题。这个阶段CDE关注药品上市前药学研究的充分性。原料药中,比如起始物料的研究是否已经充分;比如临床期间的变更是否都有相关的桥接对比数据;比如相关杂质研究是否已经充分,以及限度是否得到了界定;制剂中溶出方法和接受标准基本需要确定;复盘文章中较为常见的有PPQ批次是否可以商业化,制剂商业化批次的批量,溶出方法的开发,以及制剂生产地的变更。
表1:创新药临床I期前会议-药学共性问题相关技术要求
表2:创新药临床III期前会议-药学共性问题相关技术要求
表3: 创新药上市前会议-药学共性问题相关技术要求
长三角与大湾区的创新药企业占比国内新药研究80%以上,基本可代表国内新药研究方向,所遇到的难点问题具有代表性。
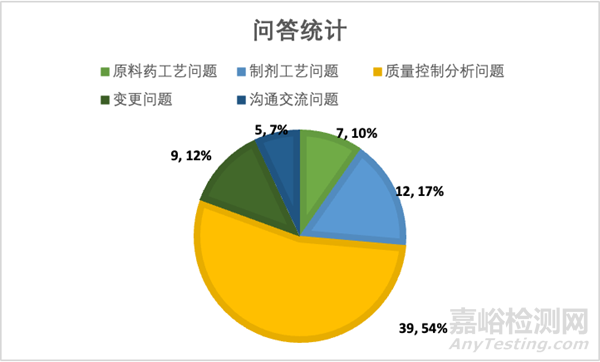
根据前面复盘文章的问题类型,包括原料药工艺,制剂工艺,质量控制分析,变更和沟通交流,共72个问题,质量控制分析相关的问题达54%,超过一半。其次是制剂工艺和原料药工艺,分别为12%和10%,这些比例刚好也反映了共性技术指南中的问题分布,说明企业在研究中实际遇到的问题与CDE的关注点是较匹配的。
如图1统计,CMC部门可有针对性的提前布局相关计划和策略,建议如下:
1.质量分析控制问题占半数以上,相关的资源和时间要提前计划,分析相关问题要讨论透测,研究要做充分,避免一些较为常见的问题在沟通交流中得不到有效的回复,比如杂质限度、晶型研究、溶出方法等。
2. 原料药中关键问题是起始物料的指认。这个难点会一直持续到上市前,因此在IND时,药学部门应有策略性的考量,包括合成路线,供应商选择、物料成本和研究时间。
3. 制剂上市前关键问题为批量的选择。临床期间和上市后批量通常不同,是逐步放大。批量放大常伴随厂地和工艺的相应变更,从而引出变更级别判断和体内桥接研究的必要性。针对这一点,CMC部门如能提前计划,锁定工艺和生产厂地,批量能在同一厂地切换,这将大大减少关键临床期间或者上市后的变更资源占用和风险控制。
4.药学变更问题量虽不多,但重要性不言而喻。CMC部门要提前规划相应变更时间节点,与临床部门沟通合作。关键临床后,尽量不发生一些重大的变更,比如原料药和制剂的工艺、处方变化,比如生产厂地变化,监管方对这些变更通常会要求进行体内数据的桥接,仅有溶出曲线的对比会引发审评老师的担忧。
5. CDE临床批件作业中常有提醒,在临床2/3期前建议申请人与CDE进行沟通。针对这类作业,CMC部门要利用一些关键节点的机会,与监管当局充分沟通药学计划,包括工艺变更,起始物指认,方法,质量标准,变更后桥接数据的有效性,以及为上市前的药学研究充分性等。
6. 药学研究相对于临床研究通常要提前一些时间,因为药品的临床数据一旦提示非常好,会跑的相对较快。监管方对于药学研究的充分性并不因临床效果好而减少,一个新药能否快速上市,药学研究部分可能会成为关键路径,因此与临床研究关键节点的合作沟通,相应研究提前规划就显得尤为重要。
图1: 长三角/大湾区问答统计分类
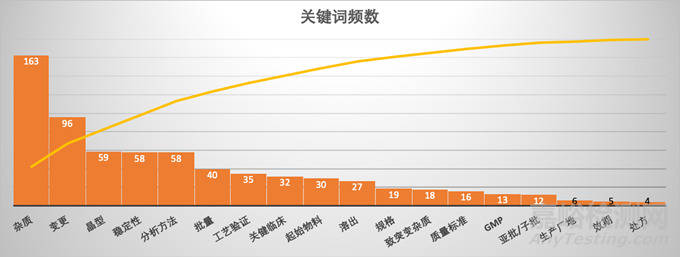
针对前面复盘文章中,笔者粗略统计了问答中常见关键词及它们在与CDE沟通交流中出现的频数,如图2。前十位关键词包括杂质、变更、晶型、稳定性、分析方法、批量、工艺验证、关健临床、起始物料和溶出,总结如下:
1. 可以看到杂质出现次数遥遥领先,是唯一一个超过100次的关键词,这也符合监管方与申请人的预期,在新药研究中,安全性是监管方排在首位的关注点
2. 其次是变更。在新药研究中,变化是唯一确定的事物,创新药的难点在于相关研究需要一直提高与改进。
3. 稳定性属于安全性关注的一个关键点,很多药物由于开发的工艺或者处方不合适,最终败在稳定性上面,申请人尤其值得关注,一个好药不仅要效果好,也要有较好的稳定性才能开发下去。
4. 工艺验证虽排第6位,但其重要性非常突出,是上市前核查重点项目,包括方案,数据,参数和结果,在国内工艺验证步骤是承上启下的关键节点。
5. 在前十个关键词中,唯一与药学研究看似没有相关性的有“关键临床”。它是一个很重要的研究节点,临床研究进入注册阶段或确证性阶段,相应的药学研究应较完整,药学研究也应达到一个关键阶段,以满足关键临床阶段用药,同时考量关键临床至上市前的药学变化要控制到一定的程度,避免引入临床数据桥接评估的额外风险。
图2: 长三角/大湾区问答中关键词频数统计
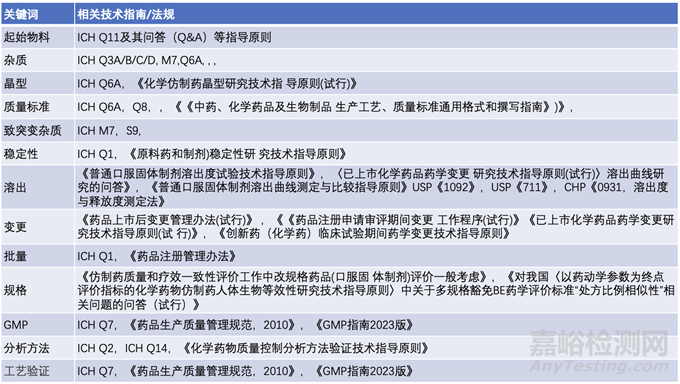
表4: 长三角/大湾区问答中常见关键词与相关药学技术指南
小结:
表4列出了各关键词涉及的常见法规指南技术要求,供同行读者参考,不断提高和完善药学研究。
复盘学习总有一些不足,无法面面俱到,这也是笔者一直努力加强的地方,比如对于临床试验和设计的理解,比如临床试验与药学研究的相关性。