【答】1、配制开始前关键要素准备和检查
(1)环境及卫生检查: 查配制间的温湿度、压差、环境卫生状况符合生产工艺要求,确认已完成清场工作且在有效期内。
(2)公用介质检查及准备: 确保压缩空气、保护气体等满足生产需要,各接口无泄漏。
(3)仪器检查: 检查如电子天平等仪器完好,校验标识在有效期内。
(4)检查气体过滤滤芯应在规定使用期限内。
(5)设备/器具清洁检查:确认配制系统各设备,设施状态完好并已清洁消毒灭菌,且在有效期内,器具经清洁灭菌后无菌转运至配制间待用。如果不是无菌投料,配制工具可以灭菌后密闭转移。
(6)检查A级区的层流装置,确保层流运行正常 (如适用)。
(7)检查配制所需的记录、文件、标识等均符合规定。
(8)按照批生产指令和产品工艺规程,设置工艺参数及配制模块下载产品配方和填写配方名称及批次、批量,包括工艺参数涉及物料名称、物料重量、混粉转速/频率、混粉时间等 (如适用)。
(9)物料准备和检查: 按照批生产指令核对生产所需原辅料是否齐全,且包装袋或容器应密封且完好,经过消毒或灭菌后经过无菌转运至称量处。如果不是无菌称量,工具灭菌后密闭转移。
(10)消毒液的领取准备: 检查即将使用的消毒液应在配制有效期。
2、 配制过程岗位操作
(1)根据产品工艺规程计算复核批生产指令的原辅料投料量应准确无误,并双人复核。
(2)若使用全无菌工艺进行配制,应在A级环境下对无菌物料进行称量,并双人复核。若配制后药液经除菌过滤,则应在A级送风下进行称量。
(3)按产品工艺顺序及要求逐一核实原、辅料的品名、性状、重量等,准确无误后开始按工艺要求无菌投料,建议采用自动投料设备以降低投料过程的污染风险。
(4)应按照产品工艺规程的规定转速、时间等要求,进行混合。配制岗位日常生产监控点见表6-5。
3、 配制结束后
(1)剩余物料需在对应称量环境级别下进行密封,如若使用全无菌工艺进行配制,应在A级环境下对剩余无菌物料进行密封,若配制后药液经除菌过滤,则应在A级送风下对剩余物料进行密封。专人确认后进行退库/处理。对于已开封剩余物料的包装流程和密封效果转移及再次使用流程应有相关研究和要求。
(2)生产结束后进行滤芯完整性测试,使用前可通过风险评估确定滤芯完整性测试的必要性。工器具拆卸、清洗、消毒、灭菌。
(3)岗位清场,各设施、设备、工器具拆卸、清洗、消毒、灭菌。
(4)配制系统在线清洗 (CIP) 和在线灭菌 (SIP) 等。
表 6-5 配制岗位日常生产监控点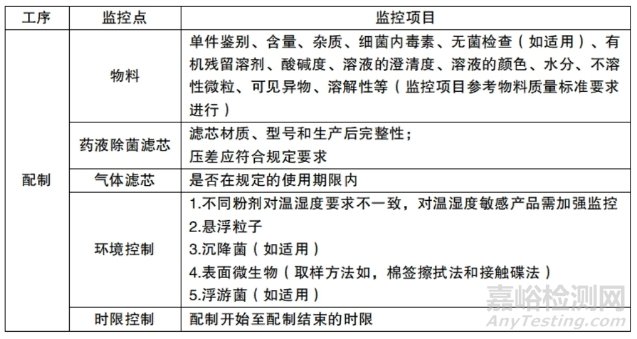
来源: 药品GMP指南第2版无菌制剂上册 (P164-166)




