近期,武汉大学药学院黎威教授在科爱创办的期刊Bioactive Materials上发表文章:一种具有药物监测功能的微针贴片用于光控协同治疗黑色素瘤。黑色素瘤是最具侵袭性和恶性的皮肤癌,该研究设计了一种基于自我监测微针(MN)的给药系统,该系统将水溶性MN贴片与聚集诱导发射(AIE)活性PATC微粒集成在一起,成功实现黑色素瘤的光控脉冲化学-光热协同治疗。
1、研究内容简介
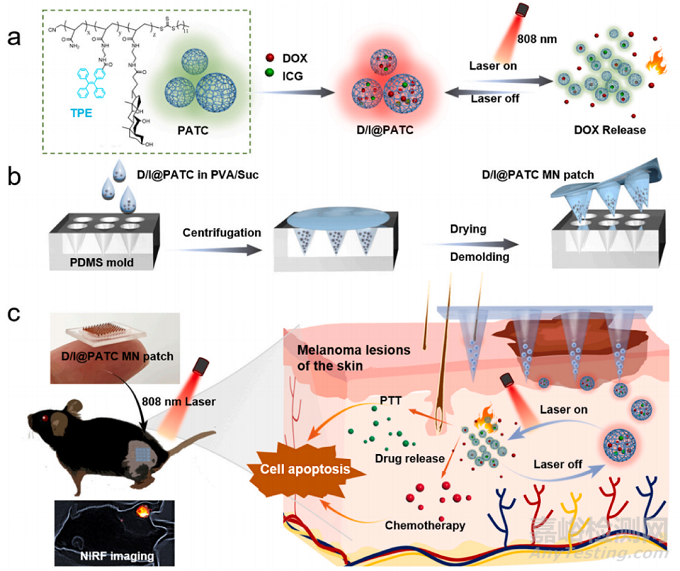
微针(MN)是一种新型的微创经皮给药系统,它可以刺入皮肤表面以下,在不损伤血管、不接触神经末梢的情况下,实现药物在皮肤内的缓释。因此该种给药方式不产生疼痛,能够显著提高患者的依从性。通过使用微针可以将小分子化学药物和生物大分子成功的递送到皮下用于局部治疗或全身治疗。本研究利用微针的特性,开发了一种基于可视化相变聚合物的微针贴片的自我监测脉冲药物释放系统,用于实时监测药物释放和化疗-光热协同治疗黑色素瘤。所选用的聚合物Poly-AM-TPE-CAA (PATC),具有生物相容性和热响应性,在低温条件下聚集体具有很强的荧光,而在高温下解离成较小的颗粒,荧光减弱(图1a),适用于直接荧光监测药物释放过程中的相变过程和热触发后的药物释放验证。为了证明微针给药系统治疗黑色素瘤的有效性以及AIE特性,我们将两种模型药物,包括化疗药物DOX和光热剂ICG,共包封在PATC聚合物中,得到D/I@PATC微粒,随后将这些微粒浓缩在微针的末端,形成D/I@PATC MN贴片,有效提高了给药效率(图1b)。本研究开发的D/I@PATC MN贴片,将MN的特性与AIE活性微粒子相结合,不仅实现了MN药物释放的可视化和验证,而且提高了体外和体内光热稳定性和可靠性。体外研究表明,D/I@PATC微颗粒具有优异的光控释药能力,在低剂量单次给药下具有较强的抗肿瘤作用。体内抗黑色素瘤实验表明,单次给药D/I@PATC MN贴片可实现时空可控的化学光热治疗,几乎完全抑制肿瘤生长,且无明显的全身毒性(图1c)。D/I@PATC MN贴片对黑色素瘤的有效治疗为临床治疗黑色素瘤提供了新策略。
图1:用于黑色素瘤治疗的D/I@PATC MN贴片示意图。a) D/I@PATC聚合物颗粒的制备及激光触发药物可视化释放。b) D/I@PATC MN贴片的制作工艺。c)用于激光触发化学-光热协同治疗黑色素瘤的D/I@PATC MN贴片示意图。
一、D/I@PATC颗粒的制备与表征
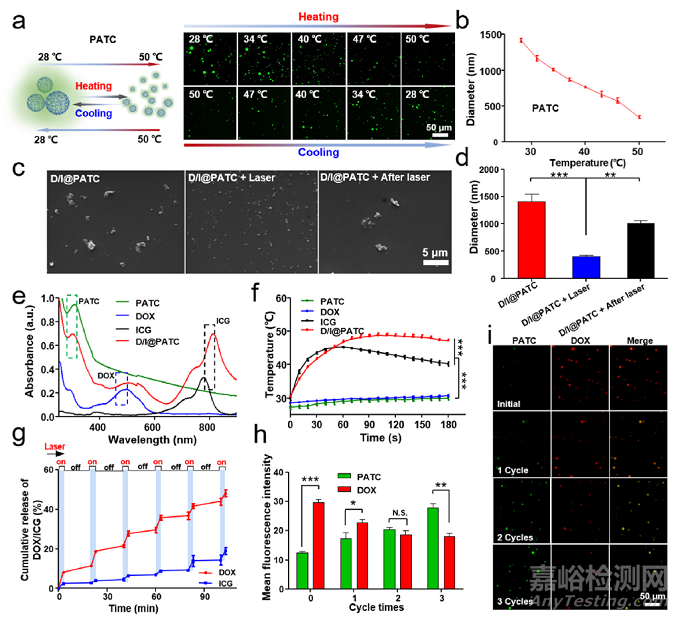
D/I@PATC颗粒的可视化相变表征。a) AIE活性PATC微粒可逆可视化相变过程示意图和CLSM图像。b)不同温度下PATC悬浮液的水动力直径。c)扫描电镜图像和d)激光照射前后D/I@PATC的尺寸定量。e) PATC、DOX、ICG和D/I@PATC的紫外-可见吸收光谱。绿色、蓝色和黑色虚线框分别表示PATC、DOX和ICG的特征峰。f)以PATC、DOX和ICG为对照样品,808 nm (0.5 W/cm2)照射下D/I@PATC粒子的光热效应。g)在808 nm激光(0.5 W/cm2)开(3 min)/关(17 min)周期照射下,D/I@PATC在PBS溶液中的体外累积DOX和ICG释放量。i) 808 nm激光反复“开/关”循环照射(3 min, 0.5 W/cm2)前后D/I@PATC粒子的代表性荧光图像和h)对应的定量荧光强度。绿色荧光:PATC; 红色荧光:DOX。每个点代表平均值±SD (n = 3)。*p<0.05, **p<0.01, ***p <0.001. N.S.表示没有差异。
二、体外细胞毒性及抗肿瘤功效
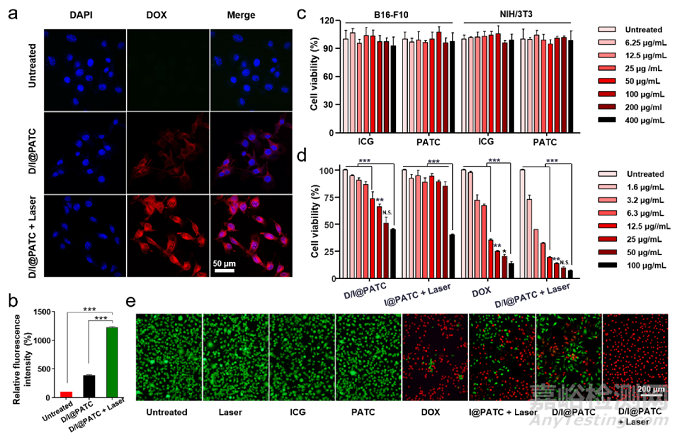
D/I@PATC释放DOX的细胞摄取及体外细胞化疗和光热效应。a)无808 nm激光照射(0.5 W/cm2, 3 min)或用D/I@PATC孵育8 h后B16-F10对DOX的细胞摄取。b)不同处理B16-F10细胞对应的定量红色荧光强度。c)不同浓度ICG和PATC孵育24 h后B16-F10和NIH/3T3细胞的细胞活力d) DOX、D/I@PATC、I@PATC激光和D/I@PATC激光处理B16-F10细胞的细胞活力。4种处理的DOX浓度一致。e) 不同材料处理B16-F10细胞的活/死细胞染色实验。绿色荧光:钙黄绿素,红色荧光:碘化丙啶(PI)。每个点代表平均值±SD (n = 3)。每个点代表平均值±SD (n = 3)。*p<0.05, **p<0.01, ***p <0.001. N.S.表示没有差异。
三、微针贴片的制备与表征
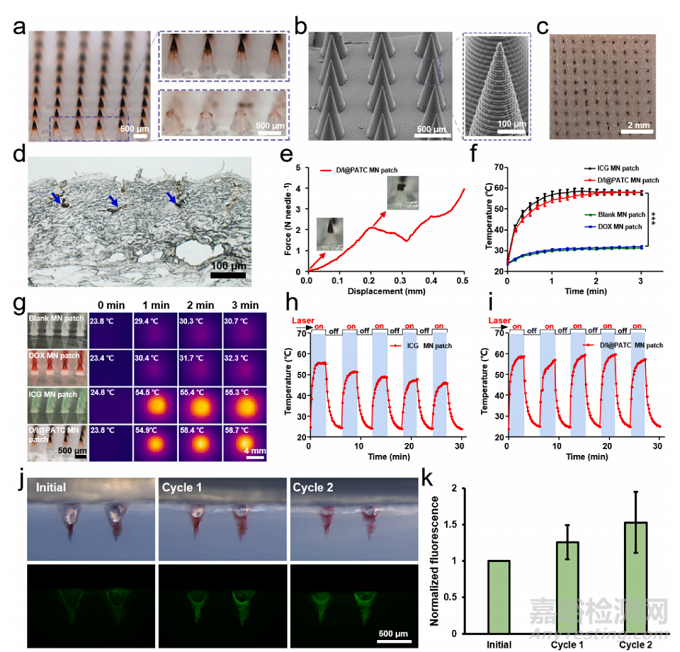
D/I@PATC微针的表征。a) D/I@PATC MN贴片插入皮肤前(右上)和后(右下)的代表性光学显微镜图像。D/I@PATC颗粒集中在MN尖端前部。b) D/I@PATC MN阵列的SEM图像。c)离体皮肤植入MN贴片后大鼠皮肤代表性明场显微镜图像。d)明场显微镜下大鼠皮肤MN贴片植入后的组织学切片代表图。蓝色箭头表示皮下递送的D/I@PATC颗粒。e) D/I@PATC MN贴片的力学行为。f) 808 nm激光照射(0.5 W/cm2)下,空白MN贴片、DOX MN贴片、ICG MN贴片和D/I@PATC MN贴片的温度变化曲线和g)对应的立体显微照片/热像图。h) ICG MN贴片和i) D/I@PATC MN贴片在5次激光“开/关”循环照射下的时间-温度曲线。j) D/I@PATC MNs插入琼脂凝胶,反复激光照射后的荧光图像。k)光照射后凝胶中D/I@PATC MNs的荧光强度变化。每个点代表平均值±SD (n = 3)。*p<0.05, **p<0.01, ***p <0.001. N.S.表示没有差异。
四、D/I@PATC MN贴片体内生物分布
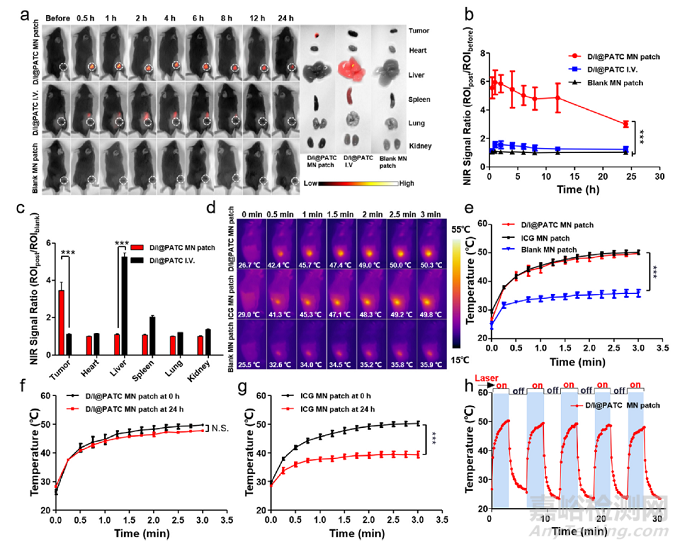
D/I@PATC MN贴片在B16-F10黑色素瘤小鼠体内的生物分布及光热效应。a)给药24 h后小鼠及主要脏器近红外(NIR)荧光图像。白色虚线表示肿瘤部位。b)肿瘤和c)小鼠给药后主要器官的近红外光信号强度。d)空白MN贴片、ICG MN贴片、D/I@PATC MN贴片在808 nm激光(0.5 W/cm2)照射下的光热图像及e)肿瘤部位相应的时间-温度曲线。808 nm激光照射肿瘤部位即刻及应用D/I@PATC MN贴片(f)或ICG MN贴片(g)后24 h的时间-温度曲线。h) 5次激光开/关循环照射下,D/I@PATC MN贴片治疗肿瘤部位的时间-温度曲线。每个点代表平均值±SD (n = 3)。*p<0.05, **p<0.01, ***p <0.001. N.S.表示没有差异。
五、D/I@PATC MN贴片体内抗黑色素瘤作用
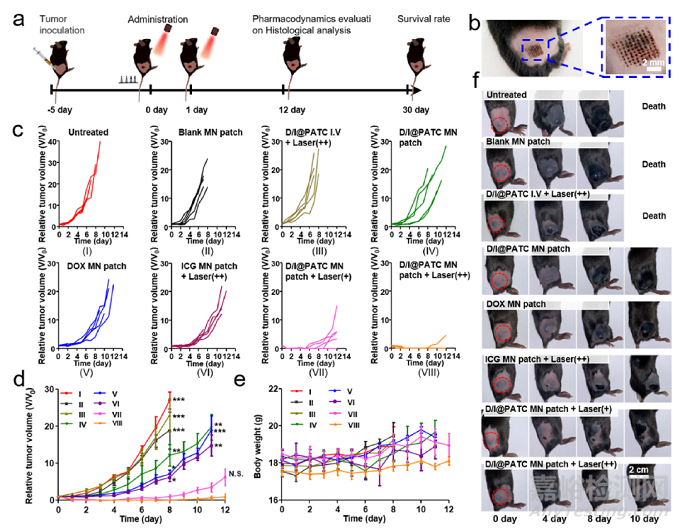
D/I@PATC MN贴片对B16-F10黑色素瘤小鼠的抗肿瘤活性。a)处理过程示意图。b)插入D/I@PATC MN贴片后C57BL/6小鼠肿瘤部位的代表性图像。c) 8个不同治疗组的个体和d)平均肿瘤生长曲线。e)不同处理后小鼠的体重曲线和f)肿瘤生长动力学照片。每个点代表平均值±SD (n = 3)。*p<0.05, **p<0.01, ***p <0.001. N.S.表示没有差异。
六、总结
本研究开发了一种自我监测的D/I@PATC MN贴片,可通过荧光变化直接监测药物释放,实现对黑色素瘤的光控化学-光热协同治疗。D/I@PATC微颗粒具有优越的AIE特性,不仅可以直接荧光观察光触发时的相变过程,而且可以通过光刺激后的荧光恢复来验证药物释放。此外,光热剂ICG包封在PATC聚合物颗粒中后,在体外和体内均表现出更强的稳定性和可靠的远程激光响应能力。在B16-F10荷瘤小鼠中,D/I@PATC MN贴片经皮肤插入后,能快速有效地将D/I@PATC颗粒递送至肿瘤部位,并表现出充分的化学光热消除肿瘤作用,且不产生任何全身毒性,具有良好的抗肿瘤功效和良好的体内生物安全性。这些结果表明,D/I@PATC MN贴片在临床治疗皮肤癌方面具有很好的潜力。
2、原文信息
Chenyuan Wang, Yongnian Zeng, Kaifeng Chen, Jiawei Lin, Qianqian Yuan, Xue Jiang, Gaosong Wu, Fubing Wang*, Yongguang Jia*, Wei Li*.
A self-monitoring microneedle patch for light-controlled synergistic treatment of melanoma.
Bioactive Materials, 27 (2023) 58-71.