您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-24 21:02
摘要 目的:鲜竹沥的法定工艺为干馏法和烧制法,而依据水提取法制备的鲜竹提取液多冒用为鲜竹沥流通市面,鲜竹沥现行的质量标准难以将二者进行区分。本研究尝试建立糖-固比的分析方法,探讨其在鉴别鲜竹沥及鲜竹提取液的应用。方法:共收集37批鲜竹沥(含干馏法20批,烧制法17批)和15批鲜竹提取液,将样品稀释,以硫酸-苯酚直接显色,或乙酸乙酯萃取后显色,于490 nm测定吸光度。参照卫生部药品标准中药材第一册“鲜竹沥”项测定总固体,计算总糖、总固体及其占比(糖-固比)。结果:干馏法鲜竹沥总糖含量为0.38~5.36 mg·mL-1,总固体0.70~13.01 mg·mL-1,糖-固比34.0%~62.2%;烧制法样品总糖含量为0.77~15.95 mg·mL-1,总固体2.34~27.97 mg·mL-1,糖-固比33.1%~69.0%;鲜竹提取液总糖含量为6.46~14.69 mg·mL-1,总固体为11.76~20.40 mg·mL-1,糖-固比38.7%~82.7%。鲜竹沥(干馏、烧制法)样品糖-固占比与鲜竹提取液差异显著(P<0.05)。结论: 本研究证明总糖测定法可用于鲜竹沥质量评价。研究首次采用糖-固占比有效甄别法定工艺(烧制、干馏法)鲜竹沥和非法定工艺(水提取法)制备的鲜竹提取液,表明糖类是鉴别鲜竹沥的潜在标志物。上述结果可为鲜竹沥炮制工艺规范和质量标准的提升提供物质基础和技术支撑。
关键词:鲜竹沥;鲜竹提取液;硫酸-苯酚法;总糖;总固体;糖-固比
Abstract Objective: The authorized methods for the preparation of Xianzhuli (XZL) is considered to be retorting and baking methods. However, the bamboo water extract (BWE) prepared by water extraction is mostly counter feited as XZL since it is difficult to distinguish both products (BWE and XZL) under current quality standard of XZL.This study attempts to establish an analytical method by using sugar-solid rate (SSR) and explore its application in the discrimination between BWE and XZL. Methods: 37 batches of XZL (including 20 batches of retorted XZL and 17 batches of bakedones) and 15 bathes of BWE were collected. All the samples was diluted with water, colored directly with sulfuric acid-phenol reagent or colored after extracted with ethyl acetate. The absorbance was measured at a wavelength of 490 nm. The total solid was determined as per drug standard of ministry of health Chinese Herbal Medicine Volume 1. The ratio of total saccharides to total solid was calculated. Results: The contents of total saccharides and total solids of XZL by retorting method were 0.38-5.36 mg·mL-1and 0.70-13.01 mg·mL-1 respectively, and the SSR were 34.0%-62.2%.The contents of total saccharides and total solids of XZL by baking method were 0.77-15.95 mg·mL-1 and 2.34-27.97 mg·mL-1 respectively,and the SSR were 33.1%-69.0%. The contents of total saccharides and total solids of BWE were 6.46-14.69 mg·mL-1 and 11.76-20.40 mg·mL-1 respectively, and the SSR were 38.7%-82.7%. The SSR of XZL by retorting and baking methods had the significant difference from that of BWE (P<0.05).Conclusion: Our investigation suggested that the UV based quantitative method for assay of total saccharides could be used in the quality control of XZL. To the best of our knowledge, this is the first paper on the application of RSS in differentiating effectively between XZL by authorized methods (retorting and baking methods) and BWE. Also,these data suggested that saccharides could be served as a potential marker for the identification of XZL, paving chemical evidence and technical support for the specification of processing method and upgradation of quality control of Xianzhuli.
Key words: Xianzhuli; bamboo water extract; sulfuricacid-phenol; total saccharides; total solids; sugar-solid rate
鲜竹沥(Xianzhuli)是禾本科植物粉绿竹Phyllostachys glauca、净竹P. nuda及同属的数种植物的鲜杆经加热后自然沥出的液体[1],宋代《本草衍义》称其为“痰家之圣剂”,治疗肺热咳嗽痰多、小儿痰热惊风等症状。临床上多用于治疗由各种肺部病变及呼吸道感染引发的咳嗽,对咽炎、呼吸道感染、支气管炎、慢性阻塞性肺疾病、中风引发的肺部病变均有显著的治疗效果[2]。鲜竹沥的临床疗效与其炮制工艺密切相关。鲜竹沥的古法制备工艺有烧制法(baking method, BM)和干馏法(retorting method, RM)。烧制法始载于唐代《备急千金要方》,主要将竹子与热源(火)直接接触获取竹沥:“取淡竹断两头节,火烧中央,器盛两头得汁”。明代《本草纲目》收录了干馏法,该法将竹子盛放于容器内,与热源(火)间接接触制备竹沥:“以住截长五六寸,以瓶盛,倒悬,下用一器承之,周围以炭火逼之,其油沥于器也”[3-4]。两种制法在各地中药饮片炮制规范中均有收录,是鲜竹沥的法定制备工艺[5-6]。实地调研发现市面多以水提取法制备的鲜竹提取液(bamboo water extract,BWE)冒用作鲜竹沥。该品种收录于《湖南省中药材标准》(2009年版)[7],而水提取法未收录于鲜竹沥相关标准,属于非法定工艺。鲜竹沥产品现行质量标准收载于《卫生部药品标准中药材》(第一册)[1],目前鲜竹沥标准项目仅性状、pH值、总固体、相对密度及薄层鉴别项[3-6],无法区分鲜竹沥与鲜竹提取液,其质量标准亟待提升。目前从鲜竹沥中发现了糖[8]、核苷[9]、木脂素[10]、酚[11]、黄酮、氨基酸[12]及寡肽[13]等类成分。其中,糖类是鲜竹沥的主要成分[14],已经鉴定出D-果糖、D-葡萄糖及蔗糖[4]。本研究在测定52批鲜竹沥(干馏法、烧制法制备)与鲜竹提取液(水提取法制备)样品总糖含量及总固体的基础上,计算样品的总糖总固体占比(糖-固比,sugar-solid rate),以此指标评价鲜竹沥与鲜竹提取液对糖的影响,为鲜竹沥炮制工艺规范和质量标准的提升提供技术支撑。
1 仪器与试药
岛津紫外分光光度计UV-2600,Sartorius BT 25S型十万分之一电子天平(北京赛多利斯天平有限公司)。37批鲜竹沥(包括20批干馏法、17批烧制法)样品均由江西仁安药业有限公司生产,15批鲜竹提取液按照《湖南省中药材标准》(2009年版)“鲜竹提取液”项下制备,所有样品均由禾本科刚竹属(Phyllostachys)毛竹(P. heterocycla (Carr.) Mitford cv. Pubescens)制备;D-无水葡萄糖对照品(批号:110833-201707,ID:JGNY-QGLJ,纯度:99.9%)购自中国食品药品检定研究院;水为超纯水,其余试剂均为分析纯。
2 方法和结果
2.1 溶液制备
2.1.1 葡萄糖对照品溶液
称取105 ℃下干燥至恒重的D-无水葡萄糖对照品适量,精密称定,用水溶解并稀释成每1 mL含100 μg的对照品液①和每1 mL含45 μg的对照品液②。
2.1.2 供试品溶液
精密吸取烧制法鲜竹沥、鲜竹提取液各2.0 mL,分别置20.0 mL容量瓶中,以水稀释至刻线,摇匀;精密吸取上述溶液1.0 mL,置不同体积容量瓶(2.0、10.0、20.0、50.0、100.0 mL)中,以水稀释至刻度线,摇匀,即得烧制法鲜竹沥、鲜竹提取液供试液。精密吸取干馏法鲜竹沥液2.0 mL,置20.0 mL量瓶中,以水稀释至刻度线,摇匀,以20.0 mL乙酸乙酯萃取4次,收集水层,或精密吸取水层1.0 mL,置10.0 mL量瓶中,以水稀释至刻度线,摇匀,即得干馏法鲜竹沥供试液。
2.2 检测波长确定
精密吸取烧制法鲜竹沥供试液(批号:20201101)和对照品液②各2.0 mL,于10.0 mL具塞试管中,依次精密加入5%苯酚溶液1.0 mL,浓硫酸5.0 mL,涡旋混匀,静置10 min后于40 ℃水浴中孵育30min,取出,冰浴至室温,于200~700 nm范围内扫描紫外吸收光谱。结果表明供试品和对照品溶液均在490 nm处有最大吸收,因此选择490 nm作为检测波长。
2.3 孵育时间考察
精密吸取2.0 mL对照品液②于10.0 mL具塞试管中,依次精密加入5%苯酚溶液1.0 mL,浓硫酸5.0 mL,涡旋混匀,静置10 min后于40 ℃水浴中分别孵育0、5、10、15、20、25、30、35、40、50、60 min,取出,冰浴至室温,于490 nm下测定各时间点吸光度值。结果表明,随着孵育时间延长,吸光度值先升高后降低,于30 min稳定,最终确定最佳孵育时间为30 min。
2.4 标准曲线绘制
精密吸取0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL的对照品液①于10.0 mL具塞试管中,加水补至2.0 mL,依次精密加入5%苯酚溶液1.0 mL,浓硫酸5.0 mL,涡旋混匀,静置10 min后于40 ℃水浴孵育30min,取出,于冰浴中冷却至室温,以水为空白对照,于490 nm下测定各管吸光度。以葡萄糖浓度为横坐标(x),吸光度为纵坐标(y)绘制标准曲线,得线性回归方程:y=0.0149x-0.029 6,r=0.999 7,线性范围为10.01~70.08 μg·mL-1。
2.5 精密度试验
精密吸取2.0 mL对照品液②,按照“2.4”项下方法连续测定6次,吸光度RSD%为0,表明仪器精密度良好。
2.6 稳定性试验
精密吸取烧制法(批号:20201101)和干馏法(批号:2021030601)鲜竹沥供试液各2.0 mL,按照“2.4”项方法分别于0、30、60、90、120、180 min测定吸光度。烧制法和干馏法供试液吸光度在0~180 min的RSD%分别为1.7%、4.1%,表明供试品在180 min内稳定。
2.7 重复性试验
精密吸取烧制法(批号:20201101)和干馏法(批号:2021030601)鲜竹沥供试液各2.0 mL × 6,按照“2.4”项方法测定吸光度,计算含量。烧制法和干馏法鲜竹沥总糖含量的RSD%分别为1.1%、2.7%,表明方法重复性良好。
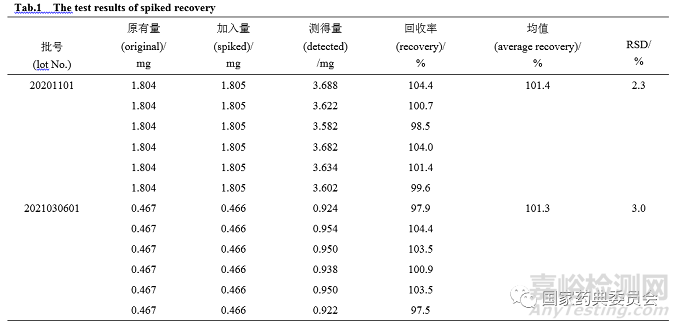
2.8 加样回收率试验
精密吸取已知含量的烧制法和干馏法鲜竹沥供试液1.0 mL×6,分别精密加入适量浓度葡萄糖对照品液1.0 mL,按照“2.1.2”项方法制备溶液,按照“2.4”项方法测定吸光度,计算含量及回收率,平均回收率为101.3%~101.4%,RSD%为2.3%~3.0%,见表1。
3 样品测定
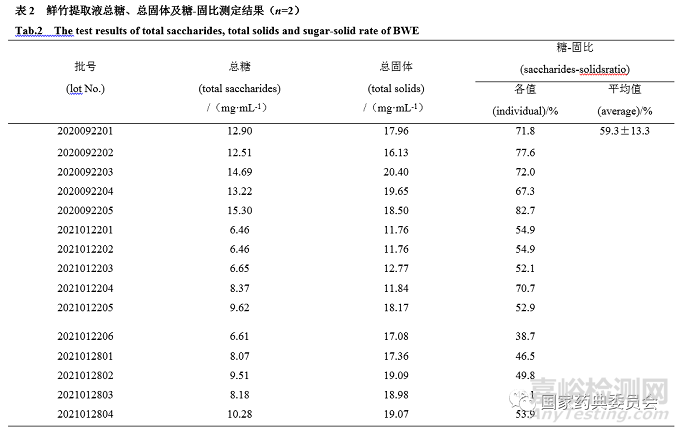
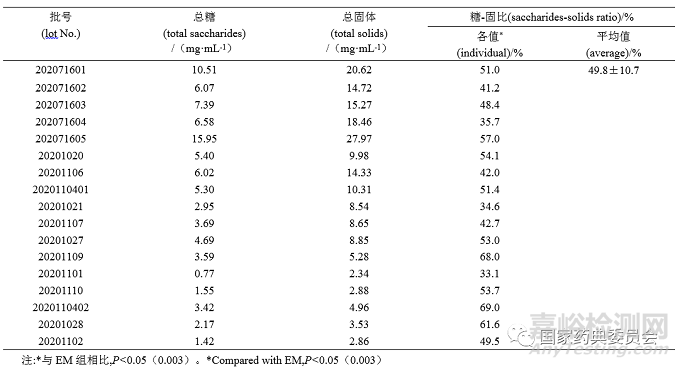
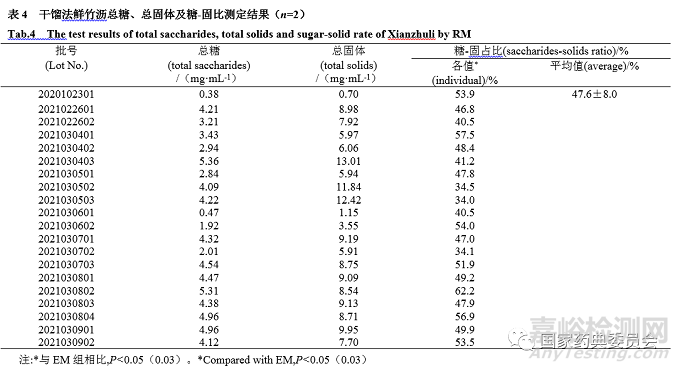
取干馏法鲜竹沥20批、烧制法17批、鲜竹提取液15批,按“2.1.2”项制备供试品溶液,按照“2.4”项方法测定总糖含量,见表2~4。由见表可知:干馏法鲜竹沥总糖含量为0.38~5.36 mg·mL-1;烧制法总糖含量为0.77~15.95 mg·mL-1;鲜竹提取液样品总糖含量为6.46~14.69 mg·mL-1。
4 总固体及糖-固比测定
参照《卫生部药品标准中药材》(1992年版)第一册“鲜竹沥”项[6],精密量取鲜竹沥液 25 mL,置干燥至恒重的蒸发皿中,蒸干,在105 ℃干燥5 h,移至干燥器中,冷却30 min,迅速称定重量,计算总固体(mg·mL-1)及糖-固比。由表2~4可知:干馏组样品总固体为0.70~13.01 mg·mL-1,糖-固占比为34.0%~62.2%;烧制组样品总固体为2.34~27.97 mg·mL-1,糖-固占比为33.1%~69.0%;鲜竹提取液样品总固体为11.76~20.40 mg·mL-1 ,糖-固占比为38.7%~82.7%。
表3 烧制法鲜竹沥总糖、总固体及糖-固比测定结果(n=2)
Tab.3 The test results of total saccharides, totalsolids and sugar-solid rate of Xianzhuli by BM
5 数据分析
采用Excel对试验数据进行分析,以单因素方差分析比较干馏、烧制组鲜竹沥的糖-固比与鲜竹提取液的差异,由表2~4可知,鲜竹提取液的糖-固比与干馏(P=0.03)、烧制组(P=0.003)鲜竹沥差异显著。
6 讨论与结论
6.1 测定方法
选择硫酸-苯酚法的原理为糖类在浓硫酸作用下迅速脱水生成糠醛或糠醛类似物,继而与苯酚缩合使溶液显色,在一定范围内溶液颜色与糖含量成正比。该法所用试剂价格低廉,且操作简便,灵敏度高,测定时不受蛋白质的干扰,因此,本研究选取该法测定鲜竹沥及鲜竹提取液总糖含量。值得注意的是,苯酚在空气中容易氧化生成醌类物质,导致波长发生偏移或吸收值不稳定,因此,在本研究中,苯酚在临用前应重蒸馏,且现配现用[14]。
6.2 供试品前处理
以HPLC-ELSD法[Shodex Asahipak NH2P-50E(4.6 mm×250 mm,5 μm)色谱柱;流动相为乙腈-水;蒸发光散射检测器:氮气量:1.5~2.5 mL·min-1;漂移管温度:40~50 ℃;柱温为30~40 ℃;流速:1.0 mL·min-1]对干馏法、烧制法鲜竹沥及鲜竹提取液的糖类成分进行了分析,结果表明葡萄糖在三种样品中均属于峰面积最高的成分,因此,本研究选择葡萄糖作为总糖测定的标准单位。干馏法样品HPLC-ELSD直接测定所得总糖含量均高于总固体,表明干馏法样品存在干扰成分。采用乙酸乙酯可将干扰成分萃出,进一步研究发现,萃取4次可将干扰成分完全去除;HPLC-ELSD分析发现,在乙酸部位中没有检出糖类,仅存在于乙酸乙酯萃取后的水液中。因此,干扰成分的去除方法定为用乙酸乙酯萃取4次。这类干扰成分可用于区分干馏法与鲜竹提取液,是干馏法样品潜在的指标成分,需进一步对其结构进行表征。
6.3 鲜竹沥及鲜竹提取液总糖
鲜竹沥的法定工艺为烧制法和干馏法,水提取法不属于法定工艺。在本研究中,烧制法与干馏法鲜竹沥总糖含量分别为0.77~15.95 mg·mL-1、0.38~5.36 mg·mL-1,与文献报道的结果(18.0~21.9 mg·mL-1)差异较大[3];此外,本研究中烧制法与干馏法总糖含量RSD%分别为72.3%、40.5%,均存在显著的批间差异,这些问题可能与样品选择或生产工艺有关。但是如果引入糖-固比计算,则烧制法与干馏法总糖含量RSD%分别下降到21.5%、16.9%,说明以此指标可以显著降低批间差异。据调研,目前国内鲜竹沥生产企业的工艺不尽相同,市售鲜竹沥多存在人为添加糖的行为,以总糖含量为指标不一定能正确解决“糖勾兑”的现象[4],引入糖-固比可能是解决这一问题的有效策略。本研究中鲜竹沥及鲜竹提取液的糖-固占比33.1%~82.7%,表明糖类是两者的主要成分,这与Gao[15]的结果一致。干馏、烧制鲜竹沥和鲜竹提取液的糖-固占比平均值分别为47.6%、49.8%和59.3%(表2~4),单因素方差分析结果表明,干馏、烧制鲜竹沥与鲜竹提取液糖-固占比存在显著差异(P<0.05)。这些结果表明采用糖-固占比可有效区分鲜竹沥与鲜竹提取液,糖类是鉴别鲜竹沥的潜在标志物。通过实地调研发现,市面上既流通着非法定工艺(水提法)制备的“鲜竹沥”(鲜竹提取液),也存在糖勾兑鲜竹沥的行为,制定合理的糖-固占比限度可有助于控制上述“乱象”。据表3和表4糖-固占比结果,建议将鲜竹沥的糖-固占比限度定为不超过50%。同时,本研究初步显示鲜竹沥中单糖含量比例(葡萄糖和果糖约1:1)与文献报道的结果基本一致[4]。因此,需进一步探索“单糖比”甄别鲜竹沥与鲜竹提取液、“糖勾兑鲜竹沥”的可行性。
6.4 结论
综上,本研究采用硫酸-苯酚法建立了鲜竹沥总糖的测定方法,测定了52批鲜竹沥和鲜竹提取液的总糖含量,表明总糖测定法可用于鲜竹沥的质量控制。首次采用糖-固占比有效甄别依据法定工艺(干馏法及烧制法)制备鲜竹沥与按照非法定工艺(水提取法)生产的鲜竹提取液,表明糖类是鉴别鲜竹沥的潜在标志物。总之,这些结果为鲜竹沥炮制工艺规范及质量标准提升提供物质基础与技术支撑。
参考文献
[1] 卫生部药品标准·中药材第一册[S]. 1992:99
Drug standards of the Ministry of Health.Chinese Herbal Medicine Volume 1[S]. 1992:99
[2] 马静,肖凡,李晓琳. 复方鲜竹沥液联合特布他林治疗儿童喘息性支气管炎的临床研究[J]. 现代药物与临床,2019,34(9):2636
MA J, XIAO F, LI XL. Clinical study on Compound Xianzhuli Solution combined with terbutaline in treatment of asthmaticbronchitis in children[J]. Drugs Clin, 2019, 34(9):2636
[3] 徐诗军,万娜,伍振峰,等. 鲜竹沥的本草考证与现代研究进展[J]. 中国实验方剂学杂志,2021,27(4):196
XU SJ, WAN N, WU ZF, et al. Herbal textual research and modern research progress of Succus Bambusae[J]. Chin J Exp Tradit Med Form, 2021, 27(4):196
[4] 赵雯,洪挺,游媛,等. HPLC-ELSD法同时测定鲜竹沥中单糖、双糖的含量[J]. 中国现代中药,2020,22(3):423
ZHAO W, HONG T, YOU Y, et al. Simultaneous quantification of monosaccharides and disaccharides in Xianzhuli by HPLC-ELSD[J]. Mod Chin Med, 2020, 22(3):423
[5] 江西省中药饮片炮制规范[S]. 2008:567
Specifications for Processing Chinese Medicine Decoction Pieces in Jiangxi Province[S]. 2008:567
[6] 湖南省中药饮片炮制规范[S]. 2010:514
Specifications for Processing Chinese Medicine Decoction Pieces in Hunan Province[S]. 2010:51
[7] 湖南省中药材标准[S]. 2009:145
Standards for Chinese Herbal Medicine in Hunan Province[S]. 2009:145
[8] HES, WANG X, ZHANG Y, et al. Isolation and prebiotic activity of water-soluble polysaccharides fractions from the bamboo shoots (Phyllostachys praecox)[J].Carbohydr Polym,2016,151:295
[9] SUN J, DING ZQ, GAO Q, et al. Major chemical constituents of bamboo shoots (Phyllostachys pubescens): qualitative and quantitative research[J]. J Agric Food Chem, 2016, 64(12):2498
[10] SUN SN, CAO XF, XU F, et al. Structural features and antioxidantactivities of lignins from steam-exploded Bamboo (Phyllostachys pubescens)[J].J Agric Food Chem, 2014, 62(25):5939
[11] YOSHIMURA M, OCHLI K, SEKIYA H, et al. Identification of characteristic phenolic constituents in mousouchiku extract used as food additives[J]. Chem Pharm Bull, 2017, 65(9):878
[12] 姚金龙,付辉政,周志强,等. 鲜竹沥乙酸乙酯部位的化学成分研究[J]. 中药材,2018,41(10):2102
YAO JL, FU HZ, ZHOU ZQ, et al. Chemical constituents of ethyl acetate-soluble from Xianzhuli[J]. J Chin Med Mater,2018, 41(10):2102
[13] FUJIMURA M, IDEGUCHI M, MINAMI Y, et al. Amino acid sequence and antimicrobial activity of chitin-binding peptides, Pp-AMP 1 and Pp-AMP 2, from Japanese bamboo shoots (Phyllostachys pubescens)[J]. Biosci Biotechol Biochem,2005, 69(3):642
[14] GUO JL, CHEN YJ, SUN GQ, et al. Study on phenol-sulfuric acid method for determination of polysaccharide content in Pleurotus eryngii[J]. Food Sci,2008, 12:131
[15] GAO Q,WANG D,SHAO S, et al. Identification and quantitation of the actual active components in bamboo juice and its oral liquid by NMR and UPLC-Q-TOF-MS[J]. Sci Rep, 2020, 10:19664
陈承瑜1,2, 杨东生1,2, 谢静1,4, 付辉政3, 洪挺3, 高进1,4, 周毅生4, 曹晖1**
(1. 暨南大学药学院, 广州 510632; 2. 粤澳中医药科技产业园开发有限公司, 广东珠海 519000;
3. 江西省药品检验检测研究院, 国家药品监督管理局中成药质量评价重点实验室,
江西省药品与医疗器械质量工程技术研究中心, 南昌 330029;
4. 盈科瑞(横琴)药物研究院有限公司, 广东珠海 519000)

来源:《中国药品标准》2021年


