您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-21 21:53
[摘要] 治疗性单克隆抗体( 单抗) 类药物是高度均一的生物大分子,抗原表位、理化性质和生物活性等方面的均一性程度高,能够通过特异性地与靶标分子结合发挥治疗作用。单抗类药物治疗过程中不良反应发生率低、患者耐受性高。单抗类药物是生物药物领域的热点和焦点,已成为现代生物制药行业中占比最大、增长最快的细分领域。根据生产技术和工艺的不同,单抗类药物发展已经经历了4 代。我国最近批准上市的信迪利单抗注射液、特瑞普利单抗注射液、注射用卡瑞利珠单抗和替雷利珠单抗注射液等均属于第3 代人源化单克隆抗体药物。单抗类药物分子结构复杂,容易发生二聚体、多聚体、末端氨基酸突变等不均一性变化,严重影响临床用药的安全性和有效性。对单抗类药物的原液和成品进行有效的质量控制是确保该类产品安全性和有效性的重要措施。目前,单抗类产品质量控制与分析的主要方法包括高效液相色谱( HPLC) 法、酶联免疫吸附测定( ELISA) 法、毛细管区带电泳( CZE) 法、毛细管等电聚焦电泳( cIEF) 法、成像毛细管等电聚焦电泳( iCIEF) 法和十二烷基硫酸钠-毛细管电泳( CE-SDS) 法等。本文就单抗类药物质量控制分析方法及应用进行综述,为相关研究及产品质量控制提供参考。
传统的抗肿瘤化疗药物通过干扰肿瘤细胞有丝分裂、阻止DNA 复制和损伤DNA 分子发挥抗肿瘤作用。化疗药物不良反应多、选择性差的特点决定了其临床应用受到较大限制。单克隆抗体( 单抗)类药物是经过分子生物学手段制备的、由单一B 细胞克隆得到的高度均一的生物大分子[1-2]。单抗类药物抗原表位、理化性质和生物活性等方面的均一性程度高,能够特异性与靶标分子结合,治疗过程中不良反应发生率低、患者的耐受性高[3-4]。从1986年全球第一个鼠源性单抗药物Muromonab OKT3 上市以来,单抗类药物经历了人鼠嵌合单抗( 第2代) 、人源化单抗( 第3 代) 的进步,已发展至如今的第4 代的全人源化产品。
治疗性单抗类药物属于结构复杂的生物大分子,经过细胞培养、分离纯化和运输保存等过程,容易发生不均一性变化,如形成二聚体和多聚体、发生末端氨基酸突变、脱酰胺化和糖链变化等结构的变异[5]。这些变异和不均一性将严重影响单抗类抗肿瘤药物的临床效果和安全性。随着生产工艺的不断优化和分析技术的进步,单克隆抗体药物的质量控制将日趋规范和严格,各国药品监督管理部门也在不断提升该类产品的质量控制要求。有效的质量控制分析方法是进行原液和成品质量控制、确保单抗类产品安全性和有效性的基础。目前,单抗类产品质量控制与分析的主要方法包括高效液相色谱( high performance liquid chromatography,HPLC) 法、酶联免疫吸附测定( enzyme linked immune-sorbent assay,ELISA) 法、毛细管区带电泳( capillary zone electrophoresis,CZE) 法、毛细管等电聚焦电泳( capillary iso-electric focusing,cIEF) 法、成像毛细管等电聚焦电泳( imaging CIEF, iCIEF) 法和十二烷基硫酸钠-毛细管电泳( capillary electrophoresis-sodium dodecyl sulfate,CE-SDS) 法等。本文分析单抗类产品分析技术与应用进展,为单抗类药物原液和成品的质量控制提供参考。
1 单抗类抗药物
单抗类药物是生物药物领域的热点和研发的焦点,是现代生物制药行业中占比最大、增长最快的细分领域。根据生产技术和工艺的不同,单抗类药物发展经历了4 代。第1 代为鼠源单抗,通过小鼠细胞生产抗体,产品的不良反应发生率高( 50% ~80%) ; 第2 代为人鼠嵌合单抗,使用人源C 区替代鼠源C 区,临床应用的不良反应发生率相对较低( 1% ~ 57%) ; 第3 代为人源化单抗,采用互补决定区( complementary determining region,CDR) 移植体和特异性决定残基( specificity-deter mining residue,SDR) 移植体生产,临床应用的不良反应发生率低( < 10%) ; 第4 代为全人源化单抗,采用基于噬菌体展示技术的全人单抗技术平台生产,不良反应发生率极低[6]。
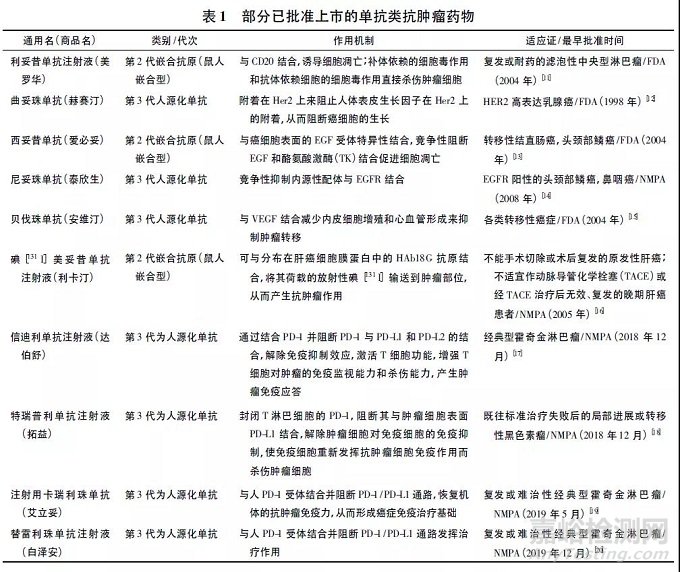
单抗类抗肿瘤药物是单抗类药物家族的重要成员,因其具有较高的特异性和较低的不良反应发生率以及患者的耐受性好而得到广泛应用[7-8]。近年来美国FDA 和国家药品监督管理局( NMPA) 均批准了一系列用于治疗恶性肿瘤的单抗类药物,如曲妥珠单抗( 赫赛汀) 、利妥昔单抗注射液( 美罗华)等,见表1。值得指出的是,NMPA 近2 年新批准了一系列的单抗类抗肿瘤药物,包括信迪利单抗注射液( 2018 年12 月获批) 、特瑞普利单抗注射液( 2018年12 月获批) 、注射用卡瑞利珠单抗( 2019 年5 月获批) 和替雷利珠单抗注射液( 2019 年12 月获批)等,标志着抗肿瘤免疫治疗进入了“中国创新时代”[9-10],见表1。
2 单抗类药物的质量控制参数
单抗类抗肿瘤药物分子结构复杂,容易发生二聚体和多聚体、末端氨基酸突变等不均一性变化,严重影响临床用药的安全性和有效性。对抗肿瘤类单抗产品的原液和成品进行有效质量控制是确保该类产品安全性和有效性的重要措施。以我国最近批准的PD-1 /PD-L1 抑制剂类单抗为例,原液的质量控制参数主要包括鉴别( 等电点、肽图谱) 、理化检定( 外观、pH、渗透压摩尔浓度) 、纯度( 单体含量、重链、非糖基化重链和轻链等) 、杂质( 蛋白质A 残留量、宿主细胞DNA 残留量、宿主细胞蛋白残留量) 、生物学活性( 或效价) 、蛋白质含量、细菌内毒素和微生物限度、糖基化分析、聚山梨酯20 等。PD-1 /PD-L1 抑制剂类单抗成品的质量控制的参数包括鉴别( 等电点、肽图谱) 、理化检定( 外观、可见异物、不溶性微粒、装量、pH、渗透压摩尔浓度、复溶时间、水分) 、纯度( 单体含量、重链、非糖基化重链和轻链等) 、生物学活性( 或效价) 、结合活性、蛋白质含量、无菌和细菌内毒素、异常毒性、聚山梨酯20、聚山梨酯80 含量、甘露醇含量等。
3 单抗类抗肿瘤药物参数分析的主要技术
单抗类抗肿瘤产品参数分析的主要技术包括HPLC 法、ELISA 法、CZE 法、cIEF 法、CE-SDS 法等。
3.1 HPLC 法
用于单抗类抗肿瘤产品的分析的HPLC 方法主要有反向-超高效液相色谱法( reverse phage-ultra high performance liquid chromatography,RP-UHPLC) 、体积排阻色谱( size exclusion high performance liquid chromatography,SEC-HPLC) 、阳离子交换高效液相色谱( cation exchange high performance liquid chromatography,CEX-HPLC) 、离子交换高效液相色谱( ion exchange-high performance liquid chromatography,IEC-HPLC) 和荧光检测器-高效液相色谱仪( fluorescence detector HPLC,FLD-HPLC) 等[21-24]。
肽图谱分析是通过蛋白酶或其他化学物质对蛋白质进行裂解后采用适宜的方法对蛋白质的一级结构的完整性和准确性进行鉴别的手段。胰蛋白酶水解联合RP-HPLC 或RP-UHPLC 是《中华人民共和国药典》收载的用于生物制品肽图检查的方法之一,也是抗肿瘤类单抗鉴别的重要参数。另外,高效液相色谱-质谱联用技术鉴定蛋白质一级结构准确度高,也用于分析单抗类产品的肽图。SEC-HPLC法是分析单抗分子大小异质性的主要手段,能够全面反映单体、单抗聚体和残体等的信息,是单抗类产品纯度和杂质质量控制的重要方法。IEC-HPLC 可用于分析单克隆抗体抗肿瘤药物中不同电荷异构体的比例,与cIEF 手段结合可有效分析单抗类抗肿瘤药物的酸性峰、碱性峰和主峰。CEX-HPLC 属于离子交换色谱范畴,主要用来分析等电点为弱碱性单抗药物的电荷异质性。有研究发现,CEX-HPLC 可以有效分离重组人源化抗白细胞分化抗原52( cluster of differentiation 52,CD52) 单克隆抗体的酸性、中性及碱性电荷变异体,且专属性、线性、准确性、精密度和耐用性良好[25]。将人乳头瘤病毒( human papilloma virus,HPV) 18 型L1 抗原用胰蛋白酶水解后的肽段用反向液相色谱( RP-HPLC) 法分离得到抗原肽图,并采用HPLC-MS /MS 肽图特征峰分析可对不同企业生产的18 型的HPV L1 抗原进行鉴别与质量控制[26]。郭莎等[27]通过采用SEC-HPLC 可有效分析单体的峰面积,采用IEC-HPLC 可有效检测酸性区峰面积、主峰峰面积、碱性区峰面积,并以此建立了抗PD-L1 单抗的多种质控方法。在建立抗白细胞分化抗原38( cluster of differentiation 38,CD38)单克隆抗体关键质量属性质控方法时也证实SECHPLC 分析可用于CD38 纯度控制[28]。采用HPLC-肽图法对抗人CD52 单抗的专属性鉴别时也证实辅料制剂和异种抗体对CD52 单抗的检测结果无干扰,且HPLC-肽图适于CD52 单克隆抗体的专属性鉴别、质量控制和产品批放行[29]。同时,在建立PD-1 单克隆抗体关键质量指标质控方法时也发现SEC-HPLC 法、RP-HPLC 法及CEX-HPLC 法可进行PD-1 单克隆抗体单体的纯度、单体和聚合体含量、电荷变异体分析,这些方法是PD-1 单克隆抗体制品常规质量控制的有效方法[30]。
3. 2 ELISA法
ELISA 法是继免疫荧光和放射免疫技术之后出现的免疫酶技术,通过将可溶性的抗体或抗原分子结合到固相载体上,然后利用抗原-抗体特异性结合特性的免疫反应进行定性或定量的分析方法[31-32]。在抗肿瘤类单抗药物质量控制过程中,ELISA 法可用于分析蛋白A 残留、宿主细胞蛋白残留,细胞竞争性或配体竞争性ELISA 法可用于单抗类药物生物学活性的分析。采用竞争抑制ELISA法发现抗血管内皮生长因子165 ( VEGF165) 单抗VG2 抑制VEGF 与受体结合,提示VG2 单抗能够抑制VEGF 引起的人脐静脉内皮细胞( HUVEC) 的增殖,即竞争抑制ELISA 方法可作为VG2 单抗生物学活性质量评价的手段[33]。宋媛媛等[34]成功建立了基于ELISA 法进行人血清中重组人鼠嵌合型抗CD20 单克隆抗体注射液( SCT400) 和利妥昔单抗免疫原性分析和药物浓度检测方法,并成功运用于临床试验样本的免疫原性检测。另外,采用ELISA 定量检测方法分析抗CD52 单克隆抗体中残留蛋白A的定量限为0.16 ng·mL-1,蛋白A 的加标回收率均处于80%~120%,即ELISA 定量检测方法检测抗CD52 单抗中蛋白A 残留量的专属性、准确度、精密度和线性均良好[35]。但ELISA 法用于单抗类抗肿瘤药物质量分析时也存在一定的局限性,如需经过孵育和洗涤等多步操作、容易受到外源或内源性物质的干扰,检测依赖高亲和力和高特异性的高品质单克隆抗体试剂等。已有的证据显示不同的单抗类药物与脱落的蛋白A 的结合程度不同[36],需要根据不同单抗产品特性进行相关的研究,建立适合于特定单克隆抗体的蛋白A 残留ELISA 检测方法。
3.3 CE-SDS 法
十二烷基硫酸钠( SDS) 是阴离子表面活性剂,可以断裂蛋白分子分子内和分子间的氢键、破坏其二级结构和三级结构使其伸展。虽与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳( SDSPAGE)法的电泳原理相同,CE-SDS 是液态胶在毛细管中按照分离量的大小进行蛋白的分离,自动化程度高,分离效率和重复性均优于SDS-PAGE[37]。在单抗类产品质量控制领域,CE-SDS 法已经基本取代了SDS-PAGE 法。《中华人民共和国药典》也将CESDS法作为单抗药物分子大小变异体的分析手段。根据样品处理过程中使用N-乙基顺丁烯二酰亚胺( NEM) 或β 巯基乙醇的不同,CE-SDS 法区分为非还原CE-SDS 法和还原CE-SDS 法( 使用β 巯基乙醇、二硫苏糖醇等还原剂进行样品处理) 。通过CESDS法分析可将目标成分和杂质有效分离,且能区分多批重组人源化PD-1 单抗产品间的细小差异,即CE-SDS 法适用于PD-1 单抗产品纯度和相关杂质的质控分析[30]。在应用CE-SDS 法分析抗CD52 单抗参比品单体纯度和非糖化重链比例时发现非还原CE-SDS 法测定单体纯度为93. 57%,还原CE-SDS法电泳重链修正峰面积为66.89%,CE-SDS 法测定抗CD52 单抗纯度及非糖化重链比例偏差小,结果准确可靠[38]。郭莎等[27]在对抗PD-L1 单抗的质量控制进行分析时证实还原CE-SDS 法的轻链与重链峰面积之和为( 98.37 ± 0. 21) %,非还原CE-SDS 法主峰峰面积为( 96.33 ± 0.15) %,CE-SDS 法可用于抗PD-L1 单抗纯度的质量控制。在采用CE-SDS 法分析HER2 单抗质量时也发现非还原CE-SDS 法检测的酸性异构体、预洗脱杂质、原液的主峰含量为90.83%,53.93%, 95.83%,小分子杂质含量分别为9.17%, 46.07%,4.17%,还原CE-SDS 法检测的酸性异构体、预洗脱杂质、原液的轻、重链百分含量分别为96.80%,78.00%, 98.85%,即CE-SDS 法可用于HER2 单抗的纯度分析[20]。非糖基化重链是抗体药物质量控制的关键参数,对抗体药物的体内外稳定性、半衰期等生物学活性起关键的作用,而CESDS法是目前唯一能够将抗体非糖基化重链与重链进行分离和进行准确定量的技术[39]。目前采用CE-SDS 法分析单抗药物纯度时采用的检测手段主要为紫外检测( UV 和PDA) 和激光诱导的荧光检测。与前者相比,激光诱导的荧光检测灵敏度高,可对痕量的蛋白质进行分析,而紫外检测器可消除背景胶中紫外吸收引起的基线波动,自动积分更准确[40-41]。为保证CE-SDS 法可靠稳定,研究人员采用了在毛细管两端增加相同的电压、反吸法移取凝胶溶液等手段提高CE-SDS 法的稳定性,并采用多通道毛细管电泳分析抗体药物纯度以提高检测的通量[42-43]。
3.4 cIEF 法与iCIEF法
cIEF 和iCIEF 均属于毛细管电泳的范畴,在基于电荷的分离技术中其分辨率是最高的[44 - 45]。根据待分离物质等电点的不同,将其在pH 梯度内将酸碱两性物进行电泳分离,并最终在与物质等电点相等pH 值的位置聚集成条带。单抗类产品生产过程中涉及糖基化、末端氨基酸改变、异构化、聚合、分裂等翻译后修饰,而这些修饰均会引起单抗表面电荷的改变,包括直接改变电荷的数目和间接引起构象的改变,即单抗类抗肿瘤药物的电荷异质性。在单抗类抗肿瘤产品质量控制过程中,cIEF 法和iCIEF`法主要用于分析产品的等电点和电荷异质性[46 -47]。在对重组抗肿瘤坏死因子α ( TNF-α) 全人源单抗分析时发现cIEF 法和iCIEF 法可用于主峰与酸性峰的比例分析,但二者检测抗体主峰等电点具有差异性,提示在实际应用时应结合单抗药物的特性和表征选择合适的电荷异质性分析方法[48]。刘振东等[49]建立了iCIEF 分析血管内皮生长因子受体-抗体Fc 融合蛋白的电荷异质性,发现iCIEF 法分离效果明显好于cIEF 和IEF,即iCIEF 法用于重组蛋白类药物电荷异质性及等电点快速、准确、重复性好,能够较好地检测高度糖基化的重组血管内皮生长因子受体-抗体Fc 融合蛋白产品的电荷异质性,保障了Fc-融合蛋白类产品生产工艺的稳定性,为该产品质量控制提供了快速、可靠的分析方法。在评价全柱成像毛细管电泳( capillary isoelectric focusing-whole column imaging detection,cIEF-WCID) 检测多肽类药物等电点的效果时,证实该方法可快速、准确地分析具有电荷异质性的多肽类产品的等电点,且能够跟踪聚焦过程中样本的迁移特征,对复杂电荷异质性蛋白类药物检测具有较好的分辨率和重复性[50]。美国药典36 版也收录了cIEF 作为单抗类药物曲妥珠单抗和利妥昔单抗的电荷异质性分析方法。除了单克隆抗体外,cIEF 也可以对抗体偶联药物( antibody-drug conjugate,ADC) 进行电荷异质性的分析[51-52]。
3.5 毛细管凝胶电泳( capillary gel electrophoresis,CGE) 法
在毛细管电泳的多种分离模式中,CEZ法分析主要依靠分子量大小进行分离,cIEF 分析依靠单抗的等电点进行分离,而CEZ 法是依靠单抗类药物电荷/质量比进行分析,是最简单、最常用的毛细管电泳类型。由于单抗类药物各个变异体之间的质量差别不大,主要变异来自氨基酸的翻译后修饰,具体体现在表面电荷的不同。CEZ 法的分离模式与cIEF 法相似,但前者比后者更简单、更便捷。CEZ法与质谱联用后可以依靠后者对毛细管电泳分离的电荷变异体进行结构分析。在对IgG2 型单抗电荷异质性进行毛细管区带电泳分析时证实CZE 法可以有效分离IgG2 单抗电荷异构体,精密度良好,峰面积RSD < 3. 0%,提示CZE 法可以对该类单克隆抗体的电荷异构体有效分离[53]。在对常用的单克隆抗体电荷异质性分析时证实IEC 法和CZE 法在检测的电荷异构体峰面积时结论基本一致,但二者与CIEF 法和iCIEF 法检测的抗体主峰等电点存在一定差异[38]。虽然CEZ 法操作简单便捷,但单抗类药物的多样性决定了没有任何一个分离条件能对所有的药物实现最佳的分离效果。在采用CZE 法分析单抗类药物的电荷异质性时,应综合考虑pH值、三乙烯四胺( TETA) 浓度、羟丙基甲基纤维素( HPMC) 或羟丙基纤维素( HPC) 等聚合物添加剂等因素。
3.6 定量聚合酶链式反应( polymerase chain reaction,PCR) 法及其他
外源性DNA 是通过病毒感染或基因工程等途径引入靶细胞的其他物种或细胞的DNA 序列,是单抗类等生物制品质量控制的关键项目[54-55]。现行有效的国际主流药典都对生物制品中外源DNA 残留做了明确的限度规定。定量PCR 法、阈值法、荧光染料法及分子杂交等都是分析外源性DNA 的常用手段,其中定量PCR 法是目前批准的抗肿瘤类单克隆抗体产品中外源性DNA检测的通用方法。最近新上市的信迪利单抗注射液、注射用卡瑞丽珠单抗及特瑞普利单抗注射液等均是来自中国仓鼠卵巢细胞( CHO) ,经细胞培养、分离和纯化后获得的重组单克隆抗体。目前这类抗肿瘤单抗的质量控制标准中均是采用定量PCR 法对相应的外源性DNA 进行分析。
单抗类抗肿瘤产品的原液通常是采用常规法或薄膜过滤法进行微生物限度检查,产品的无菌检查均采用薄膜过滤法进行; 蛋白质含量的检测采用紫外分光光度法进行; 细菌内毒素检测采用凝胶法进行。支原检查可采用PCR 法进行初筛和产品放行,但结果存在争议时要以培养法结果为仲裁标准。其他的分析项目,如外观、性状、可见异物、摩尔渗透压、pH 值、装量和不溶性微粒及异常毒性等均采用常规法。
4 问题与展望
单抗类药物已成为制药领域研究的热点和焦点。在全球生物制药领域中,单抗类药物占据了50%左右的份额。单抗类抗肿瘤药物是单抗类药物的重要组分,且随着信迪利单抗注射液、特瑞普利单抗注射液、注射用卡瑞利珠单抗和替雷利珠单抗注射液等一系列抗肿瘤单抗的获批,抗肿瘤免疫治疗进入了“中国创新时代”。单抗类抗肿瘤药物为结构复杂的生物大分子,经翻译后修饰容易发生二聚体、多聚体、末端氨基酸突变、糖基化等不均一的变化,严重影响临床用药的安全性和有效性。为确保抗肿瘤类单抗产品安全性和有效性,需对原液和成品进行有效的质量控制。目前单抗类产品质量控制与分析的主要方法包括HPLC 法、ELISA 法、CZE法、cIEF 法、iCIEF 法和CE-SDS 法等。本文对上述的常用分析方法及应用进行了综述,可为相关研究及产品质量控制提供参考。但应当指出的是由于单抗类抗肿瘤药物的迅猛发展,不同的单抗产品质量控制所采用的方法可能与药物的一级结构、二级结构、电荷属性等因素有关。因此,为确保所采用的方法适合于特定的产品,需对产品的理化特性进行分析研究,建立适合于特定单克隆抗体的分析方法。

来源:Internet


