您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-10-24 17:46
2018新版本从各个章节对2009版本进行了全面的修订。笔者力图详尽比较新旧版ISO 10993-1的差异,对重要内容进行解读,以期为读者提供参考信息,以便正确理解和使用新标准。
ISO 10993-1:2018 新版本解读
(一)前言
标准在前言中简要阐明了本版的主要变化为:
(1)修订附录A“生物风险评估中要解决的终点”,新增了"物理化学信息"、“材料热原”、“慢性毒性”、“致癌性”、“生殖和发育毒性”和“降解”的选项栏,矩阵中“物理化学信息”用“X”标识,为必做项目;其他项目用“E”标识,作为测试终点需要考虑的项目;
(2)附录B“风险管理过程指南”用 “基于风险管理过程的生物学评价指南”取代(原ISO TR 15499);
(3)增加ISO 10993系列标准中通用的名词术语;
(4)增加“非接触医疗器械”和“短暂接触医疗器械”评价信息;
(5)增加纳米材料和可吸收材料评价信息;
(6)增加参考文献ISO 18562(全系列标准)“医疗应用中呼吸气路生物相容性评价”;
(二)引言
引言部分的措辞更加科学严谨。其中,使用“生物反应”或“生物相容性”取代“组织相互作用”,作为选择材料的重要表征手段。在利用现有科学知识减少动物使用方面,在原来体外模型和化学手段的基础上、增加了材料的物理、形态学和地形学表征的应用,使体外试验的技术更加全面。另外,将引言中所有的“数据组”由“终点”代替,使生物学评价更加科学严谨,完整全面。
(三)范围
本部分主要新增内容为:
(1)该标准的使用范围更加明确,主要用来评价以下情况的医疗器械及材料:
——正常使用过程中,直接或间接接触病人的身体;
——如果用作保护(例如外科手套、面罩和其他),直接或间接接触使用者的身体;
(2)标准明确提供评价指南,关注以下方面引起的生物危害:
——作为生物安全整体性评估的一部分,随时间推移医疗器械发生变化产生的风险;
——医疗器械或组件的破损,使身体组织暴露于新材料时发生的风险。
(3)明确指出该文件不包括与细菌、霉菌、酵母菌、病毒、传染性海绵状脑病(TSE)和其他病原体有关的危害。
(四)术语和定义
该部分变化很大,将原有的5个术语和定义进行了更新,并新增21个,具体变化为:
(1)“医疗器械”定义,原有的5个备注缩减至1个,将以前的备注5“医疗器械可包括牙科器械”更新到正文中,明确“医疗器械包括牙科器械”;同时,在有些国家或地区属于医疗器械的列举中新增“用于体外受精或辅助生殖技术的器械”。
(2)“材料”定义中,原"无活性物质"使用“复合材料(composite)”代替。
(3)“最终产品”,原定义为“由制造商技术规范或标签中定义的处于可使用状态的医疗器械”,该定义强调“使用”状态,不包含医疗器械组件;新定义强调“上市销售(to be marketed)”状态,特指经历过所有生产过程,处于“上市销售”状态的医疗器械或部件,包括包装和灭菌(如果适用)。
(4)“化学成分”定义中增加“基材(base material)”,原"着色剂(dyestuff)"由"颜色添加剂(color additives)”和”染料(dyes)"代替。
(5)“数据组”定义中明确列举物理化学表征、毒理数据,作为生物反应表征信息来源。
另外新增的术语分别为:生物相容性、生物风险、生物安全、直接接触、外部循环器械、器械几何配置、植入物、间接接触、材料表征、纳米材料、非接触、物理和化学信息、风险分析、风险评估、风险评价、风险管理、毒性、毒理学危害、毒理学风险、毒理学阈值、短暂接触。总体而言,新增术语和定义主要内容为:
一是依据ISO 14971和ISO TR 15499的要求增加生物风险和生物评价术语;
二是定义了器械接触类型,其中“外部接入医疗器械”中明确:直接或间接接触体内组织/体液,部分或整体位于体外的医疗器械或组件,均为外部循环器械,例如导尿管等。
三是首次引入“非接触”和“短暂接触”的术语定义,并在5.3.2章节对短暂接触医疗器械作了具体的描述,列举了柳叶刀,皮下注射针,毛细管等接触时间小于一分钟的器械;
(五)生物学评价基本原则
1、新标准4.1 将“作为风险管理一部分的生物学评价系统方法流程图”进行了更新,将原版第一个方框中的“获得材料识别信息,要考虑化学表征”改为“获得物理/化学信息,考虑材料表征”;将原版第三个菱形框后移,并将其中的“化学成分是否相同”改为“几何和物理性质是否相同”(见图 1)。此修订意味着,产品的物理/化学特性已成为生物学评价的基本内容。同时,新版标准强调: 如果材料表征证明目标产品与已评价过确认安全的医疗器械和材料等同(具体参照ISO 10993-18和ISO 10993-19),且有足够的信息对材料/医疗器械进行风险评估时,通常没有必要进行测试。
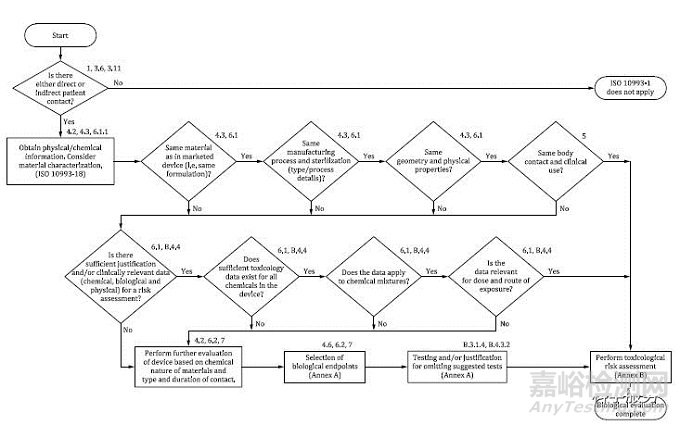
图 1 作为风险管理一部分的生物学评价系统方法流程图
(摘自 ISO 10993-1:2018 Figure 1 )
2、新标准4.3章节整体生物学评价的相关性,新增加了对于包装材料的考虑因素。直接或间接接触医疗设备的包装材料可以将化学物质转移到医疗器械上,然后间接地影响病人或医生,例如包装上的标签和油墨等。根据新版标准要求,需要考虑包装材料在货架期内,是否会影响医疗器械的安全性。对于纳米材料医疗器械,例如含有涂层的介入类器械,由于具有潜在的独特特性,因此需要按照ISO/TR 10993-22:2017《纳米材料指南》进行研究和生物学评价。新标准明确强调:医疗器械风险评估应同时考虑局部和系统的影响。
3、新标准4.7章节是新增条款----生产商对医疗器械的生物安全评价应覆盖医疗器械全生命周期。 此规定引入了全生命周期的生物学评价,即除了研发阶段的生物相容性检验,临床试验直至产品退市阶段产生的所有数据,都将成为生物学评价报告更新的必要输入。
4、新标准4.8章节是新增条款----对于可重复使用医疗器械,制造商应对确认过最大使用次数进行生物安全评价,这也是风险分析和管理的正确应用。
5、新标准4.11章节是新增条款,对该标准中的基本原则进行了标准符合性说明:
1)已经按照老版本生物评价结束的医疗器械,该标准不强制重新测试;
2)按照新版标准,任何生物相容性检验项目的豁免都需要提供合理解释,证明符合新标准要求;
3)以往的临床安全资料,可作为在售医疗器械额外试验豁免的依据;
4)任何医疗器械涉及4.9条款中描述的变更发生,必须按照新版标准进行生物风险再评价。
(六)医疗器械分类
1、在5.1的原则中添加了2项举例说明:对于仅在外科手术过程中使用,包括植入物和输送系统的的医疗器械,植入物应该与输送系统分开评估。另外明确了间接接触的气路类医疗器械,其分类和生物学评价参照 ISO 18562 系列标准进行。
2、新版标准5.2.1章节新增了非接触类医疗器械,明确非接触类医疗器械不需要进行生物相容性检验,比如医学诊断软件、体外诊断设备以及采血管等。
3、新版标准5.2.2章节表面接触医疗器械类别中,新增了备注解释,明确采用常规原材料的皮肤接触器械,无需更多的生物学评价。例如人机接触的电子设备(键盘、按钮、触摸屏、SD 卡、U 盘等)和与任何完整的皮肤接触的电子监视器或程序板(如手机、平板电脑等电子设备)或者与保护手套接触的器械(如导管的手柄)等。
4、新版标准5.2.3章节中“与组织/骨/牙本质接触的外部接入医疗器械”,新增一类虽不与组织/骨接触,但用于向组织或骨输送液体的导管类器械,也划分为外部接入器械,如灌注导管、导尿管等。
5、新版标准5.2.4 “植入医疗器械” 章节中“与血液接触植入器械”,将前版“主要与血液接触的器械”范围更新为“主要与心血管系统中循环血液接触的器械”,使之更加科学准确。 同时增加备注:虽然很多组织含有循环血液,但这个分类并不包含植入此类组织的器械,例如疝气修补植入物。
6、新版标准5.3 “接触时间分类” 章节中,首先将前版的 “永久接触(permanent)”替换成“长期接触(long-term)”,使表述更加严谨。因为有些长期植入类器械,由于某些原因只能维持几年就需要重新更换,并不能算作永久植入,例如心脏起搏器或冠脉支架等。 其次新增了短暂接触医疗器械的分类,即规定接触时间小于 1 分钟的器械。短暂接触医疗器械通常不需要进行生物相容性检验,也未列入附录 A,但此类器械若涉及累积使用,则需要另外评价。
(七)生物学评价过程
生物学评价过程作为ISO 10993-1中最重要部分,新版在章节名称、编排和内容上作出了重大修订和变更,主要解读如下:
1、新版6.1 “用于生物风险分析的物理化学信息”替换前版的 “材料表征”,材料表征也由“化学表征”修订成“物理/化学表征”,并且强调在生物学评价和材料表征之前,必须收集器械/组件的物理和化学信息。此类信息的获取是生物学评价的第一步,并为材料表征和数据组提供产品信息依据。在更多表征和额外数据组豁免方面,新标准更加谨慎,除了前版要求“所有材料、化学物质和工艺的结合在预期应用中使用安全”外,增加了“物理性质没有改变”才有可能豁免,并且需要文档记录豁免理由,以便追溯。对于磨损可能产生微粒的器械/组件,必须按照ISO/TR 10993-22:2017《纳米材料指南》进行纳米微粒的研究。
2、 新版6.2 “差距分析和生物学评估终点的选择”为新增条款,是将原标准6.1和6.2.1的条款进行了重新编排和修订。该条款规定了差距分析的实施流程,应参考4.3章节、附录 A和附录C进行判定。 基于差距分析的结果,判定存在的潜在风险,以决定需要选择的生物相容性检验项目(生物学终点)和其它数据组(包含可提取物和浸出物研究的材料物理/化学表征)。此条款最重要的是附录A的修订,现解读如下:
A、 使用“生物风险评估中需要考虑的终点”题目取代旧版的“生物评价试验”,更强调优先根据现有的信息资料进行评估,而不是盲目进行试验。新版评估表中新增6个评估考察项目:物理/化学信息、材料性热原、慢性毒性、致癌性、生殖/发育毒性和可降解试验(见表1)。
B、 新版评估表使用符号“ E”(Endpoint的首字母) 取代旧版的 “ X ”,以标识生物风险评估的试验终点;
C、新版评估表使用“X”表示生物学风险评估需要的前置信息,如物理/化学信息;
D、新版评估表新增10条备注,包含参考标准、符号说明、评估项目使用注意事项,使整个表格的使用更加科学、准确、有针对性。
E、新版评估表第六列遗漏了“致敏试验”的题头,估计以后的勘误会做修正。
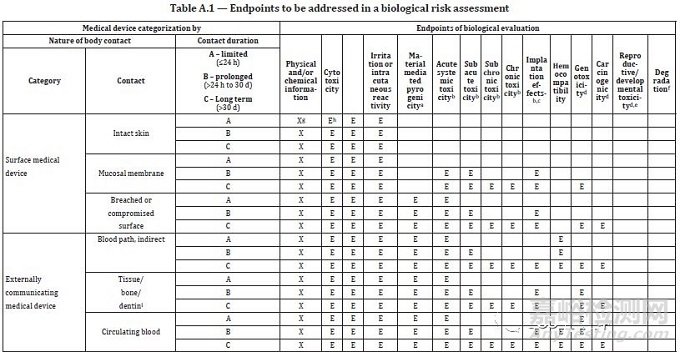
表一 生物风险评估中需要考虑的终点
(摘自 ISO 10993-1:2018 Annex A)
3、 新版6.3 “生物学试验”、 6.3.2“评价试验” 、 6.3.2.2“致敏试验(Sensitization)” 、 6.3.2.9“植入影响(Implantation effects)” 、 6.3.2.13“降解试验(Degradation)”分别替换前版的 “生物学评价试验”、 “试验描述” 、 “迟发型超敏反应(Delayed-type hypersensitivity)” 、 “植入(Implantation)” 、 “生物降解(Biodegradation)”,使条款或术语名称更合理规范。有关生物单项测试的修订解读如下:
A、将旧版“急性全身毒性”中的“热原试验”单列为6.3.2.5“材料性热原”条款, 作为生物学评价的一部分。含有生物材料的器械容易发生“材料性热原”,故要进行重点评估,例如来源于动物心包的心脏瓣膜;
B、新版6.3.2.9“植入影响”新增要求,如果可能和适用,需要同时评价对血液相容性的影响,这是因为器械植入人体时,极易接触到血液系统。
C、新版6.3.2.10“基因毒性”进行了修订,评价试验除ISO 10993-3标准外,还可以同时参考ISO/TR 10993-33:2015 基因毒性评估测试指南(ISO 10993-3补充版)。对于体外阳性试验结果,旧版建议进行体内试验,否则假定材料具有致突变性;新版则建议优先进行可提取物和浸出物研究,对未知杂质进行化学鉴定,探明基因毒性的物质基础。同时,通过材料的化学表征,减少了动物的使用。
D、新版6.3.2.12“生殖和发育毒性”为附录 A 新增评估项目。对于一般医疗器械不用考察评估,但对于新材料、具有已知生殖或发育毒性的材料、具有相关目标人群(例如孕妇)的医疗器械需要考虑。
E、新版6.3.2.13“降解试验”新增了适用范围,即任何医疗器械、部件或残留在组织内的材料,只要可能在人体中降解,都需要提供降解试验信息。另外删除了旧版中“植入体内超过30天的器械”就需要评价降解的情况,原因是有些植入器械虽然超过30天,但材料明确为非降解材料就不必做类似评价试验。
ISO 10993-1与FDA、USP相关指南的关联
ISO 10993-1在引言开头部分就开宗明义指出:本部分综合了多个关于医疗器械生物学评价的国际标准、国家标准和指南,说明该标准的制定和修订兼收并蓄,对各国的生物学评价进行协调。1986年,美国食品药品管理局(FDA)、加拿大健康福利部以及英国卫生和社会服务部共同发布《三方生物相容性指南》。FDA随后于1987年4月23日生效通用程序备忘录“三方生物相容性指南 (G87-1),此指南成为ISO 10993-1:1992 起草的模板。1995年5月1日,FDA发布蓝皮书备忘录G95-1“ISO 10993标准的使用 《医疗器械生物学评估—第1部分:评价和试验》 ”,G95-1取代了G87-1,既和ISO 10993-1 的标准进行了协调,也对部分内容进行了修订,这也成为ISO 10993-1:1997 修订的南本。ISO 10993-1:2009发布后,其中的一些观点和理念也被FDA接受,并在FDA 2016年6月16日发布的“ISO 10993-1标准的使用 《医疗器械生物学评估—第1部分:风险管理过程中的评价与试验指南》 ”中得到体现。ISO 10993-1:2018修订生效时,也汲取了FDA 2016年版指南的营养,例如标题名称的使用,“评估终点”术语的引用,附表A生物学评价项目的新增等。需要强调的是:医疗器械FDA申报时,建议一定参考FDA 2016年版指南;同时FDA不承认ISO 17025体系,所以生物相容性测试必须在正规的GLP实验室完成。 USP41-NF36<1031> “药物容器、医疗器械和植入物中所使用材料的生物相容性”,也是生物相容性评价的指南。但该指南参考标准的仍然是FDA器械评估办公室(ODE)蓝皮书备忘录G95-1,版本比较老,参考意义不太大。
总结
随着ISO 10993-1:2018的全面修订并发布,“医疗器械的风险管理和生物学评价”将再次成为业内讨论的热点,也从侧面说明医疗器械的风险管控将进入一个全新的阶段,会对医疗器械生产商、注册人、检验机构及监管机构产生巨大的影响。由于该标准的重要性,希望我国尽快进行等同转换,为国内企业提供详细的生物学评价体系和技术指南,也为我国医疗器械行业的全面发展和医疗器械的安全使用提供保障。

来源:SGS


