寡核苷酸安全工作组小组委员会(Subcommittee of the Oligonucleotide Safety Working Group, OSWG)是由AstraZeneca、Novo Nordisk、Cardior Pharmaceuticals、Alnylam Pharmaceuticals等公司组成。近期,OSWG发布了关于寡核苷酸类药物(oligonucleotides, ONs)吸收、分布、代谢、排泄研究的白皮书。
ONs是由化学合成的寡核苷酸单链或双链组成的一类药物,一般由12-30个核糖核苷酸或脱氧核苷酸单链或双链组成。ONs通过沃森克里克碱基互补配对作用于目的核苷酸序列上,干扰基因的解旋、复制、转录、翻译等各个环节,使编码异常的基因丧失功能,进而矫正“错误”蛋白质的表达,达到治疗疾病的目的。
ONs包括反义核酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、核酸适配体(aptamer)、核酶(ribozyme)等。其中ASO和siRNA应用最为广泛。
涉及药代动力学研究内容的指南很多,罗列如下。但特别针对寡核苷酸的很少,大多是通用原则,未特指某一类产品。OSWG从这一需求出发,对寡核苷酸的ADME研究策略和特点进行了介绍,以期获得这类产品的最佳实践。
2010, ICH M3(R2): Nonclinical safety studies for the conduct of human clinical trials and marketing authorization for pharmaceuticals.
1995, ICH S3A: guideline for industry, toxicokinetics: the assessment of systemic exposure in toxicity studies.
1995, ICH S3B: pharmacokinetics: guidance for repeated dose tissue distribution studies.
2020, FDA: Safety testing of drug metabolites, guidance for industry.
2012, EMA: Guideline on the investigation of drug interactions.
2020, FDA: Draft guidance: drug-drug interaction assessment for therapeutic proteins guidance for industry.
2022, FDA: Draft guidance: Clinical pharmacology considerations for the development of oligonucleotide therapeutics.
2018, FDA: Guidance for industry, liposome drug products: Chemistry, manufacturing, and controls; Human pharmacokinetics and bioavailability; and labeling documentation.
2010, ICH S9: Guidance for industry, S9 nonclinical evaluation for anticancer pharmaceuticals.
2018, EMA: Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products.
2013, FDA: Preclinical assessment of investigational cellular and gene therapy products.
吸收
通常来讲,寡核苷酸药物的PK/ADME研究目的、设计原则、数据分析,与小分子或者生物药是相似的。ONs药物在分子量、电荷和亲水性方面有一定特殊性。ONs给药方式包括静脉注射(IV)、皮下注射(SC)、鞘内给药(IT)、侧脑室给药(ICV)、吸入给药和玻璃体内注射给药(IVT)。
单次给药PK研究
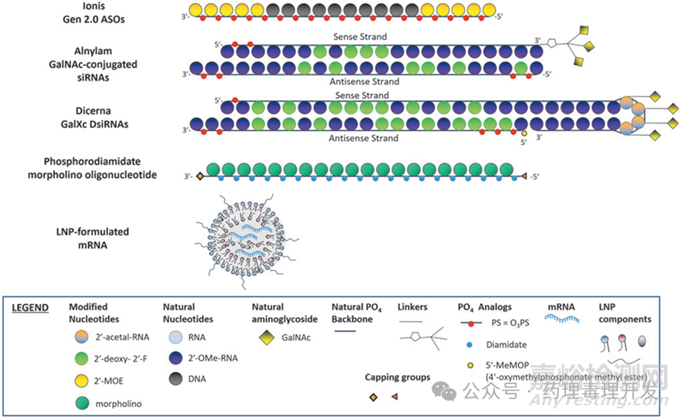
对于新分子ONs,通常需要开展单独的单次给药PK研究,有助于建立血液/脑脊液和组织中药物浓度相关性,并方便可能的建模(PK modeling)。但是,如果一个ONs平台已经进行过充分研究,有着丰富的背景数据,常不需要开展单独的PK研究,因来自同一平台的化合物往往具备相似的ADME属性。比如下图中的Ionis公司的Gen2.0 ASOs平台、Alnylam公司的GalNAc-conjugated siRNAs平台、Dicerna公司的GalXc DsiRNAs平台等。
还有一种获得单次给药PK数据的路径来自重复给药毒理研究中的Day1的PK/TK数据。具体优缺点将在重复给药PK/TK部分讨论。
给药途径与临床拟用途径一致。如果临床非IV给药,如SC、IT或IVT,需要开展非临床IV给药PK研究,考察绝对生物利用度。但关于这点还有些争议,因为ONs产品的PD或者毒性,与生物利用度并不总是相关的。故,不同监管机构对生物利用度的要求也有区别。
剂量选择方面与小分子类似,需要考量动物模型中的药理活性剂量、种属间异速放大或临床拟用剂量范围。同类化合物的临床前PK/PD、体外活性等数据也是可以参考的。当然,最好还要有些动物耐受性试验数据,用于设计PK试验的高剂量。
PK研究用动物种属与药理学和毒理学研究种属一致,通常是啮齿类+猴。如果该分子所在的技术平台已经有充分的研究背景数据,一个种属的PK研究也是可以接受的(如前文所列平台),否则还是需要在两个种属中进行单次给药PK研究。
ONs性别差异在小鼠中偶然存在,在大鼠、猴和人中却非常少见。因此,单次给药PK研究可以在单性别中考察。性别差异可以放在后续重复给药毒性研究中进行评估。
单次给药PK研究中其它指标如研究持续时间、采样时间点、样本基质、分析方法、GLP依从性等与小分子或生物药一致。研究周期应足够长,以充分评估ONs的PK行为,至少覆盖产品的3个消除半衰期。采集时间点应能满足Cmax、Tmax、AUC表征的目的。消除相参数如t1/2、清除率和表观分布容积对于PK/PD或PK建模比较关键,如果可能,也尽量获取。基于Cmax或AUC的剂量-反应关系需要评估。ONs系统给药采集的样本基质通常是血浆或血清,局部给药则视具体解剖位置,可能是脑脊液或玻璃体液。血样通常置于冰上,低温离心,并尽快冻存。如果是mRNA-LNP类药物,还需要添加额外的稳定剂。
单次给药PK研究通常检测血药浓度和组织浓度。通常消除相血药浓度与组织中的浓度是呈一定比例的。
单次给药PK研究通常不检测ADA。
重复给药PK/TK研究
TK研究在non-GLP毒理试验中是建议开展的,在GLP毒理中则几乎是必须要伴随进行的。同样的,ONs类产品的TK研究原则与小分子/生物药也是类似的。前文提到,可以采用第一天PK/TK数据代替单次给药PK研究。这样做的优势是省时、省成本、省动物。缺点是频繁采血操作可能影响毒性结果评估,而且毒性剂量下的线性与药效剂量可能也有区别,对剂量设计的要求比较高。
重复给药PK在给药途径、剂量、种属选择、样品基质、分析方法等方面的要求与单次给药PK一致,不再赘述。
ONs重复给药PK/TK持续时间方面与其他产品略有不同,需要考虑供试品在组织中的半衰期,而不只是外周血中的暴露和消除情况。采样时间点方面,首先需要有充分的时间点保障AUC、Cmax、Tmax的获取。其次,建议每次药前采集1个时间点,用于考察Ctrough。首末次给药后的AUC、Cmax的剂量-比例关系、蓄积情况也需要评估。
ADA的检测可以参照ICH S6(R1)及FDA免疫原性指导原则进行。OSWG强调,只有当PK、PD或毒性发现一些改变,需要ADA解释时,方进行动物ADA测定(The measurement of ADA in animals should be conducted only if there is evidence of changes in PK, PD, or toxicity that could be explained by ADA)。毕竟动物ADA结果的临床转化存在种属差异。此外,FDA对治疗性蛋白产品的ADA方法开发和验证要求适用于ONs。ADA的采集时间点可以在首次给药前、给药期间谷浓度、恢复期处死或TK采集时。ADA的分析结果应能反应发生率、出现时间及持续时间。
另外值得注意的一点是,对于ASOs类产品,ADA对PK谷浓度的影响比较大,ADA阳性的动物较ADA阴性的血药浓度更高。由于仅对低浓度的供试品有影响,故Cmax和AUC不受影响,但消除半衰期可能受影响。因此计算消除参数时,注意区分ADA阳性和阴性动物。
对于LNP包裹的ONs产品,如果采用了之前未在任何上市药物中出现的新的制剂成分,需要额外对该组分的PK和ADA情况进行考察。
对于偶联的ONs,建议对完整偶联的ONs及其代谢物(未偶联的ONs)的PK行为均进行考察。偶联物如GalNAc则很少进行考察。
分布
分布试验的目的主要是获取组织和器官的暴露量,以解释潜在的靶器官毒性,并为给药频率,非临床PK/PD及临床研究提供支持。
体外血浆蛋白结合试验(Plasma protein binding, PPB)
药物与血浆蛋白的结合潜在降低肾小球滤过率和肾脏排泄,延长药物的循环时间。但PPB对于小分子来讲,会降低药物的组织渗透和药理活性。相反,ONs类产品由于细胞的内吞作用,反而会增加活性。原因之一,ONs与血浆蛋白结合特点与小分子不同,亲和力更低且是短暂的。另外,不同修饰对ONs的PPB结合也有很大影响,比如PS修饰会增加PPB结合,2’-MOE、2’-cEt结合则会降低结合,2’F则对结合无影响。单链ONs表现出比双链更高的结合;链的灵活性也影响结合,polyA的亲和力比polyT低100倍。GalNAc降低PPB结合,但PS的影响更占据主导地位。
建议检测不同种属PPB间的差异,包括人、非临床药理学和毒理学相关研究种属。PPB检测浓度至少覆盖临床拟用剂量对应浓度和非临床研究的Cmax浓度,至少设置3个浓度梯度。系统给药的可采用血浆进行评价,局部给药的如IT、ICV、IVT,可采用局部基质如脑脊液、玻璃体液等。
ONs类产品PPB开展的时间点与小分子也有不同,后者通常在IND之前开展。ONs类产品通常种属间PPB结合差异不大,也不涉及游离药物浓度的剂量校正,可以在IND之前,也可以在临床Phase1/2阶段开展。
体内组织分布研究
通常生物药的组织分布研究在大规模临床试验如Ⅲ期临床或上市时提交,但对于ONs则要提前很多,通常在候选分子选择时就开展,作为评估递送的关键指标。组织分布可以用于解释组织暴露和毒性之间的关系,组织中的药物滞留时间还可以指导PD和毒理方案设计,如给药间隔、恢复期等。
试验设计方面与小分子化药大体类似。单种属(如啮齿类)、单次给药、单一性别,剂量至少包括临床有效剂量和毒理剂量。通常采集4-7个时间点,时间点要覆盖血浆Tmax、组织Tmax,直至4-5个组织半衰期。因此,ONs的组织分布时间周期有可能会很久。
为考察ONs药物组织中的蓄积情况。可以通过单次给药组织半衰期和给药间隔进行估算。也可以收集毒理研究终点的组织样本进行检测。具体收集什么组织,可以根据PD和毒理学研究结果确定。至少收集肝、肾这种高摄取的器官。局部给药则要增加给药部位附近相关基质和组织的取材。
分析方法和组织收集
通常组织分布的药物浓度检测方法不需要“validated”,只需要“qualified”即可。有一点需要注意的是,要注意不同动物之间的组织取材一致性,比如肾脏髓质和皮质之间、大脑不同区域之间浓度可能是有差异的。
胚胎-胎仔发育毒性研究中也可以伴随组织分布检测。可以在卫星组收集母体组织样本和血浆,方便与一般毒的TK数据进行对比。胚胎和胎仔的暴露量可以仅检测主要脏器如肝脏,以评估药物透过胎盘屏障及经乳汁吸收的生物利用度。
放射性标记和非标记方法各有优劣。采用非标记方法开展组织分布研究的缺点是获取的组织有限。不过,对于已经有充分背景数据的平台,非标记的方法是可以接受的。各监管机构对放射性标记方法也没有强制要求。如果采用放射性标记方法开展,需要考虑标记位置是否容易被代谢掉。出于稳定性和成本考虑,通常1个分子仅标记1-2个碱基。放射性方法无论周期还是成本,都是高于非放射性的。
其它特殊考虑
对于偶联的ONs,组织分布既要检测完整偶联的ONs,还要检测非偶联ONs和偶联组分(如GalNAc)。偶联组分可以伴随在重复给药毒性中,仅对PD靶器官、肾脏、肝脏及相关器官进行检测即可。
对于LNP递送的ONs(siRNAs或mRNAs),给药途径在模拟临床拟用途径的同时,建议包含拟产生最大系统暴露量的途径(如IV)。对于新的LNP组分,需要检测其浓度和组织半衰期,数据在Ⅲ期临床前提供。不过,如果毒理发现不是与ON有关,怀疑与LNP组分相关,则需要在更早阶段提供新组分的组织分布数据。另外,对于LNP-mRNA,可以对其表达的蛋白在组织或血浆中的浓度进行检测。
代谢
与小分子化药很不同,ONs类产品在不同种属间的代谢差异很小,很少出现仅在人体存在或人体中比例尤其高的特定代谢产物。ONs主要被核酸内切酶、外切酶代谢,而这些酶在哺乳动物中没有种属、性别、年龄相关的差异。不过,这并不意味ONs类产品的代谢研究不重要。ONs产品被切掉少数核苷酸后,剩余的大代谢产物可能依然有活性,仅检测原型ONs会低估该分子的活性。另外,更小片段的代谢产物可能杂交结合脱靶序列,导致非预期毒性反应。故,ONs的代谢研究非常必要。
体外代谢稳定性
体外代谢在药物发现阶段用于考察候选分子的稳定性比较常用。虽然种属间代谢物种类通常没有区别,但代谢速率还是有差异的。一套理想的体外评价体系对预测产品的体内稳定性颇为关键。通常血浆、靶组织细胞或者匀浆物更被认可。如果是局部给药,则建议采用局部基质。
体外代谢产物鉴定
前文已经提过,体外代谢产物鉴定对小分子非常重要,但对于ONs,由于种属间的代谢相似性,该研究的意义有限。有的企业IND阶段不提交代谢产物鉴定的数据,也未影响临床试验启动。有的企业为了降低注册风险,未开展体外试验,仅提供体内代谢数据。有的企业则提供了文献依据,合理说明不开展该项研究的风险并不大。
体内代谢
鉴于ONs类产品的代谢路径具备很好的可预测性,OSWG及ICH相关指南建议在Ⅲ期临床前提供该数据即可。
除非在其它PK/TK研究中看到原型药暴露量的性别差异,体内代谢通常仅在单一性别中考察即可。代谢主要采集的样本是血浆或尿。血浆与组织中的一致性更好,尿则多了肾脏代谢的环节。组织也是一种选择,可以考虑ONs的主要递送器官或表达PD靶标的器官,亦或者潜在长时间滞留的器官。当然,组织中的代谢产物考察并不是出于监管机构的要求,完全取决于企业的研究目的。体内代谢常用检测方法是LC-MS。本研究可以在毒理研究中伴随考察。
代谢产物安全性测试
FDA代谢产物相关指南中要求,如果稳态时代谢产物暴露量超过原型药10%,则会引发安全性方面的担忧。这点对于ONs类产品也适用。
对于新的LNP组分、多肽、连接子,如果未在任何已获批药物中使用过,也需要对其安全性进行评价。
排泄
OSWG及ICH M3建议在Ⅲ期临床前提供排泄数据即可。同一类ONs的排泄路径是相似的。大部分ONs主要在组织中代谢,仅有一小部分以原型药排泄。
排泄可以在单独的PK试验中考察,也可以伴随毒理试验考察。单次给药、单一种属即可。啮齿类通常是首选。既要检测原型药,也要考察代谢物。临床拟用剂量水平的单剂量通常是足够的,但如果伴随在组织分布中考察,还要增加一个更高剂量。通常仅检测尿中组分就够了。但当尿液不是主要排泄途径时,需收集其它样本比如胆汁。如果供试品出现胃肠道毒性或肺毒性,则建议增加粪便和呼气中样品检测。
虽然放射性标记方法非监管机构强制要求,但已上市ONs大多采用该方法评估物料平衡。但OSWG认为ONs产品的代谢和排泄已有充分研究数据,且同类产品的特征相似,放射性标记并不能带来额外价值。而且,如果采用放射性标记,就不能伴随毒理试验开展了。不过,对于其它方法灵敏度不够、对于新型ONs类产品、对于组织滞留时间过长导致临床无法开展基于放射性标记的排泄研究等情况,动物的放射性标记物料平衡就有一定意义。前文也有提到,如果采用放射性方法,标记的位置尽量选择对核酸酶比较稳定的区域。
乳汁分泌则视产品的暴露量和持续时间、口服生物利用度、目标人群是否含哺乳期妇女等决定是否需要开展。根据ICH S5(R3)描述,一般不需要开展。已经上市的ONs类产品,开展过的乳汁分泌研究结果显示供试品浓度非常低或检测不到。
另外,与吸收、分布、代谢的要求类似,如果偶联物、制剂等非ONs部分含有新组分,也需要在排泄试验中增加该部分的检测。最后,对于mRNA治疗的产品,因其先天不稳定性,不要求开展排泄研究的考察。
体外药物相互作用
DDI主要涉及代谢酶和转运体。一个药物既可以成为DDI的“受害者”,也可以作为“加害者”影响其它药物的PK。从受害者角度看,前提是ONs需要成了Ⅰ相或Ⅱ相代谢酶、或转运体的底物。而ONs主要通过核酸酶代谢,与CYPs代谢酶和Ⅱ相结合没有关系,同样也不是转运体的底物。另外,ONs通常也不会影响小分子的PPB结合。因此,ONs类产品通常不需要开展作为代谢酶或转运体底物的相关研究。当然,事无绝对,对于偶联型ONs或含有新组分的LNP制剂产品可以考虑开展代谢酶底物研究。对于主要以原型药物经肾脏排泄的ONs,可以评估下是否是肾转运体的底物。GalNAc偶联的ONs产品则重点关注下是否是肝脏外排转运体的底物。
从加害者角度看,ONs确实有非特异性结合一些大分子的可能,虽然亲和力比较弱,但还是可能会占据酶或者转运体的活性位点,影响其它药物的PK行为。不仅ONs的骨架有可能引起DDI,偶联组分或制剂组分也有潜在风险。如果是平台技术制备的产品,DDI背景数据是可以参考的。比如前序产品DDI阳性,那后续基于该平台设计的产品也需要开展相关研究。如果阴性,则提供其他产品数据和文献资料,不需再额外开展DDI研究。另外,DDI通常仅评估全长供试品,代谢物不在考察范围内。因ONs被细胞内吞后,只有一小部分逃离溶酶体进入胞质,并影响代谢酶,故肝细胞能更好模拟这一完整过程,而肝微粒体出现假阳性的可能性会高很多。再来看转运体,已上市的ONs确实可以看到对某些转运体抑制的报道,如casimersen抑制MATE1,eteplirsen抑制OCT1和OTP1B1等。所以,建议开展ONs对外排和内流转运体的抑制研究。
除了直接的结合引发DDI,ONs还有可能通过其PD作用,影响CYPs或转运体的表达。因此,需要进行充分的文献调研,评估拟开发产品的PD作用对代谢酶和转运体表达的影响。FDA还担心ONs通过间接作用影响CYPs活性。比如细胞因子可以影响CYPs的表达,而ONs有可能调节细胞因子浓度。这种情况下,标准的体外CYPs评估方法就不适用了,可以考虑采用给药后患者的血浆添加到肝细胞中进行评估。
FDA(2020)和EMA(2012)相关指导原则建议小分子药物的DDI研究在Ⅲ期临床前完成,这点也适用于ONs类产品。
最后
寡核苷酸类药物属于比较新型的一类治疗方式,尚没有针对这类产品ADME研究的指导原则。OSWG这类工业界协会发挥了很好的示范作用,给出了比较详细的ADME开展建议。寡核苷酸类药物大部分试验设计原则与传统化药、生物药是相似的,但又有其特殊性。比如吸收部分出现性别差异的风险比较低,可以开展单种属的PK。生物样本采集要考虑到组织中的半衰期。寡核苷酸药物的组织分布研究是重中之重,比化药和生物药的开展节点要提前很多。另外,因种属间代谢酶的一致性,寡核苷酸类代谢研究的意义是不如化药的。寡核苷酸类通常不会是肝药酶CYPs的代谢底物,但确实有可能会影响CYPs或转运体的活性,DDI风险还是需要重视的。当然,不是所有研究均在IND之前完成,很多试验可以在临床期间提供。ONs类产品还涉及偶联组分、递送载体组分等引入的风险,设计方案时也要注意甄别,会影响到检测指标。最后,设计ONs类产品的技术平台背景数据是被OSWG很看重的,对于ADME的具体研究内容影响很大。当然,本文是基于OSWG白皮书所写,并不代表监管机构意见,仅供参考。