摘要
亚硝胺类杂质是一类具有潜在致突变性的化合物。近年来,多种药品中相继检出亚硝胺类杂质,此类杂质已成为监管机构、制药企业和患者关注的焦点。本文在查阅最新法规指南及相关文献基础上,总结了亚硝胺类杂质的来源、控制、限度及检测方法等方面的研究进展,并提出思考和展望,期望为药品研究和监管工作提供参考。
一、背景
自2018年在抗高血压药物缬沙坦中检出亚硝胺类杂质N⁃亚硝基二甲胺(NDMA)后,其他沙坦类药物以及抗胃溃疡药雷尼替丁和尼扎替丁、降糖药二甲双胍和西格列汀、抗结核药利福平和利福喷丁等多种原料药或其制剂中相继检出了亚硝胺类杂质。由于部分药品中检出的亚硝胺类杂质含量超出了可接受水平,导致大量药品被停售、召回或撤市。随着更多的亚硝胺类杂质在药品中被识别或检出,相关事件持续发酵和升级,进一步引发了公众对药品质量和药品供应的担忧,造成了恶劣的经济和社会影响。
为更好地控制药品安全性风险,各国监管机构加强了对亚硝胺类杂质的审查,欧洲EMA、美国FDA及我国国家药品监督管理局(NMPA)陆续发布了相关的指南,目前仍在不断进行更新或补充。制药工业界、学术机构也对亚硝胺类杂质给予了高度重视,相关研究也有大量报道。本文通过梳理国内外指南并参考相关文献,归纳总结亚硝胺类杂质的来源、控制策略、限度制定及检测方法等,加深对亚硝胺类杂质的了解,并对今后的工作提出了展望。
二、致突变性
亚硝胺是指亚硝基与胺直接相连的一类小分子化合物。在体内代谢环境下,亚硝胺可转化为烷基重氮离子,并直接与组成DNA的鸟嘌呤、胞嘧啶和胸腺嘧啶等分子中的氮和氧相互作用,使DNA烷基化,导致DNA发生错配和突变,产生致癌风险。
在2017年ICH发布的《评估和控制药物中DNA反应性(致突变)杂质以限制潜在的致癌风险》(ICH M7)中,亚硝胺被列为具有较高致癌风险的“关注队列(cohort of concern)”杂质,即使摄入量低于毒理学关注阈值(threshold of toxicological con⁃cern,TTC),理论上也可能会导致较高的致癌风险。国际癌症研究机构(International Agency for Research on Cancer,IARC)公布的致癌物中收录了18个亚硝胺类化合物,包括2个1类物质(已确定对人类致癌)、5个2A类物质(对人类很可能致癌,此类致癌物对人类致癌性证据有限,对实验动物致癌性证据充分)和11个2B类物质(对人可能致癌,此类致癌物对人类致癌性证据有限,对实验动物致癌性证据并不充分;或对人类致癌性证据不足,对实验动物致癌性证据充分),见表1。
三、来源
亚硝胺在自然界和工业产品中广泛存在。食品、饮料、啤酒、香烟、玩具、橡胶制品、化妆品、饮用水甚至是被污染的空气中都可能含有亚硝胺,其产生途径也多种多样。根据现有的认知,在人用药品中,处方、工艺、包材、生产和贮藏环境等因素均可能导致亚硝胺类杂质的产生。
3.1 由合成工艺引入
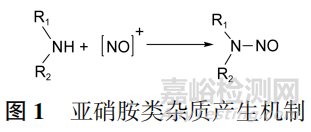
胺与亚硝酸根离子发生亲核取代反应直接生成亚硝胺。在合成工艺中使用了二级胺类化合物和亚硝化试剂时,有较高产生亚硝胺类杂质的风险,见图1。
二级胺不仅包括脂肪仲胺,还包括芳香仲胺以及酰胺、氨基甲酸、羟胺、肼、腙、脲、胍类化合物,其中以脂肪仲胺的亲核性最强,产生亚硝胺的风险最高。仲胺可以是生产过程中直接使用的物料或试剂,如用作溶剂或催化剂的二甲胺、二乙胺,也可以是物料或试剂中存在的仲胺类杂质,如三乙胺中可能含有二乙胺,N,N⁃二甲基甲酰胺(DMF)中可能含有二甲胺,四丁基溴化铵(TBAB)可降解生成二丁胺,N⁃甲基吡咯烷酮(NMP)可在高温下水解生成N⁃甲基⁃4⁃氨基丁酸。
亚硝化试剂来源包括亚硝酸盐、亚硝酸酯以及其他可能产生活性亚硝基的化合物(如亚硝基卤化物、亚硝基鎓盐、氮氧化物、硝基烷烃、卤代硝基烷烃、弗雷米氏盐、亚硝基磺酰胺、羟胺的氧化、硝基取代的芳香化合物脱硝基)等。
沙坦类药物产生亚硝胺类杂质主要是通过仲胺与亚硝酸钠产生。四唑环是沙坦类化合物的必要结构,工业上一般采用有机腈与叠氮试剂通过1,3⁃偶极环协同加成反应来制备。生产过程中为了避免使用有爆炸性风险的叠氮酸,一般使用叠氮化钠、叠氮化三丁基锡、氯化三乙铵/叠氮化钠、氯化三丁基锡/叠氮化钠、溴化锌/叠氮化钠等金属叠氮试剂进行替代,同时加入催化剂(如三乙胺、二异丙基乙胺)加快反应进程,常用溶剂为DMF或NMP,且反应多在高温下进行。反应结束后,为淬灭剩余的金属叠氮试剂,通常还需加入亚硝酸钠。如果亚硝酸钠处理不彻底,将与反应体系中的二甲胺、二乙胺、二异丙基乙胺等仲胺反应生成亚硝胺类杂质。
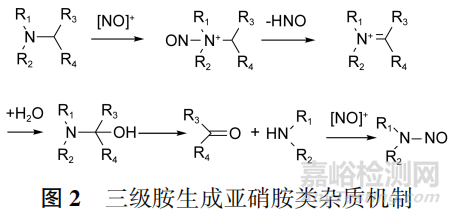
三级胺的氮原子的α碳上如有质子时,也可先经过亚硝化、脱除HNO、水解后得到二级胺,再通过亚硝化产生亚硝胺。由于此过程步骤更多且需发生额外的脱烷基反应,因此由三级胺直接产生亚硝胺的概率较低,但在某些特定条件下仍能够生成亚硝胺类杂质,见图2。
需要强调的是,在连续进行的生产工艺中,即使在不同的步骤中分别使用了胺类化合物和亚硝化试剂,也有可能产生亚硝胺类杂质。2019年在一些批次吡格列酮盐酸盐中检出NDMA,经调查后认为可能原因是在早期合成步骤中使用了亚硝酸钠并经过结晶等操作,后续步骤中又使用了DMF和盐酸,残留的亚硝酸钠在酸性环境中与DMF水解产生的二甲胺反应生成了NDMA。
此外,工艺中如涉及经过氯化、氯胺化、臭氧处理过的自来水,如在合成步骤中涉及仲胺或者叔胺,也有生成亚硝胺类杂质的风险。该过程的机制较为复杂,可能涉及多种微量成分在特定条件下的催化反应。
3.2 由降解引入
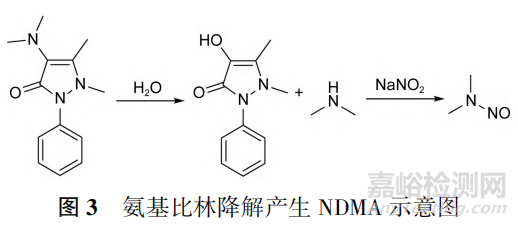
在生产和贮藏期间,与原料药结构相关的某些化合物(包括起始物料、中间体和原料药本身)可能降解生成仲胺,进而生成亚硝胺类杂质。如Eisenbrand等研究认为,氨基比林中NDMA可能来源于氨基比林降解产生的二甲胺亚硝化后生成,见图3。
美国FDA调查发现,在室温下贮藏时,雷尼替丁中NDMA水平会随着时间的推移而升高,加速条件下NDMA水平增长速度更快,说明雷尼替丁在贮藏期间可产生NDMA。King等在排除了合成工艺、物料污染等可能引入NDMA的因素后,以同位素取代的原料制备了氘、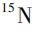 取代的雷尼替丁,并用质谱分析其中的NDMA。结果显示,纯的同位素取代的雷尼替丁中只产生了全同位素取代的NDMA(分子量+7),表明形成NMDA的二甲胺和亚硝基全部来自雷尼替丁而非外源性物质。将同位素取代的雷尼替丁与普通雷尼替丁混合后,检出了4种分子量(+0,+1,+6,+7)的NDMA,表明形成NDMA的反应也可发生在雷尼替丁分子之间。该研究进一步证实雷尼替丁可降解产生NDMA,但具体的机制尚未阐明图片,见图4。
取代的雷尼替丁,并用质谱分析其中的NDMA。结果显示,纯的同位素取代的雷尼替丁中只产生了全同位素取代的NDMA(分子量+7),表明形成NMDA的二甲胺和亚硝基全部来自雷尼替丁而非外源性物质。将同位素取代的雷尼替丁与普通雷尼替丁混合后,检出了4种分子量(+0,+1,+6,+7)的NDMA,表明形成NDMA的反应也可发生在雷尼替丁分子之间。该研究进一步证实雷尼替丁可降解产生NDMA,但具体的机制尚未阐明图片,见图4。
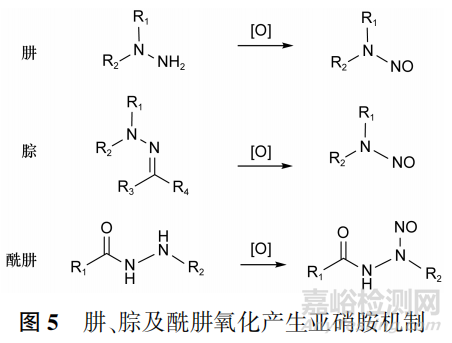
基于上述原因,2020年4月,美国FDA要求立即停用和召回所有涉及雷尼替丁的药品。肼、腙及酰肼类化合物在合成过程及贮藏期间还可被空气、过氧化物、臭氧等氧化生成亚硝胺,见图5。
3.3 由辅料或包材引入
多种辅料如羟乙酸淀粉钠、交联羧甲基纤维素钠、预糊化淀粉、聚乙烯吡咯烷酮、交叉聚乙烯吡咯烷酮和乳糖等均可能含有痕量亚硝酸盐杂质。制剂处方中的原料药或其降解物/杂质结构中存在胺结构(如仲胺、叔胺等)时,在制剂生产或者贮藏期间有生成亚硝胺杂质的风险。如文松松等研究认为,二甲双胍中残留的二甲胺与辅料羟丙甲纤维素中的亚硝酸盐发生反应生成NDMA,导致二甲双胍缓释片中的NDMA超出可接受限度(acceptable intake,AI)。
包装材料也可引起亚硝胺类杂质生成。例如含有硝化纤维的盖箔在热封过程中可形成氮氧化物,与油墨中的胺类化合物反应生成亚硝胺类杂质并转移至药品中。《化学药品与弹性体密封件相容性研究技术指导原则(试行)》提出,亚硝胺类杂质也是橡胶密封件相容性研究需要重点关注的一类物质。
3.4 由物料污染引入
原料药生产过程中使用了被仲胺、亚硝化试剂或者是直接被亚硝胺类杂质污染的物料(包括但不限于起始物料、中间体、溶剂、试剂、催化剂等),也可能带来亚硝胺类杂质残留的风险。例如,美国FDA在2019年检查Lantech Pharmaceuticals Limited时,发现其回收溶剂中含有NDEA,而该回收溶剂用于缬沙坦的生产。另外,在同一生产线上连续运行不同品种的合成工艺时,如清洁不彻底,也可能会造成交叉污染,导致亚硝胺类杂质产生。
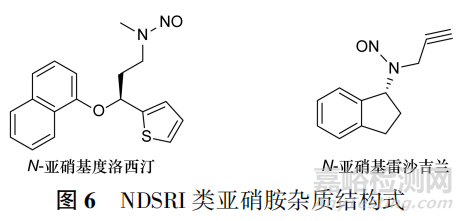
还有一类仲胺来源的亚硝胺类杂质,原料药或者中间体、起始物料中结构本身自带的仲胺结构可能会导致亚硝胺类杂质产生,如度洛西汀中检出的N⁃亚硝基度洛西汀、雷沙吉兰中检出的N⁃亚硝基雷沙吉兰。这些与原料药结构密切相关的杂质称为NDSRI(nitrosamine drug substance related impurities)。需要说明的是,此类NDSRI杂质可能与原料药合成工艺相关,也可能是原料药与辅料中的痕量硝酸盐或者亚硝酸盐反应生成,见图6。
四、控制策略
国内外监管机构对于亚硝胺类杂质均建议采取“避免为主,控制为辅”的策略。实施药品工艺开发时应遵循质量源于设计的理念,推荐采用ICH Q9《质量风险管理》中所述的失效模式与影响分析(FMEA)或失效模式、影响与关键性分析(FMECA)方法进行风险评估。
如评估结果显示生产工艺有产生亚硝胺类杂质的风险,应尽量避免选择此类工艺。比如在进行叠氮化反应时,可考虑将反应生成的中间体先分离出来,然后再用亚硝酸盐淬灭剩余的叠氮化试剂;也可考虑采用其他试剂(如次氯酸钠等)代替亚硝酸钠作为淬灭剂。当生产工艺中不得不使用亚硝化试剂时,应尽量降低引入胺类化合物的风险,比如避免使用DMF或NMP等胺类的溶剂、用其他催化剂代替胺类催化剂等。如果确实无法避免在同一品种生产过程中同时或先后使用亚硝化试剂和胺类,则应考虑优化反应条件降低亚硝胺类杂质生成的风险,并证明工艺对此类杂质有足够的清除能力,制定合理的控制策略。
如果工艺中使用了回收物料,应评估其中存在亚硝胺类杂质或后续可能生成亚硝胺类杂质的风险,并制定相应的控制措施。建议对合成工艺中涉及物料供应链进行审计,监控有风险的起始物料、中间体及溶试剂。同时还应加强药品生产质量管理规范(GMP)管理,对生产线进行充分的清洁验证,避免交叉污染。
如果有辅料、包材导致生成亚硝胺类杂质的风险,应尽量使用其他种类的辅料或包材进行替代。如无法避免使用,则应对辅料或包材进行针对性研究和控制,并在制剂中建立合理的控制策略。例如上文提及的NDMA,某公司对其产品盐酸二甲双胍缓释片进行风险评估,研究发现原料药中二甲胺含量对制剂中NDMA含量有重要影响,最终将原料药二甲胺限度在欧洲药典(EP)控制限度0.05%基础上进一步严格要求。另外研究发现辅料中羧甲纤维素钠、羟丙甲纤维素、微晶纤维素均存在亚硝酸盐,其中羧甲纤维素钠、微晶纤维素中亚硝酸盐含量极低,且2种辅料在处方中占比例较低,风险较低,而羟丙甲纤维素中亚硝酸盐含量较高,且该辅料在处方中占比例较高,风险较高,对该辅料中亚硝酸盐含量进行了严格控制。通过控制原料药中二甲胺含量及辅料羟丙甲纤维素中亚硝酸盐含量,产品中NDMA含量在稳定性考察中虽有增长趋势,但均未超出限度要求。
若在贮藏期间有产生亚硝胺类杂质的风险,应对可能的产生原因进行充分调查,并对存放的药品实施严密监测,必要时采取相应的控制措施。
需要指出的是,亚硝胺类杂质不仅存在于化学合成的药品中,也可能存在于生物制品中,因此需对所有类别的药品中亚硝胺类杂质进行风险评估。
五、杂质限度
根据美国FDA、欧洲EMA、国家药品监督管理局(NMPA)等国内外监管机构发布的指南,亚硝胺类杂质仍然适用ICH M7关于潜在致突变杂质的控制要求,即AI值可以采用公开文献中报道的研究较为完善的啮齿动物致癌效价数据如TD50值(给药剂量下会导致50%的肿瘤发生,等于患癌风险可能性水平为50%)进行外推计算。如果杂质没有相关的TD50数据或TD50数据研究不够完善,则可以考虑与已知TD50值的结构相似化合物采用构效关系进行推导,如NDBA和N⁃亚硝基⁃N⁃甲基⁃4⁃氨基丁酸(NMBA)的AI值均采用此种方式进行推导计算。此外,欧洲EMA也推荐统一采用18ng·d-1作为没有研究数据的亚硝胺类杂质的AI值,该数据是根据Lhasa致癌性数据库收录的致癌性最强的一类亚硝胺杂质的TD50数据进行线性外推得到的。表2是欧洲EMA基于上述规则推荐的单个已知亚硝胺类杂质的AI。

如果药品中存在2种及以上的亚硝胺类杂质时,欧洲EMA认为只需对其中含量大于其AI值10%的杂质进行控制,小于AI值10%的亚硝胺类杂质所构成的毒理学风险较低,可忽略不计。欧洲EMA指南推荐了2种限度制定策略,一种策略是筛选出含量大于其AI值10%的所有亚硝胺类杂质,将亚硝胺类杂质的总量控制在其中已知致癌效力最高的亚硝胺类杂质限度之内,此种情况下无需分别制定单个亚硝胺类杂质的限度。第2种策略是将亚硝胺类杂质的总量控制在不超过1/100000的致癌风险水平。针对第2种策略,该指南提供了固定方法及灵活方法2种计算方式。所谓固定方法是指对单个亚硝胺类杂质设置固定的限度(转换为以ppm或者ppb表示,下同),而对总亚硝胺类杂质限度无需控制。每个亚硝胺类杂质的限度应根据其在亚硝胺总量中所占百分比计算其限度。所谓灵活计算是指每个亚硝胺类杂质限度为其AI值,但每个杂质实际含量除以其AI值的百分比总和不得超过100%。举例如下:一个最大日剂量为300mg产品中含有2个亚硝胺类杂质且其检出量均大于各自AI值的10%,分别为NDMA和NDEA,2个杂质的AI值转化为ppm表示:NDEA为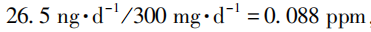 ,同理NDMA限度计算为0.32ppm,不同控制策略的杂质限度见表3图片。
,同理NDMA限度计算为0.32ppm,不同控制策略的杂质限度见表3图片。
目前各监管机构已经明确,以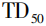 为计算依据的亚硝胺类杂质限度均依据终生暴露时长制定,且监管机构关于亚硝胺类杂质的限度制定依据也在不断调整中。
为计算依据的亚硝胺类杂质限度均依据终生暴露时长制定,且监管机构关于亚硝胺类杂质的限度制定依据也在不断调整中。
尽管ICH M7提出潜在致突变杂质的限度可依据短于终身治疗时长(less than lifetime,LTL)进行调整,但由于亚硝胺类杂质的特殊性,从保护患者的角度,欧洲EMA通常不接受对亚硝胺类杂质采用LTL概念进行限度调整,除非与监管部门协商同意后商定一个临时限度,直到采取进一步措施降低至AI。
欧洲EMA在2022年10月更新的问答中指出,对于上市药品含有一种或多种新的亚硝胺类杂质的量超过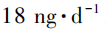 ,经监管机构批准后可采用
,经监管机构批准后可采用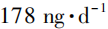 (总亚硝胺)的临时AI(temporary AI,t⁃AI),该t⁃AI也是使用Lhasa致癌性数据库中计算的
(总亚硝胺)的临时AI(temporary AI,t⁃AI),该t⁃AI也是使用Lhasa致癌性数据库中计算的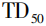 值得出的,且使用时间一般不超过12个月。如超过12个月,需征得欧洲EMA相关机构同意。
值得出的,且使用时间一般不超过12个月。如超过12个月,需征得欧洲EMA相关机构同意。
美国FDA基本也是遵循上述原则。例如在美国销售的戒烟药伐仑克林中检出N⁃亚硝基伐仑克林,该杂质的AI值为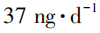 ,为防止药品召回后引起药品短缺,美国FDA曾在2021年7月宣布为该杂质制定
,为防止药品召回后引起药品短缺,美国FDA曾在2021年7月宣布为该杂质制定 的临时AI值,不会反对销售含有N⁃亚硝基伐仑克林高于
的临时AI值,不会反对销售含有N⁃亚硝基伐仑克林高于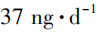 但低于图片的伐仑克林片,直到杂质被消除或降低到可接受的水平。这是因为美国FDA科学家评估了在临时可接受摄入量水平下暴露于N⁃亚硝基伐仑克林的风险,与终生每天暴露于37ng的N⁃亚硝基伐仑克林的相比,临时最高
但低于图片的伐仑克林片,直到杂质被消除或降低到可接受的水平。这是因为美国FDA科学家评估了在临时可接受摄入量水平下暴露于N⁃亚硝基伐仑克林的风险,与终生每天暴露于37ng的N⁃亚硝基伐仑克林的相比,临时最高 的暴露量引发额外患癌的风险最小。后续美国FDA于2022年5月宣布在美国市场销售的该制剂中N⁃亚硝基伐仑克林的含量不得超过
的暴露量引发额外患癌的风险最小。后续美国FDA于2022年5月宣布在美国市场销售的该制剂中N⁃亚硝基伐仑克林的含量不得超过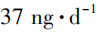 。
。
六、检测方法
为确保亚硝胺类杂质的可控,并依据测定结果制定原料药及制剂合理的控制策略,需要建立能准确可靠检测此类杂质的方法。由于亚硝胺类杂质在药品中多以痕量存在且其安全限度较为严格,对分离检测技术的要求较高,目前大多采用色谱⁃质谱联用技术进行检测,如LC⁃MS,LC⁃MS/MS,GC⁃MS,GC⁃MS/MS等,目前各监管机构已在网站或更新的药典中公布了相关产品的详细检测方法。采用上述方法时,需对检测方法进行确认,重点关注检测方法的专属性及灵敏度。
由于不同药物的合成工艺或处方组成不同,也可结合药物的特点以及待测亚硝胺类杂质的理化性质,自行开发适当的检测方法,此时需对检测方法进行全面验证,可考虑建立2种不同原理的互补的检测方法,以验证检测方法的可行性,确保检测结果的可靠性。对于不能直接测定或在检测条件下不稳定的亚硝胺,可考虑采用衍生化法进行测定。
需要注意的是,开发检测方法时需重点关注其专属性,避免出现假阳性及假阴性检测结果。例如美国FDA利用其开发的检测方法检测二甲双胍缓释片中NDMA的含量普遍低于一家检测机构的结果,经调查发现,使用检测机构的方法,产品中存在的DMF干扰了NDMA的检测,使其检测结果普遍偏高。又如用于测试沙坦类药物中亚硝胺类杂质的GC⁃MS方法不适用于雷尼替丁中NDMA的检测,原因是雷尼替丁在高温下会产生NDMA。因此,在检测亚硝胺类杂质时,除了需要开发高灵敏度的检测方法外,实际操作过程中还需格外谨慎仔细地排除来自仪器、器具、试剂、水、基质、环境等甚至是待测样品本身引起的干扰。
七、总结与展望
近年来,虽然监管机构与业界针对亚硝胺类杂质给予了前所未有的关注,在杂质溯源、毒理研究、分析方法开发等方面取得了较多进展,但此类杂质仍然是制药行业需共同面对的难题。药品中某些亚硝胺类杂质的产生机制尚未完全阐明,随着越来越多的药物中检出亚硝胺类杂质,新发现的亚硝胺类杂质的种类也更加多样化。亚硝胺类杂质的质控限度十分严格,现有检测方法通用性较差,对仪器设备及人员经验要求较高,分析方法干扰因素较多,开发通用、简便、灵敏的检测方法是对分析人员的巨大挑战。再者,亚硝胺类杂质能够以极低的剂量水平产生较高的致突变风险,其致癌性不容忽视,但亚硝胺类杂质不仅存在于药品中,还广泛存在于水、空气、食品以及多种工业产品中,人们在日常生活中已经不同程度地摄入了亚硝胺类杂质,如何科学合理地对待药品中的亚硝胺类杂质,达到风险与获益间的平衡,对于监管机构与业界都是巨大的挑战。
参考文献
[1]FDA.FDA Announces Voluntary Recall of Several MedicinesContaining Valsartan Following Detection of an Impurity[ EB/0L].[2022-12-18].https://www.fda.gov/news-events/press-announcements/fda-announces-woluntary-recall-several-medi-cines-containing-valsartan-following-detection-impurity.
[2]FDA. $tatement alerting patients and health care professionals of NDMA found in samples of ranitidine[EB/0L].[2022-12-18]https ://www, fda. gov/news-events/press-announcements/state.ment-alerting patients-and-health-care-professionals-ndma-found.samples-ranitidine.
[3]FDA.Statement from Janet Woodcock, M.D., director of FD A'sCenter for Drug Evaluation and Research , on impurities found indiabetes drugs outside the U.S.[ EB/0L].[2022-12-18].ht-tps://www, fda. gov/news-events/press-announcements/state.ment-janet-woodcock-md-director-fdas-center-drug-evaluation-and-researeh-impurities-found.
[4]FDA, FDA Requests Removal of All Ranitidine Products ( Zan.tac)from the Market[EB/0L].[2022-12-18].https://wwwda.gov/news-events/press-announcements/fda-requests-removalall-ranitidine-products-zntac-market.
[5]FDA. Search list of Recalled Angiotensin I Receptor Blockers(ARBs)Including Valsartan , [osartan and Irbesartan : Find outwhich Specifie Blood Pressure Medications are Affeeted by theRecall[EB/0L].[2022-12-18].https://www.fda. gov/drugs/drug-safety-and-availability/search-list-recalled-angiotensin-ii-re.ceptor-blockers-arbs-including-valsartan-losartan-and.
[6]FDA. Amneal Pharmaceuticals, LC. Issues voluntary nationwiderecall of nizatidine oral solution , 15 mg/mL, due to potential lev-els of N-nitrosodimethylamine (NDMA)impurity amounts abovethe levels established by FDA[EB/0L].[2022-12-18 ].ht-tps://www. fda. gov/safety/recalls-market-withdrawals-safety-alerts/amneal-pharmaceuticals-lle-issues-voluntary-nationwide-re-call-nizatidine-oral-solution-15-mgml-due.
[7]EMA, Update on review of recalled valsartan medicines : preliminaryassessment of possible risk to patients EB/0L].[2022-12-18].htips://www.ema.curopa.eu/en/news/update-review-recalled-val.sartan-medicines-preliminary-assessment-possible-risk-patients
[8]EMA, EMA reviewing medicines containing valsartan from Zhe.jiangHuahai following detection of an impurity: some walsartanmedicines being recalled across the EU[EB/0L].[ 2022-12-18.https://www.ema.europa.eu/en/news/ema-reviewing-medi.cines-containing-valsartan-zhejiang-huahai-following-detection-impurity-some
[9]EMA,Valsartan: review of impurities extended to other sartanmedicines[EB/0L].[2022-12-18].https://www.ema. curopa.eu/en/news/valsartan-review-impurities-extended-other-sartan.medicines.
[10]EMA.Procedure under Article s(3)of Regulation EC( No )726/2004 Nitrosamine impurities in human medicinal productsEB/0L].[2022-12-18 ]. https://www. ema. curopa. eu/endocuments/referral/nitrosamines-emea-h-a53-1490-assessment-report_en.pdf.
[11]FDA. Control of Nitrosamine impurities in human drugs EB/0L].[2022-12-18].hitps://www. fda. gpv/media/141720/download.
[12]国家药品监督管理局药品审评中心.国家药监局药市中心关于发布《化学药物中亚硝胺类杂质研究技术指导原则(试行)》的通告(2020年第1号)[EB/0L].[2022-12-18].https://www.ode.org,cmainnews/viewInfoCommon/776b663787ec5a60ac744071c3714d5a.
[13]叶倩,耿兴超,张河战,等.亚硝胺类遗传毒性杂质的监管策略及思考[J].中国药事,2021,35(2):127-137.
[14]ICH.ICH M7(Rl)assessment and control of DNA reactive( mutagenie)impurities in pharmaceuticals of limit potential carcinogenic risk[EB/0L].[2022-12-18].https ://database. ich.org/sites/default/files/M7 Rl Guideline.pdf.
[15]LARC. Agents classified by the lARC Monographs, Volumes 1132[EB/0L].[2022-12-18].https ://monographs. iarc. who.int/list-of-classifications.
[16]LÓPEZ-RODRÍGUFZ R,MCMANUS JA, MURPHY NS, et al.Pathways for N-nitroso compound formation: secondary aminesand beyond[ j].0rg Process Res Der,2020,24(9):1558-1585.
[17]ZHOU Y, WANG 」, GU ZN, et al. Next generation of fuorine.containing pharmaceuticals,compounds currently in phase clinical trials of major pharmaceutical companies : new structuratrends and therapeutie areas[J]. Chem Rep,2016,116(2):422-518.
[18]HERR RJ. 5-Substituted-1月-tetrazles as carboxylic acid isosteres:medicinal chemistry and synthetie methods J]. BioorgMed Chem,2002.10(11):3379-3393.
[19]梁义,侯英卓,刘德才,等.水体中亚硝基二甲胺(NDMA)形成和降解概述[J].轻工科技,2020,36(9):112-115.
[20]KRASNER SW, MITCH WA, MCCURRY DL, et al. Formation ,precursors,control,and occurrenee of nitrosamines in drinkingwater:a review J.Water Res,2013,47(13):4433-4450.
[21]EISENBRAND G,SPIEGEIHAIDER B, KANN J, et al. Carei.nogenie N-nitrosodimethylamine as a contamination in drugs containing 4-dimethylamino-2,3-dimethyl-1-pheny-3-pyrazolin-5one(amidopyrine,aminophenazone).Arznemittelforschung1979,29(6):867-869.
[22]KING FJ, SEARLE AD, UROUHART MW. Ranitdineinvestigations into the root cause for the presence of N-nitroso-N.N.dimethylamine in ranitidine hydrochloride drug substances andassociated drug productsJ].0rg Process Res Der, 2020.24(12):2915-2926.
[23]WU YM, LEVONS J, NARANG AS, et al. Reactive impuritiesin excipients: profling, identifcation and mitigation of drug-excipient incompatibility[J]. AAPS Pharm Sei Tech,2011.12(4):1248-1263.
[24]文松松,牛冲,刘琦,等.盐酸二甲双胍制剂中 N-亚硝胺基因毒性杂质的 CC-MS/MS 测定及 N-亚硝基二甲胺的产生机制解析[J].药物分析杂志,2022,42(8):1424-1432.
[25]EMA. Ouestions and answers for marketing authorisation holdersapplicants on the CHMP Opinion for the Article 5(3)of Regulation (EC)No 726/2004 referral on nitrosamine impurities in human medicinal products[EB/0L].[2022-12-18 ].https :/www.ema.curopa.ew/endocuments/referral/nitrosamines-emea-ha53-1490-questions-answers-marketing-authorisation-holders/ap.plicants-chmp-opinion-article-53-regulation-ec-n0-726/2004-referral-nitrosamine-impurities-human-medicinal-products en .pdf.
[26]国家药品监督管理局药品审评中心.《化学药品与弹性体密封件相容性研究技术指导原则(试行)》[EB/OL].[2022-1218].https://www.cde.org,cn/alyz/domesticinfopage? zdyzld.C0DE=a38135dt72524a15d357e0602b82d4.
[27]FDA, Statement on the ageney's ongping efforts to resolve safetyissue with ARB medications[EB/0L].[2022-12-18].https ://www.fla.gov/news-events/press-announcements/statement-ageneysongoing-efforts-resolve-safety-issue-arb-medicat ions.
[28]FDA. Updates on possible mitigation strategies to reduce the riskof nitrosamine drug substance-related impurities in drug productsEB/0L].[2022-12-18].hitps://www.fda.gov/drugs/drugsafety-and-availability/updates-possible-mitigation-strategies-re-duce-risk-nitrosamine-drug-substance-related-impurities.
[29]FDA.FDA Updates and Press Announcements on Nitrosamine inVarenicline(Chantix)[EB/0L].[2022-12-18].https://wwwda.gov/dmugs/drug-safety-and-availability/fda-updates-and-pressannouncements-nitrosamine-warenicline-chantix.
[30]FDA. Rigorous Detection of Nitrosamine Contaminants in Met.formin Products : Balancing Product Safety and Product Accessi.bility[EB/OL].[2022-12-18]. https ://www.fda. gow/drugsnews-events-human-drugs/rigorous-detection-nitrosamine-contami.nants-metformin-products-balancing-produet-safety-and-product.
[31]EMA. Assessment report. Referral under Article 3l of Directive2001/83/EC.INN:ranitidine [EB/0L].[2022-12 -18 ]. ht-ips://www.ema.curopa.ew/en/documents/referml/mnitidine-article3l-relerral-assessment-rpoit en.pdf.
[33]董晨欢,龚青,张新房.利福平和利福喷丁中亚硝胺类杂质控制策略综述[J],中国新药杂志,2024,33(1):23-27.田冶,冯媛媛,陶晓莎,等.固相萃取-离子色谱法检测利福平及利福喷丁胶囊中亚硝酸根离子[J].中国新药杂志,2023 32(21):2218-2224.
[34]刘品品,梁智渊,梁爱仙,等.GC-MS/MS 测定替米沙坦片中10种亚硝胺类基因毒性杂质[J].中国现代应用药学,2023.40(9) : 1224-1229.
[ 35]王琳,李德霞,王小芹,等.二甲双胍亚硝胺杂质研究及亲水凝胶骨架材料的筛选[J].中国现代应用药学,2023,40(7):909-916.
[ 36]李霄,王娜,张娜,等.UHPLC-HRMS 定量检测莫西沙星中5种亚硝胺类化合物[J].中国现代应用药学,2022,39(1):82-86.
[37]张雅军,陈忠兰,徐翊雯,等,定量核磁共振氢谱法测定5 种N-亚硝胺类化合物的含量[J].中国新药杂志,2022,31(13):亖茱方窗せ瘐驛雚26-1330.


 取代的雷尼替丁,并用质谱分析其中的NDMA。结果显示,纯的同位素取代的雷尼替丁中只产生了全同位素取代的NDMA(分子量+7),表明形成NMDA的二甲胺和亚硝基全部来自雷尼替丁而非外源性物质。将同位素取代的雷尼替丁与普通雷尼替丁混合后,检出了4种分子量(+0,+1,+6,+7)的NDMA,表明形成NDMA的反应也可发生在雷尼替丁分子之间。该研究进一步证实雷尼替丁可降解产生NDMA,但具体的机制尚未阐明图片,见图4。
取代的雷尼替丁,并用质谱分析其中的NDMA。结果显示,纯的同位素取代的雷尼替丁中只产生了全同位素取代的NDMA(分子量+7),表明形成NMDA的二甲胺和亚硝基全部来自雷尼替丁而非外源性物质。将同位素取代的雷尼替丁与普通雷尼替丁混合后,检出了4种分子量(+0,+1,+6,+7)的NDMA,表明形成NDMA的反应也可发生在雷尼替丁分子之间。该研究进一步证实雷尼替丁可降解产生NDMA,但具体的机制尚未阐明图片,见图4。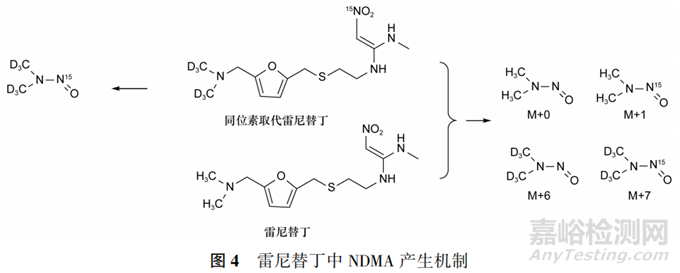

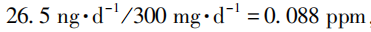 ,同理NDMA限度计算为0.32ppm,不同控制策略的杂质限度见表3图片。
,同理NDMA限度计算为0.32ppm,不同控制策略的杂质限度见表3图片。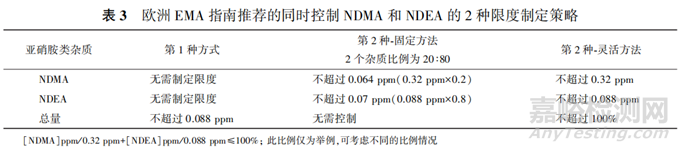
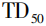 为计算依据的亚硝胺类杂质限度均依据终生暴露时长制定,且监管机构关于亚硝胺类杂质的限度制定依据也在不断调整中。
为计算依据的亚硝胺类杂质限度均依据终生暴露时长制定,且监管机构关于亚硝胺类杂质的限度制定依据也在不断调整中。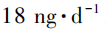 ,经监管机构批准后可采用
,经监管机构批准后可采用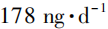 (总亚硝胺)的临时AI(temporary AI,t⁃AI),该t⁃AI也是使用Lhasa致癌性数据库中计算的
(总亚硝胺)的临时AI(temporary AI,t⁃AI),该t⁃AI也是使用Lhasa致癌性数据库中计算的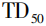 值得出的,且使用时间一般不超过12个月。如超过12个月,需征得欧洲EMA相关机构同意。
值得出的,且使用时间一般不超过12个月。如超过12个月,需征得欧洲EMA相关机构同意。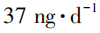 ,为防止药品召回后引起药品短缺,美国FDA曾在2021年7月宣布为该杂质制定
,为防止药品召回后引起药品短缺,美国FDA曾在2021年7月宣布为该杂质制定 的临时AI值,不会反对销售含有N⁃亚硝基伐仑克林高于
的临时AI值,不会反对销售含有N⁃亚硝基伐仑克林高于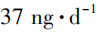 但低于图片的伐仑克林片,直到杂质被消除或降低到可接受的水平。这是因为美国FDA科学家评估了在临时可接受摄入量水平下暴露于N⁃亚硝基伐仑克林的风险,与终生每天暴露于37ng的N⁃亚硝基伐仑克林的相比,临时最高
但低于图片的伐仑克林片,直到杂质被消除或降低到可接受的水平。这是因为美国FDA科学家评估了在临时可接受摄入量水平下暴露于N⁃亚硝基伐仑克林的风险,与终生每天暴露于37ng的N⁃亚硝基伐仑克林的相比,临时最高 的暴露量引发额外患癌的风险最小。后续美国FDA于2022年5月宣布在美国市场销售的该制剂中N⁃亚硝基伐仑克林的含量不得超过
的暴露量引发额外患癌的风险最小。后续美国FDA于2022年5月宣布在美国市场销售的该制剂中N⁃亚硝基伐仑克林的含量不得超过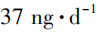 。
。


