前言
药品技术转移可以定义为“将药品的知识、技术以及相关联的产品和工艺过程,从转出方(如CRO/MAH/CMO等),转移到接收方(如MAH/CMO/CRO等)的过程”。技术转移作为产品生命周期的一部分,可以发生于不同阶段,且可以多次发生,目前技术转移相关指南多侧重于上市申请及商业化阶段,随着国家实施MAH制度、鼓励创新药等政策的不断推进,在产品IND阶段,技术转移也常发生,只是由于对产品和工艺的了解信息有限,IND阶段技术转移更注重真实性、可追溯性,而商业阶段技术转移,监管合规性期望会更高。药品技术转移应该按照项目而不仅是一个过程去管理,其顺利实施,依赖于良好的知识转移、对产品和工艺的理解以及高效项目管理。
药品技术转移,往往以满足阶段性要求为目标,如IND阶段转移,常以生产合格临床样品和稳定性考察(满足临床使用过程中稳定性)为目标,合规性应满足NMPA关于《临床试验用药品附录的公告(2022年第43号)》要求(FDA、欧盟、WHO均发布了IND阶段GMP规范,涉及国外注册时可以参考);而上市注册和商业化阶段转移,常以完成工艺验证、稳定性考察、递交注册申报为目标,合规性应满足现行GMP、注册申报等要求,其中知识管理的重要性,也正逐渐被业界重视。
PDA、ISPE、WHO、中国等均发布了技术转移相关指导规范,相关信息汇总如下表:
▲ 表-1主要药品技术转移指南汇总表
|
机构 |
名称 |
目的 |
备注 |
|
PDA |
技术报告65(TR65):技术转移,2014 |
为制药工业进行药品技术转移活动,提供指南和最佳实践。 |
重点可以参考分析方法转移实施案例。 |
|
ISPE |
良好规范:技术转移第3版,2018 |
为制药行业有效实施技术转移,以及如何平衡监管期望和风险管理、成本等提供良好操作规范。 |
结合药品生命周期管理方式,将基于科学和风险的原则如QbD、质量风险管理(ICHQ9)、制药质量体系(ICHQ10)等先进工具和管理应用到技术转移中,同时,强调了知识管理对技术转移的重要性。 |
|
WHO |
TRS 1044 附录4:WHO药品生产技术转移指南,2022 |
适应制药行业发展,重点关注转移的组织管理、质量风险管理、变更管理、生命周期方式、控制策略等。 |
通用要求,在2011年TRS 961 附录 7版本上升级,增加了基于风险的生命周期管理方式,具有通用性。 |
|
中国 |
药品GMP指南:质量管理体系,2011 |
含对技术转移的说明 |
针对上市申请和商业化阶段,在科学、可操作性方面与国外发布指南有差距。 |
|
ChP2020通则9100 分析方法转移指导原则,2020 |
为可能存在的分析方法转移类型和转移方案内容提供指导。 |
与USP、EP相关要求基本一致,不涉及微生物和生物学方法。 |
技术转移一般通过变更管理程序,正式进入到接收方内部管理体系。药品技术转移主要指药学CMC转移,主要涉及产品、工艺以及分析方法转移,三者相互关联。笔者重点参考ISPE 和WHO的技术转移指南,结合实际工作经验对技术转移流程、风险评估、转移实施等要点进行阐述,便于为同行实施技术转移提供可操作性建议。
1、技术转移一般流程
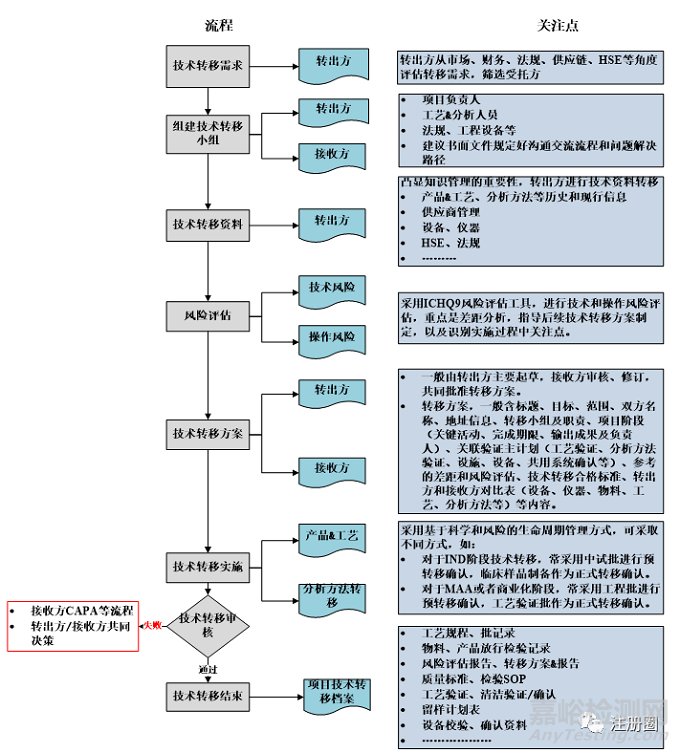
药品技术转移,首先需要确定技术转移需求,然后转出方和接收方共同组建技术转移小组,进行后续的技术资料转移、风险评估、撰写技术转移计划/方案、实施技术转移等工作,技术转移一般流程及关注点见下图1:
▲ 图1-药品技术转移一般流程
2、技术转移资料
技术资料的转移本质上就是产品知识的转移,知识管理尤其重要,通常在组建转移小组后,由转出方及时提供给接收方。基于生命周期管理思路,不同阶段,可转移资料存在区别,国内制药企业对药品技术转移管理和实施的重视程度及规范性,较国外仍存在差距,尤其涉及重大项目或者国内外转移时,建议可参考ISPE指南列举的资料清单(针对商业化阶段,见下表2),提供相关等同性资料,资料提供的越全面,越利于技术转移实施。
▲ 表2-技术资料清单
|
清单 |
大分子药物 |
小分子药物 |
|
通用资料 |
技术转移概述报告 |
P |
P |
|
风险评估 |
P |
P |
|
经验教训 |
P |
P |
|
物料相关 |
物料清单 |
P |
P |
|
起始物料信息(含合成路线) |
/ |
P |
|
关键物料 |
P |
P |
|
细胞库/原始细胞库 |
P |
/ |
|
现行供应商 |
P |
P |
|
现行质量标准和关键质量属性CQAs |
P |
P |
|
物料检验报告/放行数据 |
P |
P |
|
存储要求 |
P |
P |
|
产品相关 |
产品开发报告 |
P |
P |
|
开发运行数据 |
P |
P |
|
工艺描述 |
P |
P |
|
质量标准 |
P |
P |
|
历史批数据 |
P |
P |
|
CQAs及制定依据 |
P |
P |
|
粒径、溶解性等理化特性指标 |
/ |
P |
|
毒理数据(PDE) |
/ |
P |
|
可提取物、浸出物、吸附性数据 |
P |
P |
|
生物利用度/生物等效性数据 |
/ |
P |
|
稳定性研究报告/数据 |
P |
P |
|
持续稳定性 |
P |
P |
|
清洁限度 |
P |
P |
|
清洁批记录 |
P |
P |
|
工艺相关 |
框图流程图/工艺流程图 |
P |
P |
|
物料性能数据(尤其是关键物料属性) |
P |
P |
|
质量平衡 |
P |
P |
|
热平衡 |
/ |
P |
|
收率 |
P |
P |
|
循环时间 |
P |
P |
|
关键工艺参数CPPs及范围 |
P |
P |
|
控制策略 |
P |
/ |
|
主批记录 |
P |
P |
|
历史批数据 |
P |
P |
|
趋势分析/统计过程控制 |
P |
P |
|
过程控制样品 |
P |
P |
|
保持时限/位点 |
P |
P |
|
包装 |
P |
P |
|
废物/通风特性 |
/ |
P |
|
等同性研究 |
P |
P |
|
批准的重新加工、回收利用物料 |
P |
P |
|
健康、安全和环保HSE |
爆炸下限 |
P |
P |
|
物料安全说明书 |
P |
P |
|
物料分类 |
P |
P |
|
过程危害风险分析 |
P |
P |
|
个人防护设备要求 |
P |
P |
|
签发的各类许可 |
P |
P |
|
设施、设备 |
工艺管道仪表流程图P&IDs |
P |
P |
|
URS/设计标准 |
P |
P |
|
公用系统需求 |
P |
P |
|
控制系统 |
P |
P |
|
自动化 |
P |
P |
|
仪器 |
P |
P |
|
物料相容性 |
P |
P |
|
取样位置 |
P |
P |
|
确认数据/报告 |
P |
P |
|
质量/监管 |
质量协议 |
P |
P |
|
供应商审计 |
P |
P |
|
超标产品 |
P |
P |
|
变更控制 |
P |
P |
|
工艺偏差/CAPA |
P |
P |
|
工艺验证报告 |
P |
P |
|
注册申报资料 |
P |
P |
|
检查报告 |
P |
P |
|
产品年度回顾 |
P |
P |
注:考虑到保密性和信息有限性,对于IND阶段,技术转移资料可以根据实际情况,评估提供,以满足临床样品制备和检验需求为最低要求。
3、风险评估
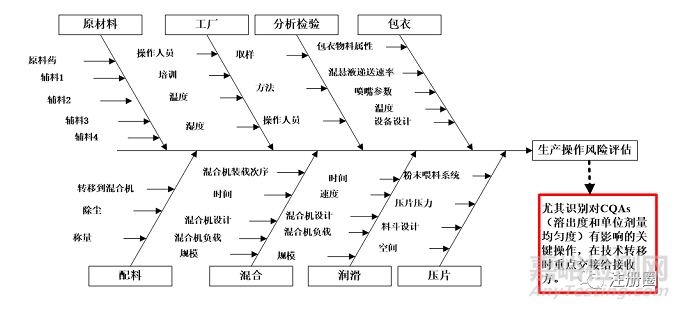
风险评估十分重要,有利于识别转出方和接收方在设施设备、工艺、检验仪器、对产品理解等方面存在的差距,为后续转移方案及控制策略制定提供依据。建议条件允许时采用面对面的交流评估方式,降低转移双方信息差,便于接收方更深入地理解产品和工艺性能,推荐采用鱼骨图,从物料、仪器设备、方法、人员、测量、环境等方面进行转移评估,尤其需要识别出对CQAs有影响的CPPs,和接收方重点阐述说明,以某固体制剂项目转移为例,其操作风险评估鱼骨图可采用下图2方式呈现:
▲ 图2-某固体制剂技术转移操作风险评估鱼骨图
4、技术转移实施
4.1 分析方法转移
定性分析方法如外观、IR鉴别等一般无需进行方法转移,通过培训即可,定量方法如含量、有关物质、溶出度等,一般需要进行方法转移,方法转移类型主要有比对试验、共同验证、再验证、转移豁免等四类,其中比对试验是最常用的方式,分析方法转移常见类型及考虑要点见下表3:
▲ 表3-分析方法转移实施类型
|
方式 |
描述 |
考虑要点 |
|
比对试验 |
转出方和接收方对预先确定数量的、同批次样品进行分析,差异满足一定要求。 |
1)样品应具有代表性如富含杂质的母液回收、稳定性加速样品等。 |
|
2)也可以采用在样品中加入某个杂质的回收率实验,接收方能够达到预先制定的可接受标准。 |
|
共同验证 |
接收方参与方法开发实验室(转出方)的方法验证过程 |
1)方法验证方案应专门针对共同验证策略,明确职责。 |
|
2)共同验证一般适合同一集团或公司内分析方法转移。 |
|
再验证 |
由接收方对待转移方法进行再验证或部分验证,证明方法适用性。 |
1)接收方进行再验证的程度,需具体问题具体分析,一般针对在转移中可能受到影响的指标,进行部分验证,如精密度、检测限、定量限、耐用性等。 |
|
2)再验证一般适用于已有分析方法验证信息不充分(如上市时间较长)或者转移的工艺、分析方法等在新场地(接收方)有变更的情形。 |
|
方法转移豁免 |
需要提供科学的证明性资料,证明方法满足豁免情形。 |
1)接收方已经在相似的样品中,使用过分析方法。 |
|
2)接收方人员具有相应的检验经验,如使用相同或者等同仪器、系统和软件的经验。 |
|
3)应根据豁免理由形成书面文件。 |
4.2 产品/工艺转移
产品/工艺技术转移通常围绕,如何回答以下3个问题进行:
1)当前的工艺/产品是什么?
2)基于任何与新场地相关的限制因素/标准,期望的最终产品/工艺是什么?
3)为了证明产品准确、工艺稳健,需要进行什么样的支撑性工作?
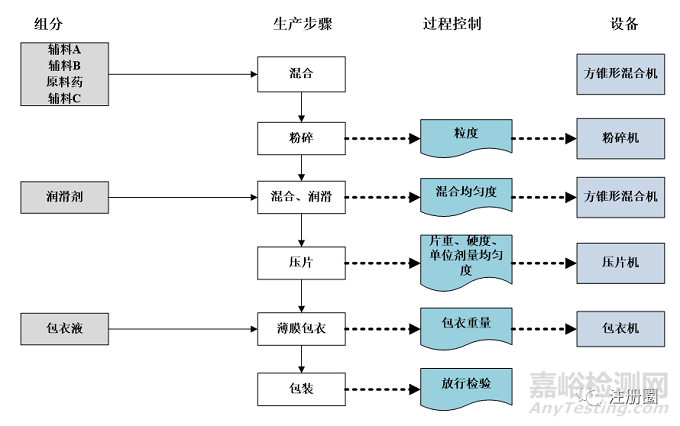
推荐采用框图流程图(含组分、生产步骤、过程控制、设备等),对待转移产品及工艺进行可视化呈现,便于接收方增强理解,如某片剂产品/工艺转移的框图流程图示例如下:
▲ 图3-某片剂框图流程图示例
进行产品/工艺转移,通常都涉及分析方法转移,常需要更广泛的取样计划,收集接收方初始转移实施信息,跟踪关键指标检验。IND阶段技术转移,通常以生产合格临床样品为目标,技术转移通常会首先进行试生产(中试批)或者空白模拟,考察工艺参数和设备可行性,然后进行正式临床样品制备。而上市注册/商业阶段技术转移,常以完成工艺验证为目标,工艺验证实施前,通常可采用工程批对工艺性能、产品质量符合性进行预先确认,当结果显示性能和质量均接近边缘指标时,提示需要进行工艺优化;若各指标均能很好满足预设指标,则可以进行工艺验证。
5、技术转移结束
技术转移实施过程中和完成后,均应该对开展情况进行审核,确保后续的稳定性研究、监管承诺、质量管理系统等工作有序开展,理想的技术转移实施,工艺、产品及稳定性趋势等应符合预期目标,且涉及的偏差和变更等均已记录和调查,一般会输出技术转移报告,相应的转移档案资料需要一并收集,及时反馈给转出方。
当过程和结果显示转移不成功时,需要通过接收方的CAPA程序进行全面调查,反馈转出方,转出方和接收方共同决策。