药品上市后变更管理是药品全生命周期管理的重要组成部分,其监管也是各国或地区药品监管的重点和难点。原料药是药品的活性成分,在预防、诊断、处置、缓解或治疗疾病中发挥药理作用或其它直接效用,或者影响人体的结构和机能。所以,原料药的质量直接决定了药品的质量,原料药的上市后变更也直接对药品的安全性和有效性产生影响。
原料药上市后变更应该以其注册上市时或登记时开展的研究验证工作,以及既往实际生产过程中积累的数据和上市后研究为基础,原料药生产企业对原料药本身的了解程度决定了其在预计发生变更时对风险的预知程度,而对风险的预知程度就决定了其进行变更研究的广度和深度,从而最终决定了所实施的变更对产品所产生的实际影响。因此,原料药上市后的变更评估就显得尤为重要,它是企业充分认识和总结品种特点、预知变更可能存在风险及针对风险制定研究和验证内容的系统性工作。
一、原料药变更的管理要求
各国/地区对原料药的法律界定不尽相同,但药品监管体系较为成熟的国家和地区,都将原料药上市后变更作为药品监管的重点。美国食品药品管理局(FDA)虽然对原料药主要采取登记管理,即药物主文件(DMF)制度,但FDA的法规对药品定义了三个级别的变更上报类型,对登记原料药同样适用,对于在制剂申请中提供原料药信息的,通过制剂上报变更,即需事先批准的主要变更补充申请、30天生效或立即生效的中等变更补充申请、在年度报告(AR)中上报的微小变更。
原料药以前在我国获批后有相应的药品批准文号,相关上市后变更自然也是按药品上市后变更管理。自2017年11月起,我国对原料药采取登记形式,不再颁发药品批准文号,但原料药的审批依旧是行政许可事项,虽然原料药采取关联审评审批,但实际管理依旧是按照药品管理。《药品上市后变更管理办法(试行)》中也明确原料药发生变更时要按照相关管理规定及技术指导原则,进行充分研究、评估和必要的验证,确定变更管理类别,并按法规要求对于生产过程中的重大变更需要报补充申请经国家局批准后实施,中等变更需要在所在省局备案后实施,微小变更实施后需要在年度报告中报告。
二、原料药生产过程变更研究评估
相对于同一剂型的制剂生产工艺比较类似的情况,原料药的生产涉及的化学反应有成千上万种,所以原料药变更的研究及评估更加复杂和困难。因为原料药生产工艺更具有特异性,所以对于原料药生产过程的变更,结合品种特点的要求就更为突出。
在这种情况下,各国的原料药变更指导原则都不可能将原料药可能涉及的变更情形一一列举。因此更需要生产企业全面掌握所生产品种的特点、工艺控制的要求,根据指导原则精神和风险控制的目的,以及提出的变更总体考虑、变更研究验证的思路,对计划发生的变更进行深层次的原因和可能存在的风险进行分析,进而开展相应的研究和验证工作,以此达到变更后能持续生产出质量不降低的原料药的目标。对于原料药生产工艺变更的评估应该系统全面,充分考虑变更对后续反应及反应后处理的影响和潜在风险,不能仅仅局限于变更步骤或操作本身,这样才能达到有效控制风险的目的。
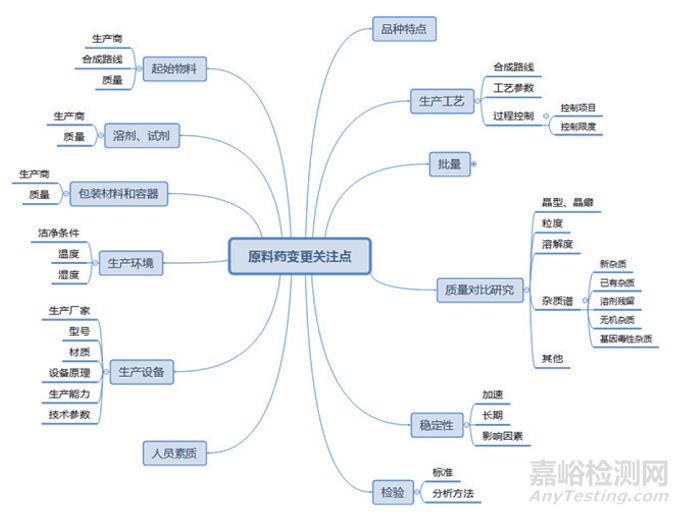
本文所讨论的原料药变更,仅涉及合成原料药以及半合成原料药的合成步骤及之后的生产工艺。这也是美国《原料药批准后变更行业指南》和我国《已上市化学药品药学变更研究技术指导原则(试行)》中变更原料药生产工艺部分的适用范围。化学合成原料药发生变更时,可能影响原料药质量的因素有很多,如图所示,所以企业需要在变更时对诸多因素进行综合评估。
原料药变更影响因素思维导图
品种特点方面。无论是制剂还是原料药,充分了解品种特点是有效控制变更风险的基础。对于原料药的品种特点,应从反应条件、化合物的结构以及化合物的稳定性等方面进行考虑。这里考虑的化合物不只是最终的原料药,还包括起始物料、合成过程中的中间体或中间产物。如果存在化合物或反应过程中使用的试剂对光、水、氧等敏感,在相应的步骤或反应后处理中应考虑反应过程中及相应操作时的控制措施。如果变更后的化合物稳定性差的,应根据其降解或变化的可能,在生产工艺和中间体保存中采取必要的措施,以达到能持续稳定地获得目标化合物和控制有关物质的目的。
人员素质方面。经验丰富的人员在同一设施中实施变更的风险,会比没有经验的人员实施变更的风险小。即便是设备也发生了变更,既往有过使用相同或类似设备经验的人员也比未使用过的人员实施变更的风险小。对于原料药,人员如果曾经有过操作类似化学合成反应经验的也比无相关经验人员的风险小,特别是对于原料药合成中反应条件苛刻、反应过程剧烈或反应中有燃烧或爆炸可能性的反应,相关经验就更为重要。
设施设备方面。在合成路线不变的前提下,设施设备的变更评估应重点关注设备变更发生的工序。如果是因合成路线等变更引起的设施设备的变更,应按照关联变更的要求进行相应的评估和研究验证。如果设施设备变更是最后一步反应之后不同设计和工作原理的设备变更,则更容易引起原料药物理性质的变化。设备材质变更时要考虑新材质与反应的相容性。生产规模的变更往往关联设备变更,如果仅生产批量变更,那么设备变更应为相同材料、设计及操作原理,仅是容量上的不同,且工艺参数的调整应限于适应设备变化需求,并且关键工艺参数应在申报范围之内。但在原料药批量变化较大时,研究工作总体上应按照技术要求较高的变更类别进行。
杂质方面。在原料药生产过程的变更中,杂质的研究不仅仅是对质量标准中规定的杂质进行检验后比较,因为生产工艺的变更往往会引起原料药杂质情况的变化。在评估时要综合考虑已有杂质、新杂质、残留溶剂、无机杂质、基因毒杂质的变化情况。如果变更后原料药的已有杂质及杂质总量与历史数据相当,可以视为杂质谱一致。变更前后杂质谱一致的,变更风险较小,杂质谱不一致,变更风险较高。评估变更对杂质谱的影响应根据实际情况确定在哪个工艺阶段评估杂质,非分离的物料一般不适合用于证明杂质谱的一致性,应在变更所在步骤之后的某已分离物料的杂质谱与变更前对比研究。
物理性质方面。原料药生产工艺的变更,特别是原料药最后一个溶液步骤及其后步骤的变更最有可能影响原料药的物理性质。对于最终以溶液剂型给药或制剂生产过程中原料药需要完全溶解的剂型及快速溶解的口服剂型等,理化性质的变更对制剂的影响比较小。但对于难溶原料药的口服制剂、原料药为固体的非口服剂型、受原料药物理性质影响显著的剂型、局部用药的粉末剂型、部分改良释放速度的药品等,物理性质就需要特别关注。变更发生在原料药最终沉淀、原料药部分溶解的打浆等步骤时,对原料药物理性质的变化产生影响的可能性更高。设施设备和生产批量的变更,也可能会对原料药的物理性质产生影响。
药品质量关系到人民群众的身体健康和生命安全,原料药的质量直接决定了药品的质量。原料药登记人在实施变更过程中,应结合品种特点,依据申报注册的工艺研究和既往生产的历史数据,充分评估变更可能存在的风险,并针对这些潜在风险开展相关研究验证工作,从而保证变更后的原料药质量不降低、不对相关制剂产生不良影响。制剂的持有人也应切实履行主体责任,按法规及自身生产要求对原料药供应商进行规范管理,及时了解原料药的变更情况,从而保证药品的安全、有效和质量可控。