您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-14 12:25
口服固体制剂是指片剂、胶囊剂、颗粒剂等经口服给药的固体制剂。
混合和压片/填充阶段是口服制剂生产工艺的关键工艺步骤,如何使混合物料的混合均匀度和中控剂量单位均匀度满足生产需求,确保每个单位剂量的物料中含有均等的活性物质,是实现成品含量均匀的前提。
近日,通过梳理相关技术指导文件,参加专家老师培训解读,对该项内容有了更深刻的理解和认识,故总结整理以下学习笔记,作为后续项目研究的基础文件。
1、国内外粉体混合均匀性指导原则
1999年8月,美国食品药品监督管理局(FDA)发布名为“Guidance for Industry,ANDAs:Blend Uniformity Analysis”的指导原则,该指南详细列出了混合均匀度抽样和验收标准。但该指南是独立于USP成品放行之外的过程检测方法,并在其中提到只要产品不符合混合均匀性要求无论最终产品是否符合含量均匀度要求该批产品最终都不得放行。产生上述矛盾的根本原因在于混合取样问题(取样器相关的混合采样错误问题)和分析方法不足(混合样品分析过程中的称重误差)。
2003年FDA发布“Guidance for Industry: Power Blends and Finished Dosage Units——Stratified In-Process Dosage Unit Sampling and Assessment”,此指南开启了以过程分层取样来评价混合均匀性的重要跨越,分层取样评估混合均匀性的优势体现在以下几个方面:
(1) 可以对产品的同质性进行精确的度量;
(2) 消除与取样器采样相关的错误问题;
(3) 提供可靠、准确的产品质量信息;
(4) 消除混合样品分析过程中的称重误差;
(5) 消除在隔离环境中生产的有毒或强效药物混合取样的安全问题;
(6) 可以解释混合后物料在压片或者灌装过程中的潜在分离行为。
ISPE(国际制药工程协会)于2014年在03版的指导原则上修订产生了“Recommendations for the Assessment of Blend and Content Uniformity: Modifications to Withdrawn FDA Draft Stratified Sampling Guidance”,此建议优化了混合器内样品混合均匀性可接受标准,初步提出了基于混合器内物料混合均匀性、过程分层取样均匀性以及终产品含量均匀性三者数据之间的关联性尝试建立以分层取样数据作为终产品含量均匀度的重要思考。更新了对于混合器内混合均匀性样品进行BU进行了Stage2(30个数据分析)的判断并提高了Stage1的判断限度5.0%→3.0%,并增加了分层取样点密度(20个点→40个点)同时在判定标准中取消了重量校正的操作,直接以单点值(20*3)进行结果判定这样以来该分层取样数据就能和放行的含量均匀度数据建立直接的相关性为后来在线放行的理念做了很好的铺垫。
ASTM E2709“Standard Practice for Demonstrating Capability to Comply with an Acceptance Procedure”和ASTM E2810“Standard Practice for Demonstrating Capability to Comply with the Test for Uniformity of Dosage Units”,伴随着统计学在制药领域的不断应用以及PAT技术的不断推广,粉体混合均匀性判断也迎来了属于她的统计分析时代。ASTM在取样操作上保留03指导原则的基础上增加了取样量、检测量的灵活性,操作者基于对自己产品的认知制定灵活的取样测试方案。
2021年9月26日CDE发布关于公开征求《口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(征求意见稿)》,进一步加强ICH质量源于设计QbD理念在实际生产中的运用,提高口服固体制剂生产过程中的风险控制水平,明确混合均匀度和中控剂量单位均匀度研究的技术要求。首先,指南对可能影响混合均匀度的原因进行分析,通常与物料的理化性质(如物料粒径及其分布、引湿性等)、工艺特点(如湿法制粒、粉末直压等),应对可能影响混合均匀度或中控剂量单位均匀度的因素进行风险评估,设计合理的取样计划,以充分反映物料的混合效果,建立合理的验收标准,以确保成品含量均匀度满足你定目标的要求。
2、取样要求(很重要)
2.1取样计划(取样点、取样量、取样份数等)
(1)混合阶段取样计划
混合阶段最终混合物的均匀性是压片或填充阶段单剂量单位均匀性的前提,也是保证成品含量均匀度的基础。
要求制定混合阶段取样计划时,取样点应均匀分布且有代表性。应结合混合设备的结构特点,确定混合设备的死角,运用合适的工具,选取不同位置的取样点进行分析,以考察样品的混合效果。例如:方锥型混合机,取样点应至少分布在混合物料的上、中、下三层及卸料区域(见下图)。
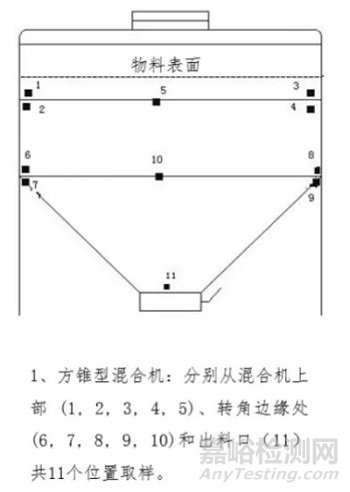
建议在混合设备和/或中间体物料容器中至少选取10个取样点,每个取样点至少取3份混合样品。单份样品取样量通常应在1-10倍单剂量范围内,样品应全量用于混合均匀度检测。
(注:对于中控分析方法需要考察前处理参数的提取率应满足试验要求,例如,取样计划为单份样品取样量为2倍单剂量,样品全量用于混合均匀度检测,则需要考察2倍单剂量样品合适量瓶体积,使满足提取回收率90%-110%)
(2)压片/填充阶段取样计划
要求制定压片/填充阶段取样计划时,应根据压片/填充工序的全过程预设适宜的取样位置和取样间隔,对剂量单位进行取样和检测。取样点必须覆盖整个压片/填充运行过程。
建议对压片/填充工序的整个批次中一般不少于20个取样点进行在线取样,每个取样点至少取样7个剂量单位。对于部分特殊情况,例如批量较小,工艺时长较短等,无法达到建议的取样点,在提供充分的科学说明后,可以适当减少取样点。
2.2取样误差
(1)取样器的设计
取样器的物理设计会影响取样误差。一个常见的设计是由两个同心的管子组成。内部的管子除了为样品采集留出的一个或多个腔室外其它部分都是实心的。外面的管子中空并带有与内部管子腔室相一致的孔。理想的是,取样过程中,关闭的取样器被插入到在粉末床中预期的位置,打开取样器,令一个样品流入内部管子的取样腔。然后关闭取样器,取出样品,收集并分析。
(2)取样技术
当将取样器插入静止的粉末中时,取样器将材料从混合器上层的物料带到下层从而使粉末床变形。理论上,变形量的大小取决于取样器是否以流畅的,断续的或是旋转的方式插入。取样器插入粉末床的角度也会影响取样误差。事实显示,一个单独的取样器,垂直方向插入与锐角插入相比可以取得粒子大小不同的样品。此外,如果取样器以锐角插入,在取样过程中样品腔室会朝向下方,上方或两者间的位置。这些因素会在不同方面影响样品。粉末床的深度也会影响取样误差。这种压力在大容量容器底部比中部或接近顶部要大很多。经证明,取样器从静止粉末床的底部和顶部可以得到粒子大小显著不同的样品。
(3)制剂的理化特性
将长取样器插入到很深的粉末床中所需的力量是可感知的。这种力量取决于制剂的物理特性,会导致紧压,粒子磨损和粉末床的更多变形。如果混合物有较宽范围的粒径分布,穿过过粗糙物料的侵透性会导致样品没有代表性。另外,当用取样器从由各种流动特性的粉末组成的均匀混合物中抽样时,流动更自由的粉末将被优先采集到取样器腔体中。这就会导致样品没有代表性。另一方面,有粘性的粉末不会流进取样腔体中。为了便于粉末流动,操作者可能需要轻拍,旋转或猛拉取样器。
3、验收标准
3.1混合均匀度验收标准
(1)在整个批次中选取至少10个取样点,每个取样点至少取3份混合样品;
(2)每个取样点检测一个样品,计算所有样品的相对标准偏差(RSD),所有单值在均值的±10.0%(绝对)以内。
如果RSD≤5.0%,进行中控剂量单位均匀度的测定;
如果RSD>5.0%,则测定剩余样品(每个取样点的另外2份样品)的混合均匀度。
(3)剩余样品的混合均匀度检测:测定每个取样点的其他混合样品,计算所有样品的RSD%,所有单值在均值的±10.0%(绝对)以内。
如果RSD≤5.0%,进行中控剂量单位均匀度的测定(至少测定20个取样点,每个取样点至少检测7个剂量单位);
如果RSD>5.0%,则进行调查,以确定变异性是否是由产品/工艺问题或取样/分析误差引起的。如果高RSD归因于取样/含量测定误差,则进行中控剂量单位均匀度(至少测定20个取样点,每个取样点至少检测7个剂量单位);如果高RSD归因于产品/工艺相关的原因,混合均匀性则是不可接受的。
(1)(2)(3)项是混合阶段完整的验收标准,在撰写制剂中控检验方案时建议完整描述。
3.2中控剂量单位均匀度验收标准
(1)整个批次中一般不少于20个取样点(包括运行的开始点和结束点;数值应进行重量校正)进行在线取样,每个取样点至少取样7个剂量单位;
(2)测定每个取样点中至少3个剂量单位,每个取样点的平均值在目标剂量的90.0%-110.0%之间,所有单值在目标剂量的75.0%-125.0%之间。
如果RSD≤6.0%,则该批次样品中控剂量单位均匀度可被接受;
如果RSD>6.0%,则测定剩余样品(每个取样点所有未检验的单剂量)的中控剂量单位均匀度。
(3)剩余样品的中控剂量单位均匀度检测:测定未检验的剩余样品,计算所有样品的RSD。每个取样点的平均值在目标剂量的90.0%-110.0%之间。所有单值在目标剂量的75.0%-125.0%之间。
如果RSD≤6.0%,则该批次样品中控剂量单位均匀度可被接受;
如果RSD>6.0%,则该批次样品含量不均匀。需对两个阶段的所有数据进行分析,以确定潜在的变异性来源,从而对生产工艺加以改进。
(1)(2)(3)项是压片/填充阶段完整的验收标准,在撰写制剂中控检验方案时建议完整描述。

来源:Internet


