您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-17 20:13
【概述】药物制剂组成复杂,在各种生产过程均可能引入元素杂质,这些元素杂质不仅可能影响药效,还是影响药品质量安全的重要因素。根据国际人用药物注册技术协调会议( International Conference of Harmonization,ICH)发布的 Q3D 元素杂质指南,分析元素杂质在药物制剂中的引入途径及限度要求,发现元素杂质在元素周期表中呈较规律分布,而元素杂质存在的形态与其毒性有较大关系,旨在为药品质量监控提供参考。
国际人用药物注册技术协调会议(ICH)Q3D元素杂质指南是新药制剂元素杂质控制的质量指南,旨在为新药制剂和其赋形剂中元素杂质的定性和定量控制提供全球性方针。根据《美国药典》39和《欧洲药典》9.0中相关金属元素杂质的通则,汇总这些指导性文件与ICH Q3D的不同之处。结果与结论:Q3D主要包括潜在元素杂质的安全性评价,类别,元素杂质的风险评估和控制,日允许暴露量(Permitted Daily Exposure,简称PDE)与浓度限度之间的转换。元素杂质的风险评估应考虑潜在元素杂质的来源和药物服用方式,将特定元素杂质水平与PDE进行比较,评价该元素在药品中存在的可能性。经风险评估需要进行控制的元素杂质,可以根据药物服用剂量和PDE用3种方法设定元素浓度限度,这有利于帮助药品生产企业通过风险评估来决定对哪些元素进行额外控制,从而有效保障药品质量。
一 药物制剂中元素杂质的来源
药物制剂组成复杂,包括原料药、辅料、催化剂等,组成各组分的无机元素种类杂多,一部分直接或间接参与人体的各种生理生化过程从而影响药品活性,如钙、镁、钠、钾、锌、铁等另一部分对药效无益甚至会产生毒性反应影响药品质量,即为元素杂质。国际人用药物注册技术协调会议( InternationalConference of Harmonization,ICH) 于 2014 年 12 月,发布 Q3D 元素杂质指南,并于 2019 年 3 月进行了最新修订该指南对元素杂质的分类、风险、浓度限度等进行了详细评估,旨在为新药制剂和其赋形剂中的元素杂质的定性和定量控制提供指导方针,并为元素杂质建立了允许日暴露量( Permitted Daily Exposure,PDE) 。
本文总结了与药品质量安全紧密相关的元素杂质在化学元素周期表中的分布,分析了这些元素杂质在药物制剂中的引入途径及限度要求,列举了部分元素杂质在不同形态的同一元素与人体健康的关系,旨在为药物制剂中元素杂质的监测和药品质量控制提供科学指导。
二 药物制剂元素杂质分类
药物制剂的元素杂质包括各组分中可能引入的部分人体必需的微量元素以及部分尚未发现存在于人体内的金属元素,如镉、汞、铅、鈀等。与生命体有关的金属元素仅有十几种,在生物体内相对含量较低,属于 “微量元素”,如锰、钴、铜、镍、铬等,这些元素在化学元素周期表中呈规律分布,主要是第三、四周期的碱金属、碱土金属和第四周期过渡金属 。人体必需的微量元素在正常体内都有其规定的相对含量,如铬与葡萄糖代谢及胰岛素分泌有关,在一般成年人体内约含 6 mg,钴是维生素 B12 的中心金属离子并参与多种酶的催化过程,在一般成年人体内约含 1. 1 ~ 1. 5 mg; 而对于人体尚未发现的金属元素,一旦进入体内,即使在极微量的情况下也能通过配位键与氨基酸或蛋白酶等紧密结合,从而影响生命体的正常生理过程。
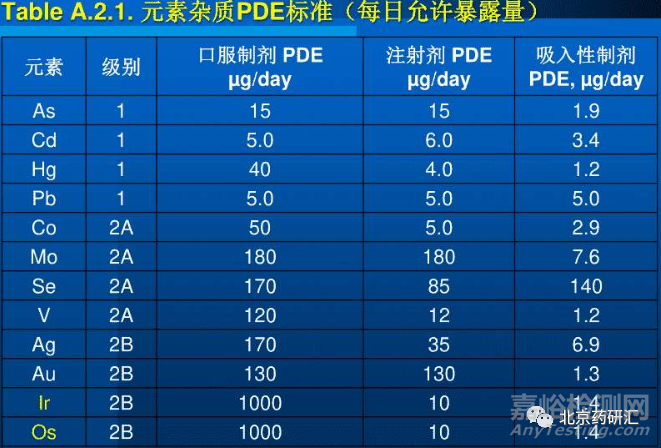
根据元素对人体的毒性大小及在药物制剂中出现的可能性,ICH Q3D 将元素杂质分为三类 。第一类,对人体毒性较大,在所有给药途径中都必须进行检测并限制使用; 第二类,包括 2A 类和 2B 类,2A 类在药物制剂中出现的概率较高,在所有给药途径中均须进行检测,2B 类在药物制剂中出现的概率较低,故无需检测,若在原料药、辅料等生产过程有意添加则需检测; 第三类,口服给药对人体毒性较低,只需对注射给药及吸入给药途径中进行检测。由于药物制剂在原料药、生产等过程引入过量或有毒形态的元素杂质,均会对生命体产生重大影响,故为保证药品质量安全,须控制药物制剂中元素杂质的控制阈值为该元素 PDE 的 30%。
三 各类元素杂质在化学元素周期表的分布及引入途径
化学元素周期表目前包括 118种化学元素,根据原子序 数由小到大排列成表,共有 7 个横行为 7 个周期,有 18 个纵列为 18个族,每种元素均有其独特的结构组成及理化性质,同一族中元素性质相似,包括碱金属元素、碱土金属元素、过渡元素、主族金属元素、类金属元素、非金属元素、卤素及稀有气体。
元素杂质在化学元素周期表中主要分布于第四、五、六周期的过渡元素、主族金属元素、类金属元素和非金属元素,另有少部分碱金属元素、碱土金属元素。
1 过渡元素
过渡元素的原子半径较大,具有可变的氧化态和较好的配位性能 ,可以多样的配位形式与人体内的酶或蛋白质结合影响生理过程。ICH Q3D 将 16 种过渡元素定为元素杂质 ,其中位于第三过渡系的元素杂质由于原子半径更大,离子性降低而不易代谢,易在体内蓄积 ,毒性更大,如镉、汞对人体有剧毒,可造成肾脏、生殖系统等损伤,为第一类元素杂质; 而位于第一过渡系的钒、铬、钴、镍、铜、钼是人体必需的微量元素,但由于其不同的存在形态或含量对人体产生的影响不同,亦归属为元素杂质。过渡元素杂质引入药物制剂的途径及在不同给药途径的允许日暴露量( PDE) 见表 1。
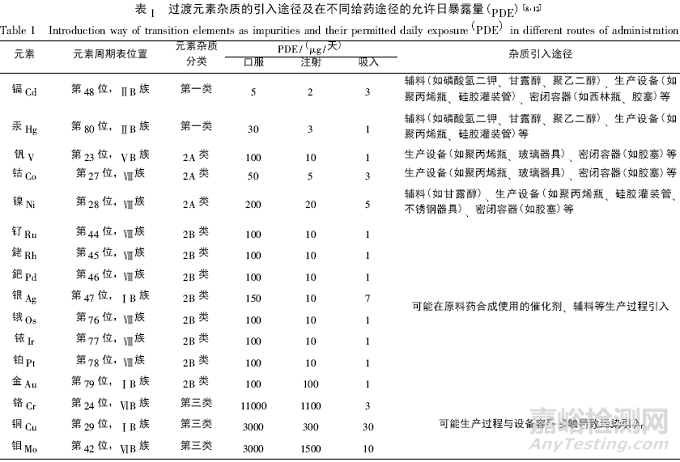
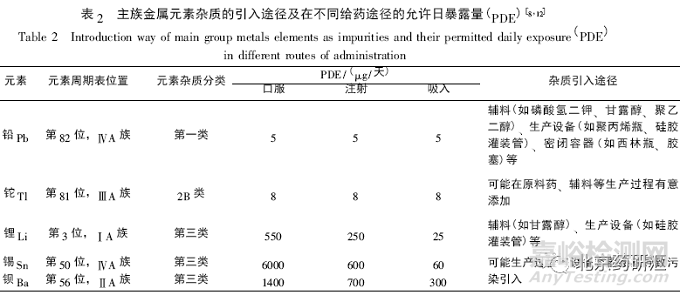
2 主族金属元素
ICH Q3D 将 1 种碱金属( 锂) 、1 种碱土金属( 钡) 及另外 3 种主族金属元素( 锡、铊、铅) 定为元素杂质,其中锡也是人体必需的微量元素。铅是一种对人体毒性极大的元素,可损害神经、消化和心血管等多个系统 为第一类元素杂质。主族金属元素杂质引入药物制剂的途径及在不同给药途径的允许日暴露量( PDE) 见表 2。
3 类金属元素
砷( As) : 位于化学元素周期表中第 33 位, A 族元素,砷是人体必需的微量元素,但由于砷在体内会蓄积,过量的砷会引发心血管系统疾病或癌症等 ,因此将砷定为第一类元素杂质,可能通过辅料( 如磷酸氢二钾、甘露醇、聚乙二醇)、生产设备( 如聚丙烯瓶、硅胶灌装管、玻璃器具) 、密闭容器( 如西林瓶、胶塞) 等引入药物制剂ICH Q3D 指出砷在不同给药途径中允许日暴露量( PDE) 分别为: 口服给药为 15 μg / 天,注射给药为 15 μg / 天,吸入给药为 2 μg / 天。
锑( Sb) : 位于化学元素周期表中第 51 位, A 族元素,其口服毒性较低,为第三类元素杂质,其可能引入药物制剂的途径与砷相似,ICH Q3D 指出锑在不同给药途径中允许日暴露量( PDE) 分别为:口服给药为 1200 μg/ 天,注射给药为 90 μg/ 天,吸入给药为 20 μg / 天。
4 非金属元素
硒( Se) : 位于化学元素周期表中第 34 位, A 族元素,是人体必需的营养元素之一,但若超过营养规定的水平就会造成中毒。其在药品中出现的可能性较低,为 2B 类元素杂质,可能在原料药、辅料等生产过程引入药物制剂,ICH Q3D 指出硒在不同给药途径中允许日暴露量( PDE) 分别为: 口服给药为2 μg / 天,注射给药为 80 μg / 天,吸入给药为 130 μg / 天。
四 元素杂质分析及控制讨论
药品质量不仅与元素杂质的总量有关,也与元素杂质的存,在形态有关 即同一元素在不同的价态或不同的分子组成形态时,其有效性或毒性不同,这主要由于化学元素周期表中各个元素的电子层排列方式不同影响稳定性造成。例如,钒是人体必需的微量元素,金属钒的毒性极低,但无机钒化合物却具有较高毒性,并且五价钒化合物的毒性远远大于三价钒化合物 ; 铅是一种有剧毒的重金属元素,其毒性大小与化学形态的关系表现为: 毒性大小烷基铅化合物>无机铅化合物>金属铅 ,烷基铅化合物中毒一般是急性中毒,严重影响神经系统并可能导致死亡; 汞的毒性大小与化学形态的关系表现为: 毒性大小有机汞化合物>无机汞化合物>单质汞,有机汞化合物能造成人体神经系统和血液系统的永久性损失,但有机汞化合物极少在药物中出现,无机汞化合物主要通过二价汞离子与含硫氨基酸配位结合导致蛋白质变性而影响人体生理过程,故在元素杂质检测时一般根据 Hg 2+ 。所以,研究元素杂质的存在形态对药品质量监控同样重要。
目前测定元素杂质最常用的手段为利用电感耦合等离子体-质谱法( ICP-MS) 或电感耦合等离子体原子发射光谱法( ICP-AES) 来检测多种元素杂质 ,利用原子吸收光谱法( AAS) 来检测单一的元素杂质 。我国于 2017 年 6 月批准加入ICH,国家药品监督管理部门与国际接轨,发布了 《已上市化学仿制药( 注射剂) 一致性评价技术要求( 征求意见稿) 》,其中明确提出要求按照 ICH Q3D 的规定对原料药、生产设备等可能引入的元素杂质进行控制和评估 。国家药典委员会在“《中国药典》2020 年版四部通则征求意见稿( 第三批) ”中的元素杂质限度和测定指导原则章节 指出按照 ICH Q3D 对化学药品中的元素杂质进行限度控制并明确规定了适用范围,提供了元素杂质限度的确认方法及控制办法等。
五 元素杂质风险评估
USP创建了一个考虑24种元素的风险评估表格。这些元素是USP<232>中列出的15种元素,加上其他9种元素,并根据毒性和出现在药品中的可能性将其分为以下几类:1、2A、2B和3。表1是基于不同的摄入途径——口服、注射或吸入,进行风险评估时需要考虑的元素种类。在评估中,如果某个元素是在生产过程中被有意添加的,那么制造商必须对其进行检测。如果元素并非有意添加的,则无需进行风险评估。由于可能的环境影响,砷、镉、铅和汞必须进行检测。
对需要测试的元素杂质进行评估是控制成本的重要步骤。当进行元素杂质测试时,每个元素必须根据其特定的分析风险和挑战分别进行考查。如果一个元素不是有意地添加到产品中的,则可根据药物的类型和其摄入方式来判断其是否需要进行测试。铜就是一个这样的元素,如果在生产过程中没有使用,则只需对吸入和注射用药进行测试。
每个元素都有自己的一系列潜在问题,例如,当测试汞时,必须添加金,如果同时也需要对金进行测试,就不能使用相同的样品制备方法。又如,对某些元素使用盐酸基质是有益的,然而添加盐酸又可能会对砷等元素造成干扰。
样品的制备是验证这些方法的关键,因此,对于24种待测元素的方法验证,可能需要多种样品制备方法。重要的是,为了避免对分析造成不必要地复杂化,要从一开始就考虑是否需要对24种元素全部进行测试。
六 结语
以 ICH Q3D 为监管指南和标准,严格监测和控制元素杂质在药物制剂中的总量,根据元素杂质不同存在形态对药品质量的影响制定合理的评估方案,分析元素杂质可能引入的途径来制定控制策略,如调整相关生产工艺、选择合适的容器设备等,以确保元素杂质水平控制符合限度要求,为药品质量监管提供有力保障。

来源:北京药研汇


