您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-02-28 10:07
法规要求
建立质量管理体系,首先是法规的要求。各个国家都有各自的法规监管医疗器械,我们国家法规对体系的要求主要是《医疗器械生产质量规范》及相关附录。美国的法规主要是QSR820,欧盟的医疗器械新法规中,对于质量管理体系也提出了他们的要求。
参考标准
了解了法规的要求,我们接下来了解可以参照什么样的标准来满足法规的要求。
ISO9000质量管理体系是一系列标准,是在1987年首先提出的概念,由国际标准化组织(ISO)制定的,可帮助企业实施并有效运行质量管理体系,是质量管理体系通用的要求和指南。我国在90年代将ISO9000系列标准转化为国家标准,随后,各行业也将ISO9000系列标准转化为行业标准,最新版的ISO9001:2015就被等同转化成GB/T 19001-2016 。
我们医疗器械企业要采用的标准是ISO13485,国内等同转化的标准是YY/T0287。标准的标题是“医疗器械 质量管理体系 用于法规的要求” 。为什么独立形成这么一个标准呢?是由于医疗器械是救死扶伤、防病治病的特殊产品,如果按ISO9000标准的通用要求来规范是不够的,所以为此ISO组织颁布了ISO13485,对医疗器械生产企业的质量管理体系提出了专用要求,促进企业持续生产安全有效的医疗器械。
现行的标准是YY/T0287-2017 IDT ISO13485:2016,在附录B中,列出了与GB/T 19001-2016的对应关系。

体系文件的构成
按照ISO13485的要求,质量管理体系文件大致可以分三级文件。
一级文件包括:质量手册、质量方针和质量目标
二级文件包括:程序文件
三级文件包括:管理制度、标准操作规程、检验规程、记录表单等
所以企业的文件按照所属关系,呈现出金字塔形状。质量手册作为纲领性的文件位于塔尖,第二层级是以质量手册为基础的程序文件,第底层是由大量的根据程序文件衍生出来的三级文件组成。
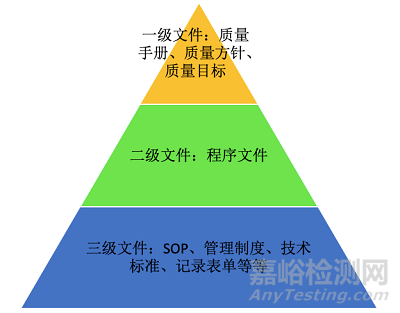
质量手册通常按照标准的条款进行编辑,下节课我们将详细介绍这些条款的要求。程序文件则是将这些条款进行详细的规定,涉及到具体的事项该如何按部就班地进行,就放在了三级文件中,所以大家会发现,公司的体系文件相互之间都是有联系的。
搭建满足要求的体系
我们的医疗器械要在国内上市,我们需要满足国内法规的要求,如果要去美国上市,就要满足美国法规的要求。那是不是我们要建立不同体系来分别满足不同国家的要求呢?
答案是否定的!我们并不需要为了满足不同的法规要求而建立多套体系。我们可以从不同法规和标准之间,找到它们的对应关系,比如下表是GMP、ISO13485和QSR820之间的对应关系,我们可以清楚得发现相关的要求是相通的。
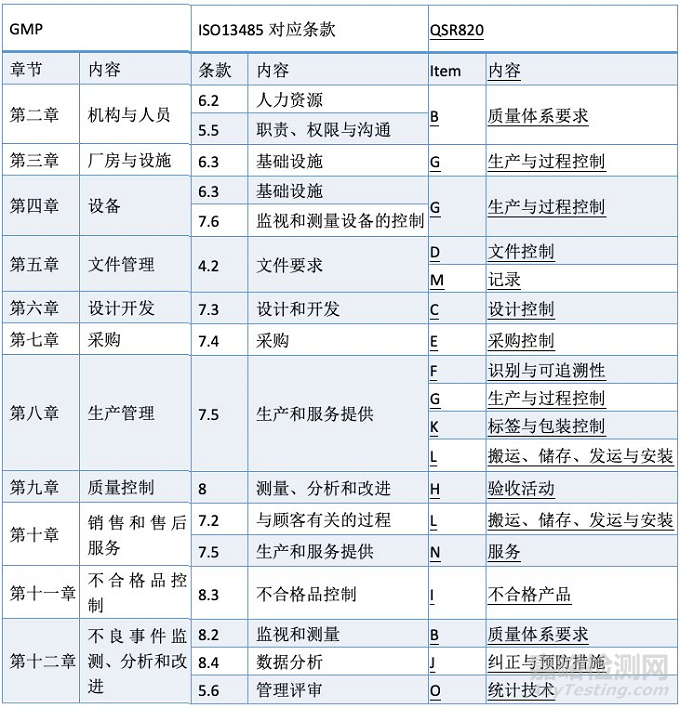
当然,其他的法规也有一些特殊要求,我们以两个主要市场为例:
美国FDA对于上报医疗器械事故报告有特殊要求
欧盟对医疗器械的监管方式有别于国内要求,所以他们也有特殊的要求,比如CE产品与体系变化要通知公告机构,上市后监督要如何进行等等
我们在搭建体系的时候,如果有其他国家法规的要求,我们就要将这些要求加进我们的体系里来。这样我们就可以用一套体系,既满足国内的要求,又满足了其他国家的要求。
结语
今天的微课就到这里,主要是介绍了医疗器械的质量管理体系要满足那些法规,可以参照的标准,以及如何搭建满足多个国家要求的体系。谢谢大家的观看,下期再见!

来源:启升资讯


