您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-25 08:59
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
赛诺菲PCSK9单抗即将国内上市。赛诺菲的PCSK9单抗阿利珠单抗(Alirocumab,Praluent)的上市申请审评状态已变更为"在审批",预计近期获批上市。PCSK9单抗是他汀类药物之后最被看好的一类降脂药,用于降低心血管事件风险、原发性高血脂症(含杂合子型家族性高胆固醇血症)、纯合子型家族性高胆固醇血症。目前,全球仅有两款PCSK9单抗上市,即赛诺菲和再生元联合研发的阿利珠单抗以及安进的依洛尤单抗,此前依洛尤单抗已经在国内上市,阿利珠单抗将成第2个在国内上市的PCSK9单抗。
国内药讯
1.益普生醋酸兰瑞肽缓释注射液获批。益普生(Ipsen)中国宣布,国家药监局已批准醋酸兰瑞肽缓释注射液(预充式)在手术和/或放射治疗后血液中生长激素(GH)和胰岛素样生长因子-1(IGF-1)水平仍然异常时,或不能进行外科手术和/或放射治疗的肢端肥大症的治疗。新获批的醋酸兰瑞肽缓释注射液(预充式)是技术上的一种改革,属于第一种即用的基于自组装纳米管技术的缓释制剂。目前产品有60mg、90mg及120mg三种规格。研究数据显示:生化控制好的患者可实现以120mg剂量每6周或8周一次延长注射间隔的方式给药。
2.海思科复方氨基酸注射液获批上市。海思科复方氨基酸注射液(18AA-IX)获国家药监局批准上市。复方氨基酸注射液(18AA-IX)是由必需氨基酸和非必需氨基酸组成的复方制剂,是目前国内唯一含18种氨基酸的肾病专用氨基酸输液,临床上用于急、慢性肾功能不全患者出现低蛋白血症、低营养状态和手术前后的氨基酸补充。该药原研厂家为日本味之素制药株式会社,目前还未获批进入国内市场。国内市场仅广州绿十字制药、辽宁海思科两家企业拥有该产品生产批件。
3.石药舒尼替尼胶囊有望拿下首仿。石药欧意4类仿制药苹果酸舒尼替尼胶囊的审评状态已变更为“在审批”,该药有望以首仿获批上市。苹果酸舒尼替尼是小分子多靶点受体酪氨酸激酶(RTKs)抑制剂,适用于进展期或对甲磺酸伊马替尼不耐受的胃肠道间质瘤(GIST)、晚期肾细胞癌(RCC)、肾细胞癌(RCC)肾上腺切除术后高复发风险成人患者的辅助治疗、无法切除的局部晚期或转移性胰腺神经内分泌肿瘤(pNET)等。该药原研药由辉瑞研发,于2006年1月获FDA批准上市,2007年11月获批进口中国,商品名索坦。2018年该产品全球销售额为10.49亿美元。
4.强生全球首款IL-23单抗审评进展。强生公司重磅自身免疫领域药物Tremfya (guselkumab) 上市申请审评状态更新为“在审批”,预计近日即将获批,获批适应症估计为中重度斑块型银屑病。Guselkumab与强生另一款重磅自免产品IL-12/IL-23单抗乌司奴单抗有差异,Guselkumab靶向于IL-23靶点亚基p19,在斑块型银屑病患者中,Guselkumab优于阿达木单抗和司库奇尤单抗,并显示出持久临床获益。2018年Guselkumab全年销售额5.44亿美元,2019年前9月销售额7.42亿美元,全年销售额将首次突破10亿美元。
5.拜奥新多系统萎缩新药在华获批临床。拜奥新医药旗下在研1类新药BHV3241缓释片(verdiperstat)获国家药监局临床试验默示许可,适应症为多系统萎缩(MSA)。BHV3241缓释片是一种口服髓过氧化物酶(MPO)抑制剂,最初由阿斯利康研发,拜奥新医药拥有其独家开发和推广许可。目前,BHV3241已获FDA授予孤儿药资格,在美国处于Ⅲ期开发阶段。一项Ⅱa期临床结果显示,BHV3241显著降低人体血液中的MPO活性(该药物与其靶标结合的生物标志物),研究中BHV3241显示出良好的安全性和耐受性。
国际药讯
1.首款血友病基因疗法在美申报上市。BioMarin公司向FDA递交其基因疗法valoctocogene roxaparvovec用于治疗A型血友病成年患者的上市申请。这也是FDA受理的首份血友病基因疗法上市申请。Valoctocogene roxaparvovec是一种使用AAV5病毒载体递送表达因子VIII的转基因的基因疗法,已获FDA授予的突破性疗法认定和欧盟授予的PRIME药品认定,以及EMA和FDA授予的孤儿药资格。一项Ⅰ/Ⅱ期临床数据显示,患者在接受一次剂量为6e13 vg/kg的基因疗法治疗后第三年,年出血率(ABR)和使用因子VIII的需求得到控制。在治疗过程中,ABR和因子VIII使用率都平均下降96%。患者不再需要预防性因子VIII注射。
2.卫材食欲素受体拮抗剂Dayvigo获批上市。卫材开发的食欲素(orexin)受体拮抗剂Dayvigo(lembroexant)获FDA批准上市,用于治疗失眠症成人患者。此次批准是基于两项关键性Ⅲ期研究(SUNRISE 2和SUNRISE 1)的结果。总计约2000例成人失眠患者参与评估Dayvigo与对照药物和安慰剂相比的疗效,研究结果表明,Dayvigo在主观和客观评价方面,均显示出与安慰剂相比,在入睡和睡眠维持方面的统计学显著性优势。
3.艾尔建口服CGRP受体抑制剂获批治疗偏头痛。艾尔建开发的降钙素基因相关肽(CGRP)受体拮抗剂Ubrelvy(ubrogepant)获FDA批准上市,用于治疗急性偏头痛。这也是FDA批准的首款口服CGRP受体拮抗剂。在两项临床试验中,接受Ubrelvy治疗的患者在接受治疗后两小时内达到无痛和其它偏头痛主要症状消失的比例都显著优于安慰剂组。除了艾尔建的Ubrelvy以外,Biohaven Pharmaceuticals的口服CGRP受体抑制剂rimegepant目前正在接受FDA的审评,有望明年初获批。
4.精神分裂症新药lumateperone获FDA批准。Intra-Cellular Therapies宣布FDA批准Caplyta(lumateperone)上市,用于治疗成人精神分裂症。Intra-Cellular计划在明年Q1将Caplyta推向市场。lumateperone是口服5-HT2A受体拮抗剂,相比安慰剂可以显著改善患者的PANSS(阳性和阴性症状量表)评分。与安慰剂相比更常见的不良反应包括嗜睡(24%vs10%)、口干(6%vs2%)。基于一些短期研究的合并分析数据显示,lumateperone治疗后较基线的体重、空腹血糖、甘油三酯、总胆固醇变化与安慰剂组相似,锥体外系症状的发生率相似(6.7%vs6.3%)。
5.罗沙司他在美国递交新药申请。珐博进向FDA递交了该公司与安斯泰来和阿斯利康联合开发的“first-in-class“低氧诱导因子脯氨酰羟化酶抑制剂罗沙司他(roxadustat)的新药申请,治疗因慢性肾病而引起贫血的透析/非透析患者。此前,罗沙司他已在中国获批治疗因慢性肾病而引起贫血的患者。2项Ⅲ期临床结果表明,与标准疗法阿法依泊汀相比,罗沙司他对透析患者的临床获益和副作用没有显著差别。对于未接受透析治疗的肾性贫血患者而言,罗沙司他可以使患者获得显著的临床疗效,有效纠正和维持肾性贫血患者血红蛋白水平。
6.罗氏获得一项杜氏肌营养不良症基因疗法。罗氏与Sarepta公司达成许可授权协议,罗氏将获得Sarepta公司拟用于治疗杜氏肌营养不良症(DMD)的基因疗法SRP-9001在美国以外地区的独家推广权益。Sarepta将获得总计11.5亿美元前期付款和潜在17亿美元的里程碑付款。SRP-9001是一款AAVrh74载体的基因疗法。早期临床研究结果显示,SRP-9001基因疗法不但表现出良好的安全性,而且在所有患者中都能够驱动微抗肌萎缩蛋白的表达,其平均值达到正常水平的74.3%。患者的的运动功能评分与基线相比也显示出明显的功能性改善。目前,SRP-9001正在Ⅰ/Ⅱ期临床中接受检验。
医药热点
1.中国疾病负担报告:脑血管疾病、冠心病和肺癌死亡位居前三。《2005~2017年中国疾病负担研究报告》在《中国循环杂志》公布。报告指出,2017年,我国脑血管疾病、缺血性心脏病、肺癌、慢阻肺和肝癌是导致我国居民寿命年损失、缩短生命长度的前五位死因。其中,缺血性心脏病死亡人数增幅最大,达54.5%。2017年,我国脑血管疾病死亡率为149.4/10万,占总死亡的20.2%。缺血性心脏病死亡率为123.9/10万,占总死亡的16.7%。慢阻肺死亡率为68.4/10万,占总死亡9.2%。肺癌死亡率为49.0/10万,占总死亡的6.6%。
2.二级以上医院要全考核合理用药。国家卫健委发布《关于做好医疗机构合理用药考核工作的通知》。《通知》指出,省级卫健行政部门要逐步提高辖区内各级各类医疗机构合理用药考核覆盖率。到2021年,基层医疗卫生机构、二级医疗机构和三级医疗机构考核覆盖率分别达到10%、30%和100%,到2022年分别达到20%和50%;到2023年,实现二级医疗机构考核全覆盖,基层医疗卫生机构考核覆盖率达50%,并逐年提高。《通知》明确,合理用药考核结果将纳入医疗机构绩效考核内容。
3.重庆全面取消公立医疗机构医用耗材加成。从12月22日起,重庆公立医疗机构医用耗材取消加成,实行零差率销售,并同步调整一批医疗服务项目价格。本次重庆公立医疗机构取消医用耗材加成而减少的收入,将通过调整手术治疗类医疗服务项目价格进行补偿。同时,对涉及中医和儿科类项目给予价格政策倾斜。对部分项目如涉及特殊群体、明显高于外省市价格、单次绝对增幅较大的医疗服务项目,按照专家论证会以及听证会建议并参考周边省市平均价格采取价格不动、限价或封顶限价等具体处理。
股市资讯
【康弘药业】(1)子公司康弘生物获得“康柏西普眼用注射液”的药品补充申请批件。(2)康柏西普眼用注射液用于治疗湿性年龄相关性黄斑变性(nAMD)的全球Ⅲ期临床试验受试者入组人数已达到临床试验方案要求总数的100%。
【东阳光】截至2019年12月24日,累计回购股份9106.43万股(总股本3.02%),支付7.74亿元。
【亚太药业】公司对上海新高峰及其子公司失去控制。
审评动向
1. CDE最新受理情况(12月24日)
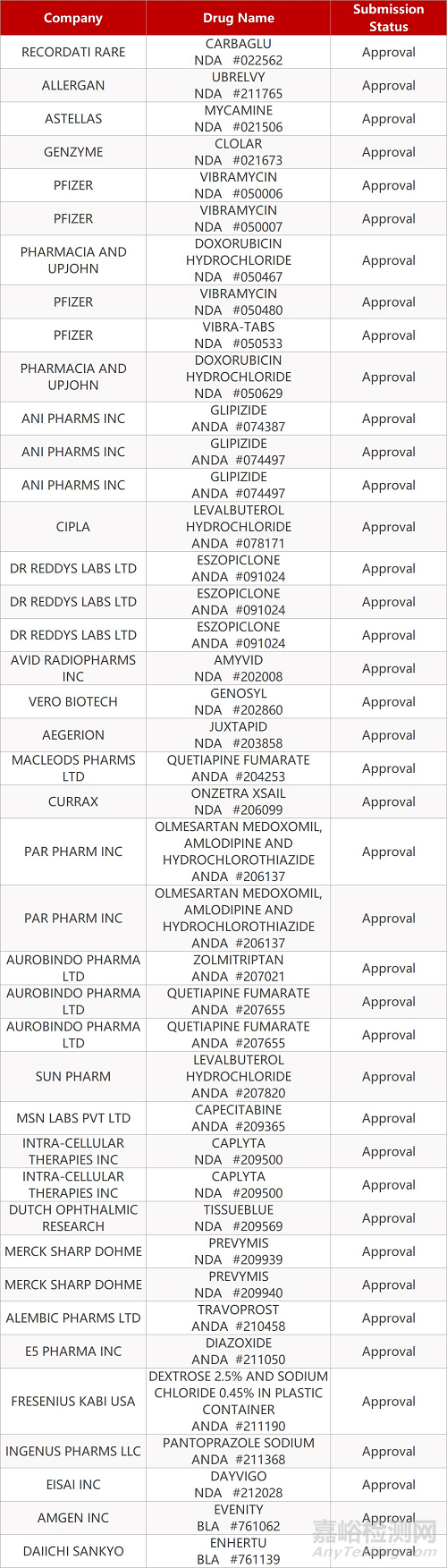
2. FDA最新获批情况(北美12月22日)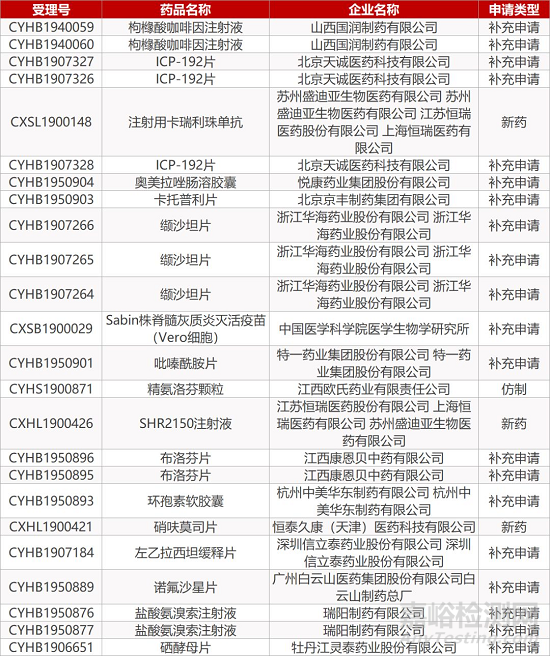

来源:药研发


