您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-09-25 22:22
确认和验证的范围和程度应根据风险评估的结果确认并不仅仅是一句法规要求,还是一种对验证应科学合理而不是一味浪费做一些无效验证的期望。
例如:使用相同的缓释微丸灌装不同规格产品,产品规格与微丸灌装量成正比。工艺验证可采用括号法减少中间规格验证批次,验证批次包括至少3批缓释微丸的工艺验证,胶囊灌装工艺验证选择最高、最低规格各3批,中间规格各1批。
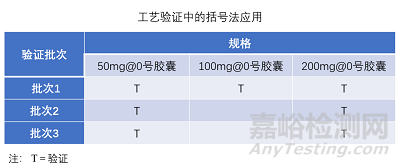
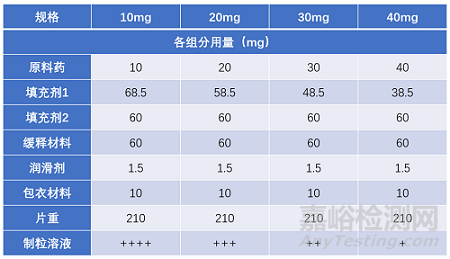
例如:采用湿法制粒工艺制备的亲水凝胶骨架缓释片,不同规格间通过调整填充剂1的处方用量使得片重保持相同。此外,不同规格制粒工艺还包括不同制粒溶液使用量这一变量,且中间规格制粒溶液使用量在高低规格制粒溶液使用量范围内。此产品工艺验证可采用矩阵法减少中间规格验证批次,验证批次选择最高、最低规格各3批,中间规格各1批。
例如,口服溶液剂,不同规格间灌装体积和灌装浓度不同。由于高低规格产品工艺包括了灌装体积和灌装液浓度的极端状态,此产品工艺验证可采用矩阵法减少中间规格验证批次,验证批次选择最高、最低规格各3批,中间规格根据评估至少各1批。

例如,含有缓释微丸的缓释胶囊,使用相同的缓释微丸灌装不同规格产品,产品规格与微丸灌装量成正比。由于微丸处方、批量、工艺等变更,但后续灌装工艺未发生变更,此种情况变更后的验证选择变更后缓释微丸的工艺验证,以及代表性规格的胶囊灌装工艺验证。
这些方法均需在充分风险评估的基础上进行。以下是有关这些方法的法规或指南描述。
EU GMP 附录15
Bracketing approach.
括号法(分组法)
A science and risk based validation approach such that only batches on the extremes of certain predetermined and justified design factors, e.g. strength, batch size and/or pack size, are tested during process validation. The design assumes that validation of any intermediate levels is represented by validation of the extremes. Where a range of strengths is to be validated, bracketing could be applicable if the strengths are identical or very closely related in composition, e.g. for a tablet range made with different compression weights of a similar basic granulation or a capsule range made by filling different plug fill weights of the same basic composition into different size capsule shells. Bracketing can be applied to different container sizes or different fills in the same container closure system.
一种基于风险的科学验证方法,采用该方法进行工艺验证的过程中,只对预定或经过论证的设计因素,例如,剂量、批量和/或包装规格,的极端条件进行测试。该设计假定所有中间水平的验证可以由极端情况的验证来代表。如果要验证的是一个范围的剂量,这些剂量的组成是相同的或相近的,例如,有类似的基本制粒过程,但片重不同的一系列片剂,或具有相同的基本组成,都是采取填充形式装入不同大小的胶囊壳中的胶囊制剂,就可以应用分组法,括号法可以用于不同包装规格或同一容器密闭系统里不同灌装规格。
APIC 原料药清洁验证指南
7.0 分组法(括号法)
The cleaning processes of multiple product use equipment in API facilities are subject to requirements for cleaning validation. The validation effort could be huge. In order to minimize the amount of validation required, a worst case approach for the validation can be used.
原料药工厂中的多产品设备清洁要求进行清洁验证。清洁工作量会比较大。为了减少验证的工作量,可以采用最差情形方法进行验证。
By means of a bracketing procedure the substances are grouped.
采用分组法时,物质按类进行分组。
A worst case rating procedure is used to select the worst case in each group.
然后在每组中采用最差情形分级法选择各组中最差的情况。
Validation of the worst case situation takes place. However, it is of utmost importance that a documented scientific rational for the chosen worst cases exists.
对最差情形进行验证。至关重要的是,选择最差情形的科学合理性要进行记录。
This chapter gives an overview of the suggested work to be carried out, the acceptance criteria and the methodology for evaluation of the data. It should be emphasized that this is only an example to give guidance. The equipment, the substances produced and the procedures in place may vary; and this results in other solutions than those given in this example.
本章介绍了所需要进行的工作、可接受标准和数据评估方法。需要强调的是,这只是一个指导性的例子,而实际情况下,设备、生产的物质和清洁程序可能有所不同,则可能需要采用与例中不同的解决方案。
The worst case rating priority will then support a conclusion that the cleaning procedures are effective for all drug substances and other chemicals within the bracket, including those not individually tested.
最差情形分级优先性是用来支持清洁方法对组内所有原料药和化学物均有效的结论的,包括那些并没有进行单独检测的物质。
中国GMP 附录 确认与验证
第二十一条 采用新的生产处方或生产工艺进行首次工艺验证应当涵盖该产品的所有规格。企业可根据风险评估的结果采用简略的方式进行后续的工艺验证,如选取有代表性的产品规格或包装规格、最差工艺条件进行验证,或适当减少验证批次。
PDA TR01 湿热灭菌程序的验证
PDA TR01 湿热灭菌程序的验证:灭菌程序的设计、开发、确认以及日常控制
5.4 等效灭菌器
两个或多个设计相似的灭菌器(包括它们相关的公用设施),可确立它们运行的等效性,并减少工艺确认试验的工作量。建议采用比较系统、完善的风险管理方法来证明这一做法的合理性。例如,如果含有多个参数难于控制的灭菌工艺(如预真空工艺),与参数易于控制的灭菌工艺相比,确定等效要困难得多。要减少确认试验,可能需监管部门的批准。在开始时,所有灭菌器必须通过确认灭菌器的运行参数以证明灭菌器之间的等效性。
使用相同的灭菌参数、装载结构(如产品、处方、容器规格、灌装体积、胶塞、设备或装载方式)并对灭菌器运行的结果进行比较,可确定灭菌器之间运行的等效性。用以进行等效比较的标准还应该包括关键和重要参数、热分布、热穿透、 F0 范围和微生物的灭活情况。
5.5 分组法
可以将产品处方设计、容器规格、灌装体积、物品或装载分组,以减少确认的工作量。分组法分可为单端分组法(要求鉴别出最差情况)和双端分组法(要求对被灭菌品的结构和配置加以确认)。最差情况的挑战试验需根据科学原理实施,或通过热穿透或生物灭活试验来确定。
5.5.1 典型产品法
可采用典型溶液法( master solution approach) 将处方分组,进行生物指示剂确认。将挑战微生物试验中耐热性最大的产品作为一个典型,来代表耐热性差的各种处方的产品。通常用耐热性测试仪来测定耐热性。关于耐热性的测试详见 3.1.1 节 D 值的测试。
可采用典型溶液法将处方分组,进行物理确认。处方中粘度最大的产品的确认可以涵盖低粘度的产品。
5.5.2 典型容器规格/装量法
如果采取同一个灭菌参数,则可将设计类似、不同规格和装量的液体分为一组。采用该方法时, 用最大装量的最大容器和最小装量的最小容器作为代表来确认中等规格及中等容器的产品。
5.5.3 典型物品法
也可考虑多孔/坚硬装载的代表性问题。即用最难灭菌的物品来代表较易灭菌的物品。例如,相同材料、直径、管壁厚度、 相同的放置方向及包扎的待确认管子,如果长度不同,则可用最长的管子为代表,来确认较短的管子。
5.5.4 典型装载法
多孔/坚硬装载进行分组确认,要求对物品作最长加热时间(因质量大)和/或最小和最大装载条件下空气去除的确认试验。就最小装量而言,在确认时,可能只需要做腔室的最大加热和/或空气去除的挑战性试验。
如需操作的灵活性,而导致装载规格/大小变化时,应确定最小及最大装载。每个灭菌器,至少进行三次连续的生物指示剂合格试验。对没有固定的加热及冷却速率/次数的灭菌程序而言, 最低装量通常需要进行低热量输入的确认试验, 而最大装载则应当进行挑战试验。如果进行风险评估且认为符合要求时,重复试验可以减少。
CFDI《工艺验证检查指南》2025
首次工艺验证应当涵盖产品的所有规格,可根据风险评估的结果采用简略的方式(如括号法、矩阵法)进行后续的工艺验证,如选取有代表性的产品规格或包装规格、最差工艺条件等进行验证,或适当减少验证批次。
...
多规格产品工艺验证:
经过充分科学论证,基于风险评估,采用括号法、矩阵法等简略的方法可以减少部分规格的工艺验证批次。选择代表性验证规格和批数的理由应当在验证总计划和工艺验证方案中概述,并应当考虑在后续常规的商业规模生产时对所有规格进行补充验证,经风险评估采用合适的验证方法。括号法策略适用于单个工艺元素可变,但其它全部可变条件保持固定的情况下。当制剂不同规格产品间所有非活性和活性组成比例完全相同时,可考虑使用括号法。例如使用相同的终混物(可以是粉末、颗粒或微丸),压制成不同规格的药片或灌装成不同规格颗粒剂或灌装成不同规格胶囊剂。
矩阵法适用于不同规格产品间有多于一种变化时的工艺验证。该方法基于的假设是选定的验证规格和批次可代表所有组合情况。
括号法、矩阵法用于稳定性试验设计
Eine maßgebliche Grundlage für beide Konzepte bildet die Leitlinie ICH Q1A (R2) – Stability Testing of New Drug Substances and Products. Dort werden Bracketing und Matrixing wie folgt definiert:
这两个概念的一个重要基础是 ICH Q1A (R2) 指南 ——《新药原料药和产品的稳定性测试》。在该指南中,括号法(Bracketing)和矩阵法(Matrixing)定义如下:
Bracketing: The design of a stability schedule such that only samples on the extremes of certain design factors, e.g., strength, package size, are tested at all time points as in a full design. The design assumes that the stability of any intermediate levels is represented by the stability of the extremes tested. Where a range of strengths is to be tested, bracketing is applicable if the strengths are identical or very closely related in composition (e.g., for a tablet range made with different compression weights of a similar basic granulation, or a capsule range made by filling different plug fill weights of the same basic composition into different size capsule shells). Bracketing can be applied to different container sizes or different fills in the same container closure system.
括号法:一种稳定性测试计划的设计,即只有某些设计因素(如效价、包装尺寸)的极限值样本,像在完整设计中那样在所有时间点进行测试。该设计假设任何中间水平的稳定性由所测试的极限值的稳定性来代表。当要测试一系列效价时,如果这些效价在成分上相同或非常密切相关,括号法是适用的(例如,对于由相似基本颗粒的不同压片重量制成的一系列片剂,或者对于通过将相同基本成分的不同填充重量填充到不同尺寸胶囊壳中制成的一系列胶囊)。括号法可以应用于不同的容器尺寸或同一容器密封系统中的不同填充量。
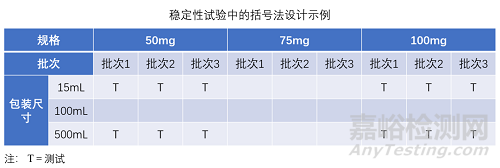
Bracketing ist also eine Designstrategie, bei der nur die Extrema (z. B. höchste und niedrigste Wirkstärke, größte und kleinste Packungsgröße) einer Produktreihe getestet werden. Die Annahme hierbei ist, dass die Stabilität der mittleren Ausprägungen durch die getesteten Extreme repräsentiert wird.
因此,括号法也是一种设计策略,其中仅对一系列产品的极限值(例如,最高和最低效价、最大和最小包装尺寸)进行测试。这里的假设是,中间表现的稳定性由所测试的极限值来代表。
Matrixing: The design of a stability schedule such that a selected subset of the total number of possible samples for all factor combinations is tested at a specified time point. At a subsequent time point, another subset of samples for all factor combinations is tested. The design assumes that the stability of each subset of samples tested represents the stability of all samples at a given time point. The differences in the samples for the same drug product should be identified as, for example, covering different batches, different strengths, different sizes of the same container closure system, and, possibly in some cases, different container closure systems.
矩阵法:一种稳定性测试计划的设计,即在指定时间点测试所有因素组合的所有可能样本总数中的选定子集。在随后的时间点,测试所有因素组合的另一个样本子集。该设计假设,所测试的每个样本子集的稳定性代表给定时间点所有样本的稳定性。同一药品的样本差异应被识别为,例如,涵盖不同批次、不同效价、同一容器密封系统的不同尺寸,并且在某些情况下可能是不同的容器密封系统。
Matrixing beruht darauf, dass nur ein Teil der gesamten Stichprobenkombinationen zu bestimmten Zeitpunkten getestet wird. Die getesteten Proben sind dabei so ausgewählt, dass alle Kombinationen im Lauf der Studie mindestens einmal getestet werden. Matrixing eignet sich besonders für Produkte mit vielen Variablen (Chargen, Behältnistypen, Füllmengen etc.).
矩阵法基于这样一点,即在特定时间点仅测试所有样本组合的一部分。所测试的样本使得所有组合在试验过程中至少被测试一次。矩阵法特别适用于具有许多变量(批次、容器类型、填充量等)的产品。
Genauere Empfehlungen zur Anwendung von Bracketing und Matrixing auf Stabilitätsstudien findet man in der ICH Q1D – Bracketing and Matrixing designs for Stability Testing of Drug Substances and Drug Products. Sie enthält unter anderem Beispiele für Tabellenlayouts und benennt Aspekte, die bei der Planung berücksichtigt werden sollten. Zudem erläutert sie, unter welchen Voraussetzungen reduzierte Designs zulässig sind, welche statistischen Überlegungen angestellt werden müssen und in welchen Fällen ein konventioneller Vollversuchsansatz vorzuziehen ist.
关于括号法和矩阵法在稳定性试验中的应用的更详细建议,可以在 ICH Q1D——《原料药和药品稳定性测试的括号法和矩阵法设计》中找到。它尤其包含表格布局的示例,并指出在规划时应考虑的方面。此外,它解释了在哪些条件下简化设计是允许的,必须进行哪些统计考量,以及在哪些情况下传统的完整试验方法更可取。
Ergänzend zu ICH Q1A (R2) und Q1D liefert die Leitlinie ICH Q1E – Evaluation of Stability Data wichtige Vorgaben zur statistischen Auswertung von Stabilitätsdaten. Sie ist von zentraler Bedeutung für die Beurteilung, ob die auf Basis eines Bracketing- oder Matrixing-Designs erhobenen Daten ausreichen, um die Haltbarkeitsdauer eines Produkts zu begründen.
作为对 ICH Q1A (R2) 和 Q1D 的补充,ICH Q1E 指南 ——《稳定性数据评估》提供了关于稳定性数据统计评估的重要规定。它对于评估基于括号法或矩阵法设计收集的数据是否足以证明产品的有效期至关重要。
Beide Strategien setzen voraus, dass die zugrunde gelegten Annahmen durch vorliegende Daten gestützt oder im Rahmen einer Risikobewertung nachvollziehbar gerechtfertigt werden. Besonders wichtig ist, dass Bracketing und Matrixing nicht ohne fundierte Begründung angewendet werden dürfen. Die Auswahl der Proben und die Teststrategie müssen dokumentiert und wissenschaftlich untermauert sein – insbesondere, wenn beide Strategien kombiniert zum Einsatz kommen.
这两种策略都要求,所基于的假设由现有数据支持,或者在风险评估的框架内得到合理的解释。特别重要的是,括号法和矩阵法不得在没有充分理由的情况下应用。样本的选择和测试策略必须有记录并在科学上得到支持 —— 特别是当两种策略结合使用时。
So heißt es in der ICH Q1D beispielsweise:
例如,ICH Q1D 中是这样说的:
Whether bracketing or matrixing can be applied depends on the circumstances [...]. The use of any reduced design should be justified.
是否可以应用括号法或矩阵法取决于具体情况 [...]。任何简化设计的使用都应该有合理的理由。
Bracketing and matrixing are reduced designs based on different principles. Therefore, careful consideration and scientific justification should precede the use of bracketing and matrixing together in one design.
括号法和矩阵法是基于不同原则的简化设计。因此,在一个设计中同时使用括号法和矩阵法之前,应该进行仔细的考虑和科学的论证。
The use of a bracketing design would not be considered appropriate if it cannot be demonstrated that the strengths or container sizes and/or fills selected for testing are indeed the extremes.
如果不能证明为测试选择的效价或容器尺寸和 / 或填充量确实是极限值,那么括号法设计的使用将不被认为是合适的。
Matrixing is appropriate when the supporting data exhibit only small variability. However, where the supporting data exhibit moderate variability, a matrixing design should be statistically justified. If the supportive data show large variability, a matrixing design should not be applied.
当支持数据仅表现出小的变异性时,矩阵法是合适的。然而,当支持数据表现出中等变异性时,矩阵法设计应该在统计上得到证明。如果支持数据显示出大的变异性,则不应使用矩阵法设计。
Die ICH Q1D macht somit deutlich: Die Variabilität der Stabilitätsdaten ist ein entscheidender Faktor bei der Entscheidung für oder gegen Matrixing. Nur wenn die Daten eine geringe Streuung aufweisen, darf auf eine vollständige Testung verzichtet werden. Bei hoher Variabilität besteht hingegen das Risiko, dass degradative Prozesse oder Trends in nicht geprüften Kombinationen unentdeckt bleiben.
因此,ICH Q1D 明确指出:稳定性数据的变异性是决定是否采用矩阵法的一个关键因素。只有当数据的离散度较小时,才可以放弃完整的测试。另一方面,在高变异性的情况下,存在未测试组合中的降解过程或趋势未被发现的风险。
Auch Bracketing ist nicht ohne Einschränkungen anwendbar: Die getesteten Proben müssen nachweislich die Extrema darstellen – z. B. im Hinblick auf Wirkstoffkonzentration, Füllmenge oder Behältnisgröße. Andernfalls besteht die Gefahr, dass relevante Stabilitätsprobleme im mittleren Bereich nicht erfasst werden.
括号法的应用也不是没有限制的:所测试的样本必须被证明是极限值 —— 例如,在活性物质浓度、填充量或容器尺寸方面。否则,存在中间范围内相关稳定性问题未被发现的风险。

来源:GMP办公室


