您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-09-24 19:46
摘要
目的:分析我国生物制品药物研发情况,为我国生物制品的研发和发展方向提供建议与参考。
方法:收集2013—2022年在我国国家食品药品监督管理总局药品审评中心(CDE)信息公示平台中登记的生物制品类药物的临床试验信息,从临床试验情况、涉及靶点和适应证领域分布等方面对我国生物制品药物临床试验的现状进行分析。
结果:共纳入3863项生物制品临床试验,2013—2022年,我国各年登记的生物制品临床试验数量总体呈上升趋势,试验申请主体以国内申请人为主(83.92%);已完成的临床试验有979项(占25.34%),I期临床试验占比最高(37.77%);适应证主要集中在肿瘤领域(44.42%);靶点主要集中在PD-1(程序性死亡蛋白-1)、PD-L1(程序性死亡配体-1)、VEGF/VEGFR(血管内皮生长因子/血管内皮生长因子受体)等;靶点丰度为6.90%;单靶点和多靶点生物制品临床试验分别有2474、354项;联合开发的靶点以PD-1和CTLA-4(细胞毒性T淋巴细胞相关抗原-4)、TGF-β(转化生长因子-β)和PD-L1等为主。
结论:我国生物制品临床试验发展态势蓬勃,但生物制品研发靶点和适应证同质化严重、靶点丰度低,临床试验效率有待提高。
关键词
生物制品;临床试验;适应证;靶点;趋势
生物制品产业被誉为21世纪最有前途的产业之一,在我国创新战略中占据重要位置。生物制品是我国医药产业最有希望实现跨越式发展、“弯道超车”的领域,“十一五”以来,我国出台了多项政策助推生物制品发展,生物制品领域近年来取得了一系列重大突破。但目前尚未见到我国生物制品研发靶点及其适应证分布领域、临床试验状态、试验分期等方面的数据汇总和相关分析。从2017年国务院印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和有关改革药品审评审批制度的意见中,我们可以看出药物临床试验的注册开展情况是国家医药创新环境和改革成效的重要参考和视角,也是未来医药创新趋势和药品监管思路的重要指导。
生物制品药物临床试验一定程度上能够反映我国生物制品研发现状。基于此,本研究借鉴国内外学者的分析方法,基于我国药物临床试验登记与信息公示平台,对我国生物制品药物临床试验发展现状进行了分析,以期为促进我国生物制品的开发、临床资源的配置和药品的审评等提供参考。
资料与方法
资料来源
我国《药品注册管理办法》第三十三条要求:“申办者应当在开展药物临床试验前在药物临床试验登记与信息公示平台登记药物临床试验方案等信息,登记信息在平台进行公示,申办者对药物临床试验登记信息的真实性负责”。国家药品监督管理局药品审评中心(Center for Drug Evaluation,CDE)基于我国药物临床试验数据库搭建了药物临床试验登记与信息平台(以下简称“CDE平台”),要求凡获国家食品药品监督管理总局临床试验批件并在我国进行临床试验的,均应在该平台进行登记与信息公示,因此本研究选择该平台收集数据。
在CDE平台检索药物类型为“生物制品”的临床试验信息,检索时间为2013年1月1日至2022年12月31日,通过八爪鱼数据挖掘软件提取临床试验的相关信息,包括:药物名称、登记号、首次公示日期、试验题目、申办者、试验目的、适应证、试验分期、设计类型、随机化、盲法和试验范围等。
数据处理
药物临床试验的研究疾病领域根据第11版《国际疾病分类》(International Classification of Diseases:11th edition,ICD-11)的疾病分类标准划分;临床试验靶点参考国际非专利名称(international nonproprietary names,INN)中的生物药类别进行分类。采用Excel软件对数据进行汇总和分类,剔除不涉及生物制品或信息不明确的临床试验项目;采用开源软件Gephi V0.9.2对生物制品临床试验靶点的合作情况进行社会网络分析。
文章内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明【来源:凡默谷公众号】。
结果
我国生物制品临床试验概况
截至2022年年底,我国CDE平台共有3863项生物制品的临床试验登记在册。
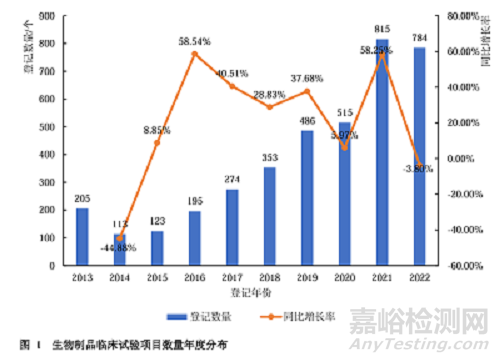
1 临床试验数量
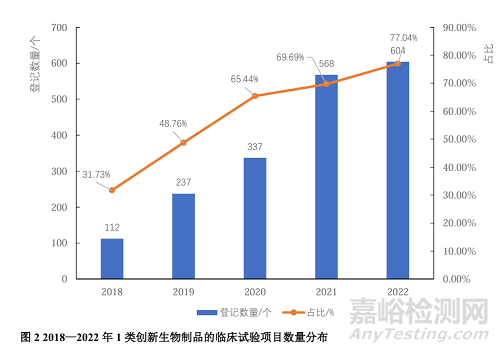
2013—2022年各年在CDE平台上登记的生物制品临床试验数量见图1。由图1可见,2013—2021年,各年在CDE平台上登记的生物制品临床试验数量整体呈增长趋势,并在2021年达到峰值,高达815项,较2020年同比增长了58.25%;2022年则稍有回落,当年登记的生物制品临床试验为784项。其中,2022年登记的784项生物制品临床试验中,1类创新药有604个,占比达77.04%。见图2。
2 临床试验状态
3863项生物制品临床试验中,截至2022年年底已完成的临床试验有979项,占比25.34%。试验状态为进行中的药物临床试验项目最多,登记数量2763项,占比71.52%,其中处于招募中的临床试验1432项(37.07%)、招募完成1027项(26.59%)和尚未招募304项(7.87%)。其余临床试验状态依次为主动终止(54项,1.40%)、主动暂停(65项,1.68%)、责令暂停(1项,0.03%)和独立伦理委员会(Independent Ethics Committee,IEC)/机构审查委员会(Institutional Review Board,IRB)暂停(1项,0.03%)。
3 临床试验分期
临床试验分期类型分为I期、II期(包括I/II期和II期)、III期(包括II/III期和III期)、IV期及其他(包括生物等效性试验、同情用药、安全性研究等)。根据试验分期对3863项生物制品临床试验进行分类汇总,可以发现,I期临床试验所占比例最高,登记数量为1459项,占比达37.77%;其次为III期临床试验(1243项,32.18%)、II期临床试验(858项,22.21%)、其他(169项,4.37%)和IV期临床试验(134项,3.47%)。
4 临床试验类型
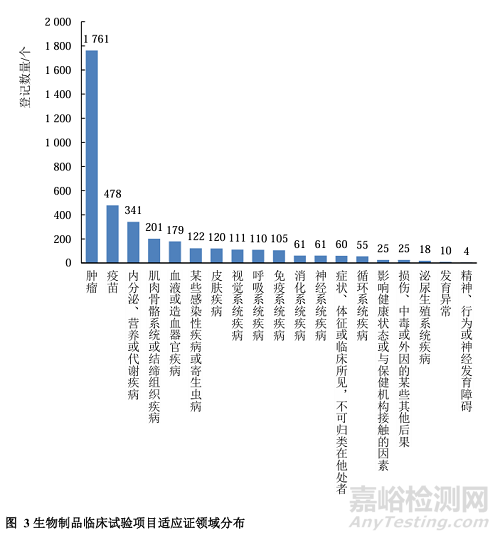
我国生物制品药物临床试验项目登记以国内试验为主,登记数量为3242,占83.92%,其次为国际多中心试验,有621项,占16.08%。5适应证分布3863项生物制品临床试验中有确定适应证的3847项按适应证进行分类,适应证为肿瘤的临床试验数量最多(以肺癌为主),为1761项(占45.78%),其次为疫苗(478项,占比12.43%)和内分泌、营养或代谢疾病(341项,占比8.86%)。见图3。
生物制品临床试验的作用靶点情况
1 靶点种类及适应证领域分析
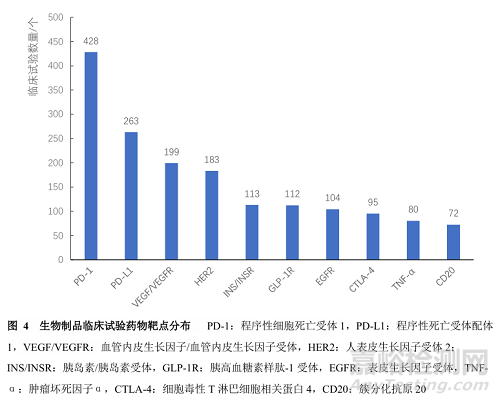
3863项生物制品临床试验中,有3233项临床试验可知明确的作用靶点,涉及的靶点共有223种,靶点丰度(靶点种类与靶向生物制品临床试验数量的比值)为6.90%(223/3233)。靶点主要集中在程序性细胞死亡受体1(programmed cell death receptor 1,PD-1)、程序性死亡受体配体1(programmed death receptor ligand 1,PD-L1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)/血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR),相关生物制品数量分别多达428个(占13.24%)、263个(占8.13%)、199个(占6.16%)。见图4。从靶点所对应的适应证领域来看,相关靶点主要集中在抗肿瘤领域,相关生物制品临床试验数量达1665项,占51.50%;其次为内分泌、营养或代谢疾病领域,相关生物制品临床试验数量为283项,占8.75%。
2 靶点种类年度数量分布
按照INN分类,我国生物制品临床试验的靶点可分为抗体类、融合蛋白类、基因治疗类和细胞治疗类,其年度数量分布如图5所示。抗体类主要以PD-1、PD-L1、HER2、EGFR等靶点为主;融合蛋白类主要以TNF、VEGFR和细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte antigen4,CTLA-4)等靶点为主;基因治疗类的临床试验较少,主要以靶向凝血因子和集落刺激因子(colony stimulating factor,CSF)系列基因为主;细胞治疗类靶点从2018年开始出现,主要以簇分化抗原19(CD19)和B细胞成熟抗原(B cell maturation antigen,BCMA)为主。
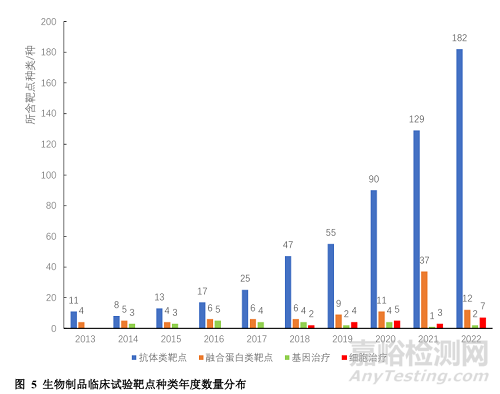
3 生物制品临床试验数量排前10位的靶点
我国生物制品临床试验前10位的靶点分别是PD-1、PD-L1、VEGF/VEGFR、HER2、INS/INSR、GLP-1R、EGFR、CTLA-4、TNFα、CD20,涉及临床试验数量共计1649项(图6)。其中,靶点为PD-1和PD-L1的临床试验主要为Ⅲ期试验,分别为40.6%(174/428)和30.0%(79/263),VEGF/VEGFR的Ⅰ期临床试验数量占比最多,为38.2%(76/199)。
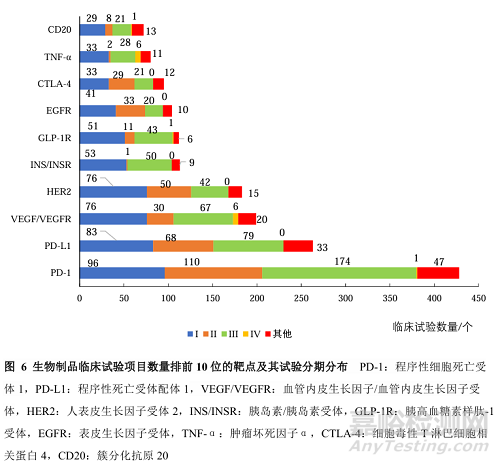
临床试验数量排前10位的靶点中,有8个靶点的生物制品的适应证涉及肿瘤,相关临床试验共有1230项(1230/1649,74.59%);3个靶点涉及内分泌、营养或代谢疾病,相关临床试验共有222项(222/1649,13.46%);2个靶点涉及视觉系统疾病,相关临床试验共有93项(93/1649,5.64%);4个靶点涉及肌肉骨骼系统或结缔组织疾病,相关临床试验共有68项(68/1649,4.12%)等。其中,针对PD-1、HER2和EGFR靶点的生物制品,其适应证均为肿瘤,这3个靶点的生物制品临床试验数量分别为428、183和104项;针对VEGF/VEGFR靶点的生物制品适应证主要为肿瘤和视觉系统疾病,临床试验数量分别有106、91项;针对INS/INSR、GLP-1R靶点的生物制品适应证主要为内分泌、营养或代谢疾病,临床试验数量分别有111、109项;针对TNF-α靶点的生物制品适应证主要集中在肌肉骨骼系统或结缔组织疾病,临床试验数量有61项;其余靶点也主要集中在肿瘤领域。
4 靶点网络分析
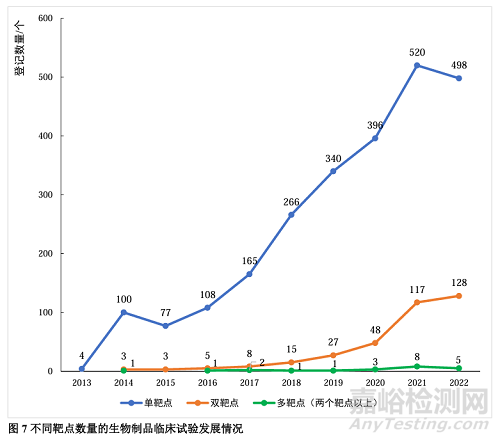
从生物制品的靶点数量来看,单靶点生物制品的临床试验登记数量远超于双靶点和多靶点药物。单靶点生物制品的临床试验项目除2015和2022年略有下降外,一直呈大幅增长趋势;双靶点和多靶点生物制品的临床试验登记数量较少,但在2020年之后年增长速度有所加快。见图7。
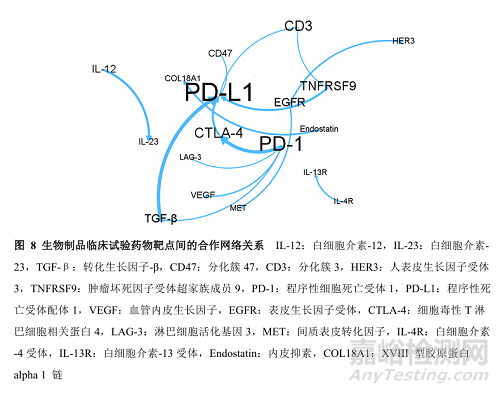
应用GephiV0.9.2软件对临床试验中各靶点的合用关系进行分析,得到合用关系图(图8)。其中,靶点节点加权度越大,则靶点的节点越大(图8中以字号大小反映),表明该靶点与其他靶点的合用次数越多;边权重代表了两靶点之间的合用次数,边权重越大,表明两靶点之间的合用次数越多(图8只显示了边权重超过6的靶点)。图8中,节点较大的靶点有PD-L1、PD-1、CD3、CTLA-4、VEGF等,表明这些靶点与其他靶点的合作次数较多;边权重较大的有PD-1和CTLA-4、转化生长因子-β(transforming growth factor-β,TGF-β)和PD-L1、白细胞介素12(interleukin 12,IL-12)和IL-23、肿瘤坏死因子受体超家族成员9(tumor necrosis factor receptor superfamily9,TNFRSF9)和PD L1、CTLA-4和PD-L1,表明这些靶点之间的合用较为紧密。
讨论
临床试验数量总体呈增长趋势
本文统计结果显示,2013年建库至2022年底,我国CDE平台共登记生物制品临床试验3863项,各年度临床试验数量总体呈现出增长的趋势。2013年登记数量较多的原因可能是当年原国家食品药品监督管理总局发布公告,强制要求凡获临床试验批件并在我国进行临床试验的,均应在平台进行登记与信息公示;2020年较2019年上升幅度较小,2021年较2020年大幅增加,这可能是受到2020年颁布的《药品注册管理办法》中生物制品注册分类及申报资料新要求的影响,制药企业需要时间学习和调整,导致临床试验登记速度放缓。
从临床试验状态来看,进行中的生物制品临床试验(71.52%)多于已完成的临床试验(25.34%),反映出我国生物制品临床试验处于蓬勃发展期。进行中的生物制品临床试验处于招募中的较多,由于我国生物制品临床试验的靶点和适应证领域过于集中,适应证以肿瘤为主,靶点丰度仅为6.90%,这一定程度上会造成临床试验资源的浪费,可能导致受试者招募困难、上市的速度缓慢等一系列问题。
临床试验以创新药为主
从试验分期来看,生物制品临床试验以I期(37.77%)和III期(32.18%)为主,其次为II期(22.21%)。I期临床试验较多,提示我国在研的生物制品研发蓬勃;III期临床试验是药品上市前的最后一道关口,在研药品的III期临床试验基本代表了未来2~3年内的药物上市走向,是新药上市的关键风向标,本研究统计发现,我国生物制品III期临床试验较多,说明我国即将有不少生物制品上市。另外,本研究统计结果还显示,肿瘤是生物制品临床试验最热门的领域,相关靶点主要是PD-1,如帕博利珠单抗;其次,是以INS/INSR为靶点的内分泌、营养或代谢类疾病等。按照新药和生物类似药分析生物制品临床试验,2018—2022年,1类生物制品创新药临床试验数量从112项增加至604项,占比从31.73%增加至达77.04%,表明我国目前生物制品临床试验登记逐渐以创新药为主。同时研究结果显示,我国生物制品临床试验主要由国内申办者发起,表明我国生物制品临床试验改革有效地促进了生物制品临床试验的开展,国内制药企业已成为生物制品研发的重要力量。
适应证主要集中在抗肿瘤领域
研究结果显示,CDE平台登记的生物制品临床试验的适应证主要集中在抗肿瘤(肺癌为主),疫苗,内分泌、营养或代谢疾病等领域,其中,肿瘤领域以肺癌为主,而肺癌适应证中大部分为非小细胞肺癌。2019年1月国家癌症中心发布的《中国恶性肿瘤流行情况分析》显示,肺癌位居我国恶性肿瘤发病首位。可见,我国生物制品研发领域与实际临床需求基本相符。另外,疫苗领域的临床试验数量仅次于肿瘤。
各类靶点临床试验发展不同
目前全球公认的靶向治疗生物制品主要包括抗体、融合蛋白、基因和细胞治疗等种类。本研究结果显示,我国CDE平台登记开展临床试验的生物制品靶点共有223种,但靶点丰度仅为6.90%,主要为抗体类药物。
1 抗体类靶点集中度高,同质化竞争激烈
我国开展临床试验的生物制品作用靶点以抗体类居多,但靶点主要集中于PD-1、PD-L1、HER2、EGFR,靶点集中度高,同质化竞争激烈,且适应证主要针对抗肿瘤,其他系统疾病涉及较少,但上述抗体靶点与已上市的抗体类生物制品靶点的集中度不完全对应——已上市抗体类单抗靶点集中度排名前8位的为CD20、TNF-α、IL-2R、前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)、HER2、补体C5、PD-1、EGFR,其中CD20、EGFR、HER2靶点的相关药物多以抗肿瘤为主,且直接针对肿瘤细胞本身;TNF-α、IL-2RA、PD-1、C5是以免疫系统调节作用为机制的单抗;PCSK9是一种针对低密度脂蛋白胆固醇的单抗,适应证主要为高胆固醇血症。而本文统计发现,在CDE平台上登记的生物制品临床试验中,CD20、IL-2R、PCSK9、C5等靶点的靶点集中度排名分别为10(72项)、94(8项)、17(48项)、44(13项),表明CDE平台登记的大部分靶点的相关生物制剂目前还处于研发阶段,离产品批准上市还有相当远的距离,且目前PD-1、PD-L1、HER2、CD20靶点仍是目前药物研发热点,反映出在针对抗体类靶点的生物制品开发历程中,能够成功转化成药并用于临床的目前还集中在有限的靶点和有限的适应证领域中。
值得关注的是,CDE已经针对个别研发过热的靶点倡导企业理性开发,旨在倡导相关企业将有限的研发资源用在具有明显临床价值的创新药物和急需药物上。
2 融合蛋白类靶点增长加快,适应证范围扩大
融合蛋白类靶点的临床试验发展进程与抗体类靶点类似,但融合蛋白类靶点的种类和数量均少于抗体类靶点,融合蛋白类靶点主要集中在VEGF/VEGFR、CTLA-4、TNF,2017年以前靶点发展进程较为平缓,2019—2021年新靶点增加明显,治疗领域也从以VEGF/VEGFR靶点为代表的视觉系统疾病逐渐扩展至免疫调节、肌肉骨骼系统或结缔组织疾病等更广泛的疾病领域。
3 基因治疗类生物制品较少
以基因治疗为主的生物制品临床试验项目较少,主要集中在CSF、巨噬细胞集落刺激因子2、凝血因子Ⅷ等靶点。在基因治疗生物制品发展初期,其主要靶向CSF3基因,适应证集中在造血细胞因子类、血液或造血组织类、抗感染类;从2020年起,相关生物制品的靶点则集中在CSF1基因上,适应证也开始向免疫系统、抗肿瘤、肌肉骨骼系统等领域发展。
4 细胞治疗类生物制品发展迅速
以细胞治疗为主的生物制品临床试验发展迅速,特别是2019年后,这类生物制品的临床试验项目数量显著增加,表明这一领域的发展潜力巨大,研究热点也从各类干细胞逐渐向嵌合抗原受体免疫细胞(chimeric antigen receptor T-cell immunotherapy,CAR-T)等基因修饰细胞的方向发展。从统计数据可以看出,针对CD19靶点的CAR-T细胞以及来源于骨髓间充质干细胞(bone marrow stem cells,BMSCs)的干细胞治疗产品较为集中,其次为以B细胞成熟抗原(B cell maturation antigen,BCMA)为靶点的CAR-T细胞疗法。特别是以CAR-T细胞治疗临床试验,其数量位列第12位(61项),适应证主要为造血组织肿瘤、成熟B细胞肿瘤,一定程度上显示了细胞疗法在该领域的治疗优势。我国细胞治疗已有较丰富的前期研究经验和临床数据的积累,随着临床研究的深入和技术发展进步,我国研发的细胞治疗产品具有较高的潜在市场预期。
根据本文的统计数据,2021—2022年,我国生物制品临床试验出现了许多全新靶点,抗体类以针对血友病的组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)、针对肿瘤的信号调节蛋白质(signal regulatory proteins,SIRP)、CD112R、蛋白质降解靶向催化剂(proteolysis targeting chimera,PROTAC)和针对心血管疾病的类血管生成素样蛋白3(angiopoietin-like3,ANGPTL3)为代表,抗体偶联药物以CD123、类酪氨酸激酶样孤儿受体1(receptor tyrosine kinase-like orphan receptor1,ROR1)、细胞黏附分子群4(nectin cell adhesion molecule-4,Nectin-4)为代表,CAR-T细胞疗法药物以CD70、叶酸受体1(folate receptor1,FOLR1)等靶点为代表。
多靶点生物制品的靶点较为集中
本研究结果显示,我国生物制品药物临床试验靶点合用主要集中PD-L1、PD-1、CD3、CTLA-4、VEGF等靶点,这些靶点与其他靶点的合用次数较多。从边权重的计算结果来看,针对宫颈癌的PD-1和CTLA-4、针对实体瘤的TGF-β和PD-L1、针对银屑病的IL-12和IL-23、针对恶性肿瘤的TNFRSF9(4-1BB)和PD-L1、针对非小细胞肺癌的CTLA-4和PD-L1等双靶点的生物制品开展的临床试验较多,表明这些靶点之间的合用较为紧密。总体来讲,目前双靶点及多靶点的生物制品临床试验较少,适应证主要为抗肿瘤,且靶点较为集中。
结语
我国生物制品临床试验发展蓬勃,基于靶点的生物制品创新药研发势头迅猛。靶点对应的适应证主要集中在抗肿瘤和内分泌、营养或代谢疾病等领域,相关的生物制品临床试验以单靶点为主,双靶点和多靶点生物制品的临床试验很少,但研发靶点和适应证同质化严重、靶点丰度低,临床试验效率有待提高。基于数据的可获得性,本研究的统计分析结果可能与实际情况有些偏差,也不能完全代表我国生物制药企业的研发现状。生物制品企业应追踪全球研发靶点动态、结合企业自身情况优选靶点和适应证,并密切关注我国药品注册、临床试验的政策法规以及医药市场需求。

来源:Internet


