USP <661.1>和USP <661.2> 将于2025年12月1日正式生效。在此日期之前,USP <661>仍适用;自2025年12月1日起,所有包装材料和系统都必须满足USP <661.1>和<661.2>的要求,即使它们此前只符合USP <661>的标准。
本期将主要介绍针对塑料包装材料的USP<661.1>,不同于USP<661>中将材料与包材系统/组件合并控制,即将正式生效的USP<661.1>和USP<661.2>将材料和包装系统/组件分两个章节分别进行了控制。
一、新规背景:全球市场的入场券
2025年12月即将生效的USP<661.1>标准(美国药典第661章第1部分),将成为药品包装材料进入国际市场的强制性门槛。据FDA最新统计,未通过该认证的包装材料导致药品召回案例同比增加37%。对于中国药企而言,这不仅是技术标准,更是参与全球供应链竞争的必备资质。
二、标准定位与适用范围
USP<661.1>是美国药典针对塑料包装材料的专项标准,适用于药品包装系统的基础材料(如树脂、添加剂等)评估。与USP<661.2>(包装系统整体评估)形成互补关系,共同构成药品包装安全的三阶段认证体系。
三、核心评估框架
1. 材料表征要求
化学材料鉴别:需通过FTIR光谱等技术确认聚合物主链结构及添加剂成分
主要检测材料:环烯烃;聚酰胺6;聚碳酸酯;聚乙烯;聚对苯二甲酸乙二醇酯;聚对苯二甲酸乙二醇酯G;聚(乙烯-醋酸乙烯酯);聚丙烯;聚氯乙烯;和聚氯乙烯,增塑剂
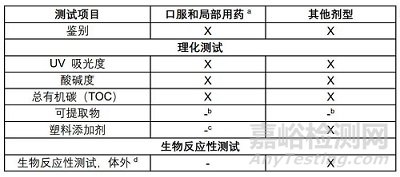
主要理化测试项目:
1)红外光谱法鉴别化学材料
2) UV法测吸光度;
3) 化学指示剂测酸碱度;
4)TOC测总有机碳;
5)热分析法测融化曲线;
6)气相、液相、薄层色谱法检测塑料添加剂(包括有关物质、残留溶剂、抗氧化剂等105种可能迁移的化学物质)
具体检项测试应用详见下表
a 对于含有助溶剂的水基口服药品(或者如果出于任何原因,预计从塑料包装组件中提取的物质量可能大于水提取),可能需要额外的可提取信息来确定适用性。如果需要其他信息,请按照上表的指示进行塑料添加剂测试。
b 最终用户认为必要和适当时。有关更多信息,参阅USP〈1661〉。
c 适当参考21 CFR 174–186中的间接食品添加剂法规,特别是涉及纯度标准和使用限制的法规。
d 支持用于最终药品包装/输送系统(药物和药物/装置组合产品)的塑料包装材料的生物反应性测试提供了基本信息,但通常不足以评估监管机构的最终适用性预期。因此,与对应的监管机构合作以获得有关产品特定应用的指导非常重要。
2. 风险控制机制
建立材料-药品兼容性矩阵,覆盖pH值、温度等12个关键变量
引入加速老化实验模型,预测材料在极端条件下的稳定性
四、企业合规关键点
1.技术文件准备
需提供完整的材料安全数据表(MSDS)
包含生产工艺流程图及原材料溯源证明
2.检测方法建立
采用符合USP要求的仪器进行表征和成分筛查
建立符合USP法规的检测方法
五、实施时间线与过渡方案
2025年12月1日:标准强制生效日期。
过渡期建议:
1. 提前熟悉新规要求,在2025年12月1日前完成合规准备。
2. 评估现有包装系统的合规性,必要时进行升级或更换。
3. 优先完成高风险材料(如注射剂包装)的认证。
成本控制:
与可靠的检测服务提供商合作(如天祥域通),即确保测试数据符合USP要求,又能降低自建检测能力的成本。