您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-09-11 22:10
摘 要: 建立生血宝合剂的高效液相色谱特征图谱,并测定原儿茶酸、红景天苷、芍药苷、2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(THSG)、特女贞苷的含量。采用Kromasil 100-5 C18(250 mm×4.6 mm,5 μm)色谱柱进行分析;流动相为乙腈-水(0.1%磷酸),梯度洗脱;流量为1.0 mL/min;柱温为35 ℃;检测波长为220 nm。15批生血宝合剂特征图中含9个共有峰,确定5种成分,相似度均大于0.995。建立了生血宝合剂的多组分含量测定方法,5种成分在各自质量浓度范围内与对应的色谱峰面积线性关系良好,相关系数均大于0.999,平均回收率为99.69%~102.26%,测定结果的相对标准偏差为1.56%~2.69%(n=6)。建立的生血宝合剂多组分含量测定方法及特征图谱方法便捷可靠,可用于生血宝合剂品质的综合评价。
关键词: 生血宝合剂; 含量测定; 高效液相色谱特征图谱; 芍药苷; 2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷
生血宝合剂作为我国著名中医药学专家的经验方,由清华德人西安幸福制药有限公司生产,临床应用了三十余年,因其疗效显著,入选2018版中国国家基本药物目录,并被《中华人民共和国药典》收载。生血宝合剂由墨旱莲、女贞子、白芍、制何首乌、黄芪、桑椹、狗脊7味中药组成,具有滋补肝肾,益气生血等功效,可治疗放化疗所致的白细胞,血小板减少、再生障碍性贫血、缺铁性贫血、肾性贫血、失血性贫血[1‒2]。经临床研究发现,生血宝合剂对各种类型贫血均有显著疗效[3‒6]。
现行生血宝合剂药典标准仅限定芍药苷、2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(THSG)两种成分的定量分析,且现有文献也大多仅针对其中的单一成分进行研究[7‒10],然而,复方中药具有“多成分、多途径、多靶点”的协同作用,能够在复杂疾病治疗中展现独特的优势,仅靠单一或少数成分难以全面反映药物的内在质量品质。中药特征图谱因其信息丰富、特征鲜明,且能够反映复方的整体性,有效反映中药的内在质量,提升整体质量控制水平[11‒14],通过特征图谱的建立与多成分含量测定方法,可以更全面地进行生血宝合剂的质量控制。
目前,针对上述功效成分的测定主要采用高效液相色谱(HPLC)及液相色谱-质谱联用法(LC-MS/MS)。其中,芍药苷和THSG作为药典指标成分,已有相关HPLC方法报道[15‒16];红景天苷和特女贞苷的定量研究多借鉴《中华人民共和国药典》女贞子项下方法进行HPLC法测定[17];而原儿茶酸作为狗脊中主要测定成分,也多采用HPLC法测定[18]。生血宝合剂中芍药苷通过调控骨髓细胞蛋白质表达网络促进造血功能[19];红景天苷与特女贞苷通过增强免疫应答协同改善血虚证候[20‒21],这些成分的含量波动可能影响制剂疗效,因此需建立精准定量方法进行有效控制。笔者通过优化梯度洗脱体系,建立HPLC法同步测定原儿茶酸、红景天苷、芍药苷、THSG及特女贞苷,为科学把控生血宝制剂的质量提供一定的实验基础。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Waters e2695型,美国沃特世科技有限公司。
紫外可见光检测器:2998型,美国沃特世科技有限公司。
电子分析天平:CPA225D型,感量为0.01 mg,德国赛多利斯公司。
超声波清洗器:KQ-300DE型,江苏昆山市超声仪器有限公司。
芍药苷对照品:批号为110736-202447,中国食品药品检定研究院。
红景天苷、THSG对照品:纯度(质量分数)均不小于98.0%,批号分别为O141B228927、H08 J11E115101,上海源叶生物科技有限公司。
原儿茶酸、特女贞苷对照品:纯度(质量分数)均不小于98.0%,批号分别为11809-201906、11926-201404,中国食品药品检定研究院。
对照药材女贞子、白芍、制何首乌、桑椹、黄芪、墨旱莲、狗脊:批号分别为121041-202106、120905-202011、21454-201806、121158-201804、120974-202414、120958-201708、121071-201706,中国食品药品检定研究院。
乙腈、甲醇:色谱级,德国默克公司。生血宝合剂样品:共15批,编号为S1~S15,生产批号分别为JX240524、JX240525、JX240538、JX240544、JX240601、JX240605、JX240606、JX240610、JX240611、JX240651、JX240654、JX240704、JX240707、JX240708、JX240709,清华德人西安幸福制药有限公司。
实验用水为纯净水。
1.2 色谱条件
色谱柱:Kromasil 100-5 C18柱 (250 mm×4.6 mm,5 μm,荷兰阿克苏诺贝尔公司);流动相:A相为乙腈,B相为0.1%磷酸溶液;洗脱方式:梯度洗脱;洗脱程序:0~10 min时A相的体积分数保持2%,10~20 min时A相的体积分数由2%提高到15%,20~40 min时A相的体积分数保持15%,40~55 min时A相的体积分数由15%提高到35%;流量:1.0 mL/min;检测波长:220 nm;柱温:35 ℃;进样体积:10 μL;分析时间:55 min。
1.3 溶液制备
对照品混合溶液:分别精密称取适量原儿茶酸、芍药苷、THSG、红景天苷、特女贞苷,溶解于甲醇中,配制成原儿茶酸、芍药苷、THSG、红景天苷、特女贞苷质量浓度分别为0.77、1.21、1.04、1.23、1.33 mg/mL的混合对照品溶液。
生血宝合剂样品溶液:精确量取2 mL生血宝合剂样品,置于10 mL容量瓶中,加甲醇定容至10 mL,超声0.5 h (120 W,50 kHz),放至室温,摇匀后用0.45 μm滤膜过滤,取续滤液备用。
对照药材溶液:取对照药材女贞子、白芍、制何首乌、桑椹、墨旱莲、狗脊和黄芪各1 g于锥形瓶中,精密加入甲醇10 mL,称定其质量,超声0.5 h,放至室温,用甲醇补足减失质量,摇匀后用0.45 μm滤膜过滤,取续滤液备用。
阴性样品溶液:按处方工艺制备各阴性制剂,再根据样品溶液制备方法制备相应阴性样品溶液。
空白样品溶液:不加样品,其他操作同样品溶液制备方法,制备空白样品溶液。
1.4 实验方法
将15批次生血宝合剂按1.3方法制备后,按1.2色谱条件进样分析,采用“中药色谱指纹图谱相似度评价系统”软件(2012版),确定生血宝合剂的共有峰,进行相似度评价。以对照品溶液质量浓度为横坐标、对应色谱峰面积为纵坐标绘制标准曲线,得线性方程和相关系数,以外标法计算样品中成分的含量。
2 结果与讨论
2.1 实验条件的优化
2.1.1 制备方法选择
依次考察了不同浓度溶剂(体积分数分别为50%、75%、100%的甲醇)、不同提取方式(超声处理和加热回流提取)对生血宝合剂中化学成分提取效果的影响。从色谱图的峰数目、峰面积以及峰形3个维度评价,以100%甲醇作为溶剂,超声提取30 min,生血宝合剂成分的提取效果最佳。
2.1.2 色谱条件选择
在特征图谱方法开发过程中,通过系统考察色谱柱类型、检测波长、流动相体系及梯度洗脱程序等关键参数,结合文献与实验优化[11‒12],确定最佳色谱条件。初始试验条件为:流动相A为乙腈,流动相B为0.1%磷酸溶液,梯度洗脱条件为:0~15 min时A相体积分数为2%,15~30 min时A相的体积分数由2%升至15%,30~40 min时A相的体积分数由15%升至25%,40~55 min时A相体积分数保持25%。结果表明,生血宝合剂中化学成分极性差异显著,需采用梯度洗脱实现有效分离。经乙腈比例梯度分段优化,最终确定梯度条件为:0~10 min时A相体积分数为2%;10~20 min时A相的体积分数由2%升至15%;20~40 min时A相的体积分数保持15%;40~55 min时A相的体积分数由15%升至35%。该梯度程序下色谱峰数量显著增加,且目标成分峰面积响应值提升,表明分离效率与检测灵敏度同步优化,结果见图1。
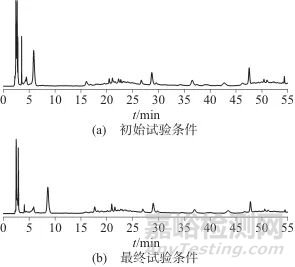
图1 不同梯度条件色谱图对比
Fig. 1 Comparison of chromatograms under different gradient conditions
对比Kromasil 100-5 C18柱(250 mm×4.6 mm,5 μm)、INERTSIL C18柱(250 mm×4.6 mm,5 μm)和Diamonsil Plus C18柱(250 mm×4.6 mm,5 μm) 3种C18色谱柱性能,发现Kromasil 100-5 C18色谱柱在相同条件下分离度最佳。采用紫外检测器对生血宝合剂进行全波长扫描(200~400 nm),发现220 nm下各特征峰响应值均衡,可检测到9个明显色谱峰,因此选择220 nm为检测波长。对比两种流动相体系(乙腈-0.1%磷酸溶液和乙腈-0.1%甲酸溶液),磷酸溶液体系色谱峰形尖锐,9个特征峰分离度良好,故选定乙腈-0.1%磷酸溶液为流动相。考察色谱柱柱温分别为25、30、35 ℃时的色谱峰形和分离度,结果表明,不同柱温下各组分色谱峰没有显著差别,为保证色谱条件一致,设置柱温为35 ℃。最终选择乙腈-0.1%磷酸溶液为流动相,流量为1 mL/min,柱温为35 ℃,所建立的生血宝合剂特征图谱9个特征峰,实现了全方位、多类型化学成分的展现,更加便于应用于对生血宝合剂的质量分析。
2.2 特征图谱方法学考察
2.2.1 方法专属性
分别精密吸取空白溶剂、混合对照品溶液、生血宝合剂样品溶液及相应的阴性样品溶液,按1.2色谱条件分析,色谱如图2和图3所示。由图2和图3可见,阴性样品在生血宝合剂样品溶液相应出峰位置未见干扰峰,表明阴性无干扰,方法专属性良好。
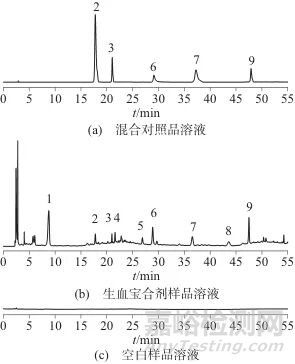
图2 混合对照品溶液、生血宝合剂样品溶液、空白样品溶液的HPLC色谱图
Fig. 2 HPLC chromatograms of mixed reference solution, Shengxuebao Mixture sample solution and blank sample solution
1、4、5、8—未知峰; ;2—原儿茶酸; 3—红景天苷;6—芍药苷; 7—THSG; 9—特女贞苷
1、4、5、8—未知峰;2—原儿茶酸; 3—红景天苷; 6—芍药苷; 7—THSG; 9—特女贞苷
图3 缺单味药材的阴性样品和生血宝合剂色谱图
Fig. 3 HPLC chromatogram of the negative sample without single herbs and Shengxuebao Mixture
2.2.2 方法精密度
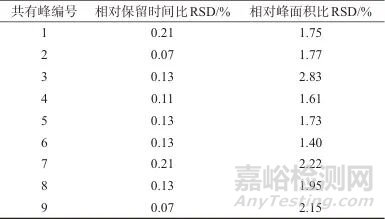
取生血宝合剂(S1)平行制备6份样品溶液,按1.2色谱条件,计算各共有峰相对保留时间和相对峰面积测定结果的相对标准偏差(RSD)[22],结果见表1。由表1可知,相对保留时间比的RSD为0.07%~0.21%,相对峰面积比的RSD为1.40%~2.83%,表明该方法精密度良好。
表1 方法精密度试验结果
Tab. 1 Method precision test results
2.2.3 方法稳定性
取生血宝合剂(S1),按1.2色谱条件,分别于第0、2、6、10、12、24 h进样,计算各共有峰相对保留时间和相对峰面积的RSD,结果见表2。由表2可知,相对保留时间比的RSD为0.09%~0.46%、相对峰面积比的RSD为0.71%~2.70%,表明稳定性良好。
表2 方法稳定性试验结果T
ab. 2 Method precision test results
2.3 生血宝合剂特征图谱及相似度评价
2.3.1 特征图谱的建立
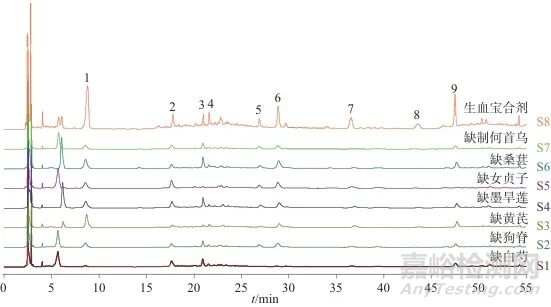
取15批生血宝合剂样品,制备样品溶液,按1.2色谱条件分析,并使用“中药色谱指纹图谱相似度评价系统”(2012版)匹配,形成对照特征图谱(R)。其中,标定的9个特征峰在15批生血宝合剂中为共有成分,如图4所示。
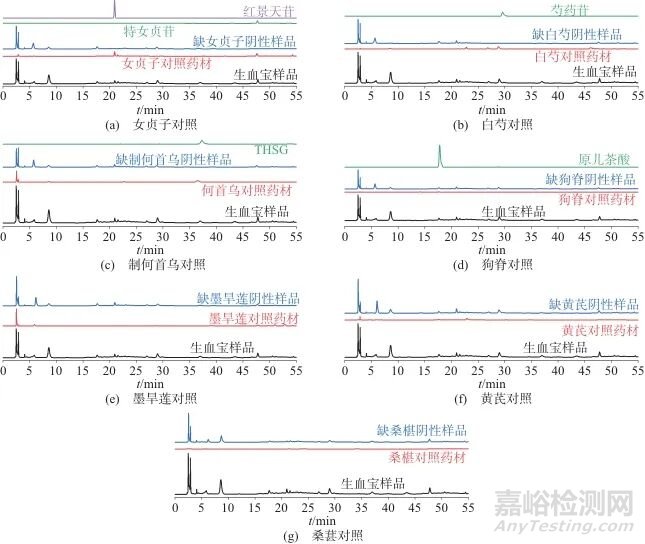
1、4、5、8—未知峰;2—原儿茶酸; 3—红景天苷; 6—芍药苷; 7—THSG; 9—特女贞苷
图4 15批生血宝合剂特征图谱和对照图谱
Fig. 4 HPLC the reference fingerprint and fingerprints of 15 batches of Shengxuebao Mixture
2.3.2 特征峰指认取样品溶液,按1.2色谱条件测定,共标记9个共有峰,经对照品比对后确定5个,色谱图见图5。
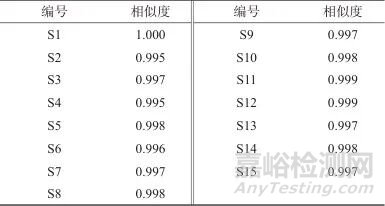
图5 生血宝合剂样品、药材、阴性对照及对照品HPLC图
Fig. 5 HPLC Chromatogram of Shengxuebao Mixture,single herb,negative reference and reference substances
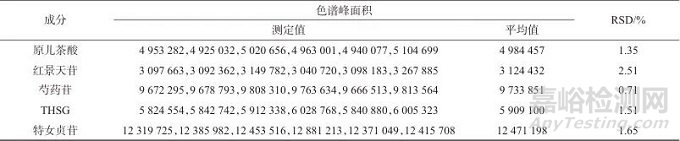
对生血宝合剂中白芍、制何首乌、黄芪、桑椹、女贞子、墨旱莲、狗脊7味药材的特征峰进行研究,对生血宝合剂特征图谱中5个共有色谱峰成分进行定性分析,其中狗脊中原儿茶酸(2号峰)、制何首乌中THSG (7号峰)、白芍中芍药苷(6号峰)、女贞子中红景天苷(3号峰)、特女贞苷(9号峰)均为各药材的指标成分。2.3.3 样品相似度评价使用“中药色谱指纹图谱相似度评价系统”(2012版)将15批生血宝合剂各共有成分峰匹配后,拟合对照图谱,该系统通过夹角余弦相似度与相关系数法多算法结合,消除基线漂移的影响,侧重峰强度变化的协同性,兼顾中药成分的动态变化与整体质量控制需求。计算对照图谱与15批生血宝合剂的相似度为0.995~1.000,相似度较高,而特征图谱能系统地反映出合剂的主要成分,表明15批生血宝合剂所含化学成分较为类似,结果见表3。
表3 15批生血宝合剂相似度
Tab. 3 15 batch Shengxuebao Mixture similarity
2.4 含量测定
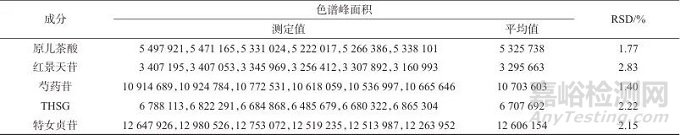
2.4.1 稳定性考察
取生血宝合剂(S1),按1.2色谱条件,分别于第0、2、6、10、12、24 h测定,计算相对峰面积的RSD,结果见表4。由表4可知,原儿茶酸、红景天苷、芍药苷、THSG、特女贞苷的RSD分别为1.35%、2.51%、0.71%、1.51%、1.65%,表明该法稳定性良好。
表4 稳定性试验结果
Tab. 4 Stability test results
2.4.2 精密度考察
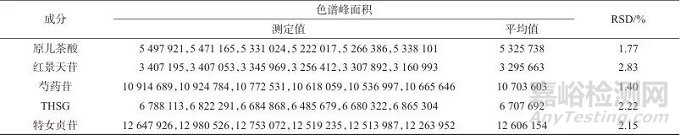
取生血宝合剂(S1)平行制备6份样品溶液,依据1.2色谱条件测定,计算相对峰面积的RSD,结果见表5。由表5可知,原儿茶酸、红景天苷、芍药苷、THSG、特女贞苷的RSD分别为1.77%、2.83%、1.40%、2.22%、2.15%,表明该法精密度良好。
表5 精密度试验结果
Tab. 5 Precision test results
2.4.3 线性关系考察
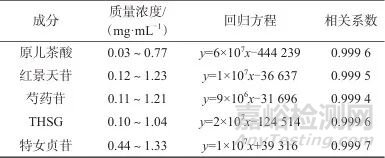
精密称取适量对照品,溶于甲醇中制备对照品储备液,并逐级稀释,进样测定,记录不同质量浓度下色谱峰面积。一对照品质量浓度为横坐标x,色谱峰面积为纵坐标y,绘制标准曲线,得到各成分回归方程及线性范围,具体结果见表6。
表6 5种成分线性关系
Tab. 6 Linear relationships of five components
2.4.4 样品加标回收试验
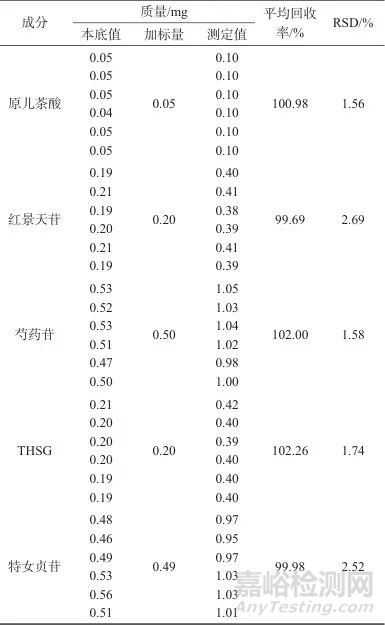
取已知含量生血宝合剂(S1),精密量取1 mL,加入100%加标水平用对照品溶液(含芍药苷0.50 mg、原儿茶酸0.05 mg、THSG 0.20 mg、红景天苷0.19 mg、特女贞苷0.49 mg),进样测定后计算样品加标回收率,结果见表7。由表7可知,芍药苷、原儿茶酸、THSG、红景天苷、特女贞苷的平均回收率分别为102.00%、100.98%、102.26%、99.69%、99.98%,表明该方法准确度良好,符合方法学要求。
表7 样品加标回收试验结果
Tab. 7 Resultsoftestforsamplespikerecovery
3 结论
建立了生血宝合剂特征图谱及含量测定的质量评价方法,可用于生血宝合剂的综合评价。通过高效液相色谱法整合15批次样品指纹图谱,对9个共有峰进行了来源归属,对比对照品保留时间,对其中5个色谱峰进行了定性鉴别及全谱相似度评价,同时测定生血宝合剂中原儿茶酸、红景天苷、芍药苷、THSG、特女贞苷五种成分含量,并对制备方法与色谱条件的选择进行了优化。相较于2020年版《中华人民共和国药典》仅测定芍药苷和THSG两种成分相比,更能全面地评估药品质量。后续研究将通过结合质谱技术深化未知成分结构鉴定,并扩大样本量验证方法普适性。
参考文献
1 周凯.生血宝合剂预防宫颈癌同步放化疗后贫血的临床研究[D].昆明:云南中医药大学,2021.
ZHOU Kai. Clinical study of Shengxuebao Mixture to prevent anemia afterconeurrent chemoradiotherapy for cervical cancer[D]. Kunming:Yunnan University of Chinese Medicine,2021.
2 占德炜.生血宝辅治缺铁性贫血临床观察[J].实用中医药杂志,2024,40(4): 651.
ZHAN Dewei. Clinical observation of Shengxuebao in the treatment of iron deficiency anemia[J]. Journal of Practical Traditional Chinese Medic,2024,40(4): 651.
3 向启蒙.生血宝合剂联合rHuEPO对MHD肾性贫血患者氧化应激及微炎症状态的影响[D].南昌:江西中医药大学,2022.
XIANG Qimeng. Effects of Shengxuebao joint rHuEPO on Oxidative Stress and micro-inflammatory State in patients with MHD renal anemia[D]. Nanchang:Jiangxi University of Traditional Chinese Medicine,2022.
4 易思.生血宝合剂辅助化疗治疗急性髓系白血病的效果及对机体免疫功能的影响[J].黑龙江医药,2024,37(2): 370.
YI Si. Effect of Shengxuebao Mixture adjuvant chemotherapy on acute myeloid leukemia and its effect on immune function[J].Heilongjiang Medicine Journal,2024,37(2): 370.
5 张婧.生血宝合剂治疗妊娠期缺铁性贫血疗效观察[J].中西医结合研究,2021,13(4): 251.
ZHANG Jing. Observation on therapeutic effect of Shengxuebao mixture on iron deficiency anemia during pregnancy[J]. Research of Integrated Traditional Chinese and Western Medicine,2021,13(4): 251.
6 陈晓峰,张一妙,朱丽红.生血宝合剂的临床应用进展[J].中成药,2024,46(5): 1589.
CHEN Xiaofeng,ZHANG Yimiao,ZHU Lihong. Progress in clinical application of Shengxuebao mixture[J]. Chinese Traditional Patent Medicine,2024,46(5): 1589.
7 易小兰,杨华,张飞飞,等.生血宝合剂的多成分HPLC指纹图谱[J].中国实验方剂学杂志,2016,22(1): 57.
YI Xiaolan,YANG Hua,ZHANG Feifei,et al. Multi-component fingerprint chromatogram of Shenxuebao mixture by HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae,2016,22(1): 57.
8 高艳彬.生血宝合剂中二苯乙烯苷的含量测定[J].中国药业, 2014, 23(16): 45.
GAO Yanbin. Determination of content of stibene glucoside in Shengxuebao mixture[J]. China Pharmaceuticals,2014,23(16): 45.
9 鄢海燕, 邹纯才.《中国药典》(2010年版~2020年版)中药指纹(特征)图谱应用进展与展望[J].南方医科大学学报,2022,42(1): 150.
YAN Haiyan,ZOU Chuncai. Progress and prospect of application of traditional Chinese medicine fingerprint(specific chromatogram) in Chinese Pharmacopoeia(2010-2020)[J]. Journal of Southern Medical University,2022,42(1): 150.
10 胡秀敏,郑玉清,孙华燕.高效液相色谱法测定生血宝合剂中芍药苷的含量[J].首都食品与医药,2015,22(22): 87.
HU Xiumin,ZHENG Yuqing,SUN Huayan. Content determination of paeoniflorin in Shengxuebao Granule by HPLC[J]. Capital Food Medicine,2015,22(22): 87.
11 李世雄,赵思宇,李源,等.中药复方配伍理论下生血宝复方化学成分溶出规律研究[J].中草药,2022,53(14): 4 298.
LI Shixiong,ZHAO Siyu,LI Yuan,et al. Study on dissolution law of chemical constituents of Shengxuebao compound under compatibility theory of TCM compound[J]. Chinese Traditional and Herbal Drugs,2022,53(14): 4 298.
12 陈爱军,黄思琪,刘晓轩,等.生血宝的液-固制剂质量属性传递规律分析[J].中国实验方剂学杂志,2024,30(20): 135.
CHEN Aijun,HUANG Siqi,LIU Xiaoxuan,et al. Aanlysis on quality attribute transfer law of liquid-solid preparation of Shengxuebao[J]. Chinese Journal of Experimental Traditional Medical Formulae,2024,30(20): 135.
13 潘坚扬,周紫楣,瞿海斌,等.生血宝合剂浓缩液质量快速分析方法研究[J].中国中药杂志,2020,45(9): 2 115.
PAN Jianyang,ZHOU Zimei,QU Haibin,et al. Study on rapid quality analysis method of Shengxuebao Mixture[J]. China Journal of Chinese Materia Medica,2020,45(9): 2 115.
14 连益纯,林静,李知瑾,等. HPLC特征图谱技术在中药制剂质量控制中的应用进展[J].海峡药学,2024,36(2): 1.
LIAN Yichun,LIN Jing,LI Zhijin,et al. Application progress of HPLC characteristic chromatogram in quality control of traditional Chinese medicine preparations[J]. Strait Pharmaceutical Journal,2024,36(2): 1.
15 任娟,刘晓,李伟东,等.基于指纹图谱和化学计量学的白芍不同炮制品成分差异研究[J].世界中医药,2024,19(14): 2 048.
REN Juan,LIU Xiao,LI Weidong,et al. Composition differences of different processed paeoniae radix alba based on fingerprint and chemometrics[J]. World Chinese Medicine,2024,19(14): 2 048.
16 许江红,张若良,黄礼福,等. HPLC法测定不同产地何首乌中蒽醌类、二苯乙烯苷、没食子酸的含量[J].中成药,2024,46(12): 4102.
XU Jianghong,ZHANG Ruoliang,HUANG Lifu, et al. Determination of anthraquinones, stilbene glycosides and Gallic acid in polygonum multiflori radix from different areas by HPLC[J]. Chinese Traditional Patent Medicine,2024,46(12): 4102.
17 张代亮,姚元成,史磊,等.女贞子配方颗粒与传统汤剂化学成分一致性研究[J].时珍国医国药,2024,35(15): 3 383.
ZHANG Dailiang,YAO Yuancheng,SHI Lei,et al. Study on the consistency of chemical components between Ligustrum lucidum prescription granules and traditional decoction[J]. Lishizhen Medicine and Materia Medica Research,2024,35(15): 3 383.
18 余中霞,丁金有,郑露盼,等. HPLC法测定补肾强身胶囊中原儿茶酸的含量[J].实验室检测,2025(3): 26.
YU Zhongxia,DING Jinyou,ZHENG Lupan,et al. Determination of protocatechuic acid in Bushen Qiangshen capsules by HPLC[J]. Laboratory Testing,2025(3): 26.
19 刘平,赵俊超,李日光.芍药苷药理作用及其机制研究进展[J].中医药导报,2023,29(8): 84.
LIU Ping,ZHAO Junchao,LI Riguang. Research progress on pharmacological action and mechanism of paeoniflorin [J]. Guiding Journal of Traditional Chinese Medicine and Pharmacology,2023,29(8): 84.
20 HAN J H,SUN N,XING J J,et al. Effect and mechanism of specnuezhenide on chemotherapy-induced myelosuppression[J]. Combinatorial Chemistry & High Throughput Screening,2023,26(13): 2 393.
21 LIU Z H,CHEN L X,XIONG D F,et al. Salidroside affects the Th17/Treg cell balance in aplastic anemia via the STAT3/HIF-1α/RORγt pathway[J]. Redox Report,2023,28(1): 2 225 868.
22 国家药品监督管理局药品审评中心.中药制剂特征图谱研究技术指导原则(试行)[EB/OL].(2024-02-20).https://www.ciopharma.com/supervise/37702.
CENTER FOR DRUG EVALUATION,NATIONAL MEDICAL PRODUCTS ADMINISTRATION. Technical guidelines for the research on characteristic maps of traditional Chinese medicine preparations(Trial)[EB/OL].(2024-02-20).https://www.ciopharma.com/supervise/37702.

来源:化学分析计量


