您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-09-24 21:30
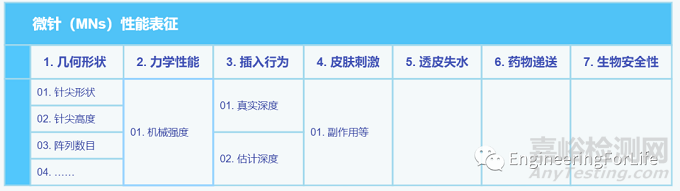
微针贴片(MNs)因无痛、微创、能增强药物渗透性、提高生物分子在表皮和真皮层的可检测性等优点,广泛应用于疾病诊断、组织修复与再生等生物医学领域。但MNs在使用过程中也存在部分问题,如力学性能欠佳、载药率低、生物相容性差等,因此需要根据多种评价指标综合评估MNs的理化生物性能,以满足试验要求。
在前期介绍了MNs最新研究进展和分类后,部分读者反馈不知如何评估所制备MNs的性能,为此本期总结整理了MNs的理化生物性能评价手段,以便于筛选合适的MNs用于后续研究。
1几何形状
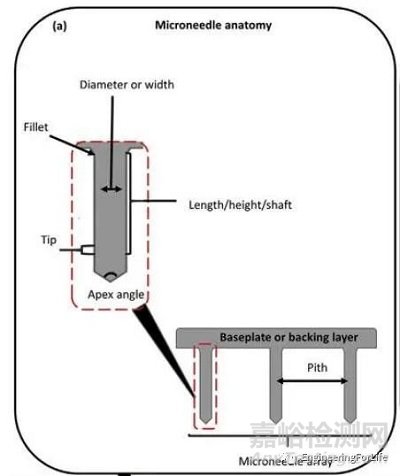
图1 MNs常用术语[1]
MNs的针尖尺寸、几何形状、针尖阵列数等因素都会影响微针的力学性能,可通过视觉检查、立体显微镜和扫描电子显微镜(SEM)等手段可视化微针的几何形状。
Aoyagi等[2]系统探索了针尖几何形状(针尖角度、宽度)对MNs插入组织过程力学性能的影响。结果表明,具有低尖端角(15-30°)和细针轴(120 μm)的MNs可以有效地增强微针的插入,而不会导致失效。
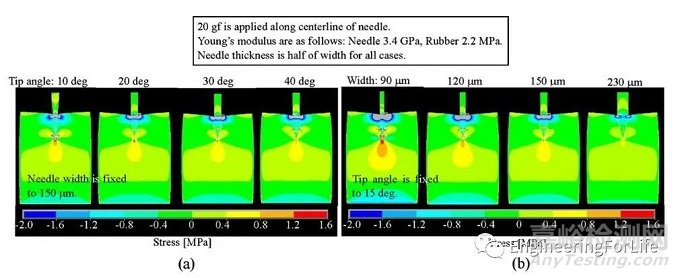
图2 MNs插入引起的应力分布的有限元模拟结果。(a)尖端角与应力的关系。(b)宽度与应力的关系[2]
微针本身的几何形状已被证明会影响插入行为。Bediz等人[3]研究表明,因锥体微针插入力随深度的增加而增加,相比之下,方尖碑设计的固体微针在更深、可重复插入方面更有效。
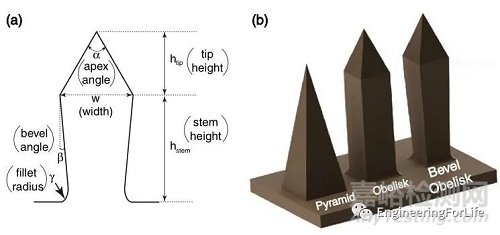
图3 (a)微针的参数化几何。(b)本研究考虑的三种形状[3]
2力学性能
皮肤的粘弹性会降低微针的穿透力,MNs必须具有足够的机械强度才能穿透皮肤。研究表明,
微针进入皮肤屏障所需的插入力约为0.098 N/针,以穿透角质层[4]。因此,将强度试验与插入试验相结合,对评价微针的穿透力具有重要意义。
评价微针机械强度最常用的试验是轴向压缩试验或微针失效试验[5]。
测试方法:一个微针阵列连接到一个测试探针,然后将微针以预定的速度压在一个扁平的铝金属块上,直到在力-位移曲线上记录一个最大峰值。这也被称为微针的断裂力。此外,微针的脆性也可以从力-位移斜率的梯度来评估。
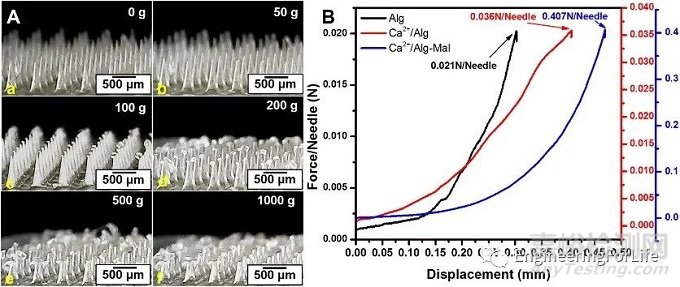
图4 (A) Ca2+/Alg-Mal 微针在0~1000 g抗重量范围内的形态。(B) 不同微针贴片的压缩试验[6]
在每次机械压缩测试后,需对微针进行视觉直观检查,以评估微针在压缩测试过程中可能产生的任何变形(如屈曲或弯曲)。压缩试验是为了确定微针在变形前所能承受的机械强度。
3插入行为
MNs必须保持完整形貌,且有效插入组织中,才能高效发挥作用,因此需对MNs进行插入研究。由于皮肤固有的粘弹性特性,整个微针长度的完整插入是很难实现的。微针插入深度分为真实深度和估计深度两类[1]。
测定真实深度:共聚焦显微镜,X射线传输计算断层扫描、光学相干断层扫描(OCT)等。
测定估计深度:组织学切片、染色等。

图5 MNs插入后位置可视化结果。(a)皮肤横切面后显微镜观察微针插入部位。(b)插入皮肤后将磺基罗丹明B沉积到皮肤,通过荧光显微镜观察微针插入部位。(c)荧光显微镜显示含有FITC -右旋糖酐的微针插入位点[1]
4皮肤刺激
MNs必须保持完整形貌,且有效插入组织中,才能高效发挥作用,因此需对MNs进行插入研究。由于皮肤固有的粘弹性特性,整个微针长度的完整插入是很难实现的。微针插入深度分为真实深度和估计深度两类[1]。
测定真实深度:共聚焦显微镜,X射线传输计算断层扫描、光学相干断层扫描(OCT)等。
测定估计深度:组织学切片、染色等。
表1 Kusamori等人[7]用于量化皮肤刺激程度的Draize法分级量表

5透皮失水
通常在微针插入试验的基础上进行透皮失水(TEWL)测量,可评估微针应用于皮肤屏障后的完整性效果。微针成功插入皮肤后会损害皮肤屏障功能,这反映在水分流失测量的增加。随着皮肤的弹性,微针孔重新密封,水分流失测量值会随着时间的推移慢慢降低。
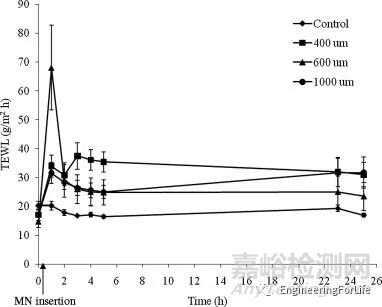
图6 经不同长度MNs处理的皮肤样品(330 m厚)的水分流失与时间曲线[8]
6药物递送
弗朗茨扩散池是研究微针增强药物真皮渗透最常用的体外方法。
原理:这些扩散池包含供体室和受体室,由膜(通常是离体的人或动物皮肤,或人工聚合物膜)隔开。含有感兴趣渗透剂的配方通常被引入供体隔室,通过所选择的膜扩散到受体隔室。随后用高效液相色谱(HPLC)等分析技术对扩散到受体室的渗透液进行分析。扩散池通常分为静态(Franz型)和流动(Bronaugh型)两种类型。
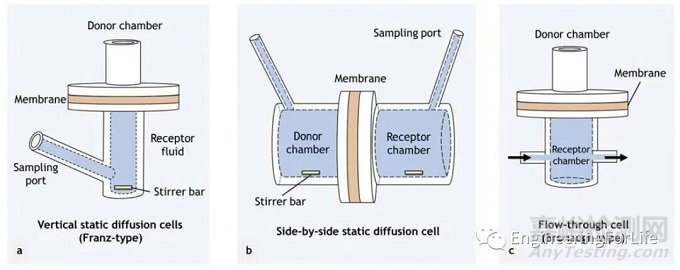
图7 用于研究皮肤渗透的扩散细胞类型。(a)垂直静态扩散池。(b)并列静态扩散池。(c)流通池[1]
与传统的体外弗朗茨池渗透研究方法相比,微针通常先应用于皮肤,然后将供体室安装到受体室上。
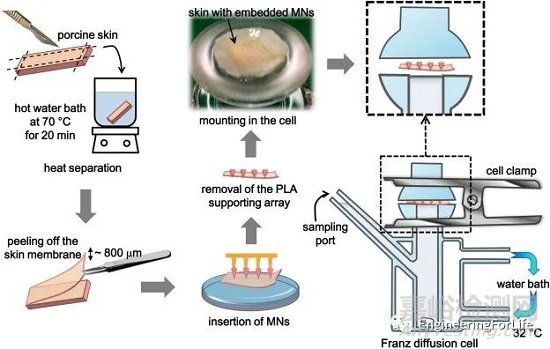
图8 使用特制的Franz扩散池进行体外透皮给药实验的详细过程示意图[9]
7生物安全性
制备MNs所使用的原料必须无毒无害,不会引起机体的免疫排斥等副反应。MNs过程中和使用后,不会对机体产生细胞毒性、血液毒性以及组织器官毒性,可分别通过相关手段(活/死细胞染色、溶血实验、心/肝/脾/肺/肾等组织器官切片观察等)检测MNs的安全性能。
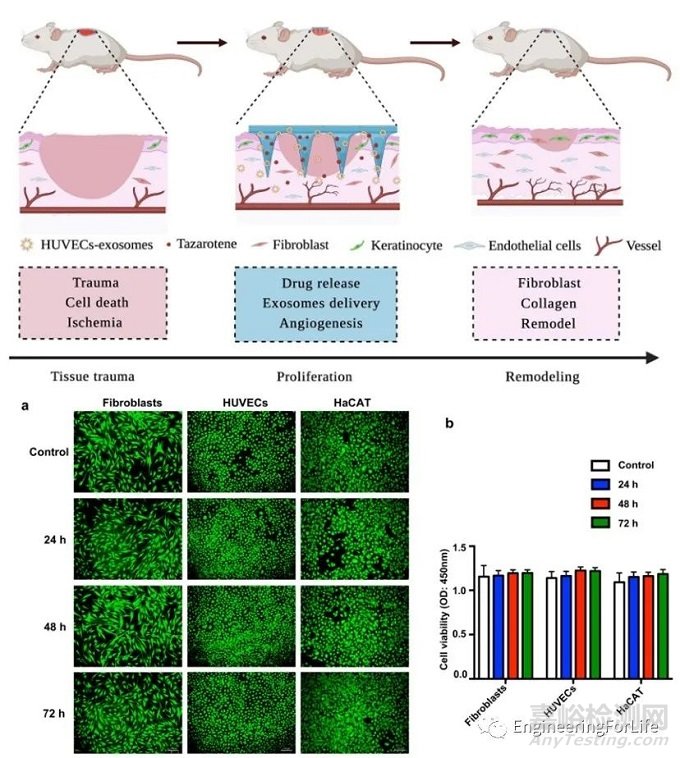
图9 GelMA基MNs的生物相容性结果图[10]
EFL 小贴士
通过对以上七类常见MNs性能测试表征方法及案例分析的学习,研究者可从多角度综合分析课题设计中MNs的治疗效果。
参考资料:
[1] Sabri A H, Kim Y, Marlow M, et al. Intradermal and transdermal drug delivery using microneedles–Fabrication, performance evaluation and application to lymphatic delivery[J]. Advanced drug delivery reviews, 2020, 153: 195-215.
[2] Aoyagi S, Izumi H, Fukuda M. Biodegradable polymer needle with various tip angles and consideration on insertion mechanism of mosquito's proboscis[J]. Sensors and Actuators A: Physical, 2008, 143(1): 20-28.
[3] Bediz B, Korkmaz E, Khilwani R, et al. Dissolvable microneedle arrays for intradermal delivery of biologics: fabrication and application[J]. Pharmaceutical research, 2014, 31(1): 117-135.
[4] Yu W, Jiang G, Zhang Y, et al. Polymer microneedles fabricated from alginate and hyaluronate for transdermal delivery of insulin[J]. Materials Science and Engineering: C, 2017, 80: 187-196.
[5] Larraneta E, Lutton R E M, Brady A J, et al. Microwave‐assisted preparation of hydrogel‐forming microneedle arrays for transdermal drug delivery applications[J]. Macromolecular materials and engineering, 2015, 300(6): 586-595.
[6] Larraneta E, Lutton R E M, Brady A J, et al. Microwave‐assisted preparation of hydrogel‐forming microneedle arrays for transdermal drug delivery applications[J]. Macromolecular materials and engineering, 2015, 300(6): 586-595.
[7] Kusamori K, Katsumi H, Abe M, et al. Development of a novel transdermal patch of alendronate, a nitrogen‐containing bisphosphonate, for the treatment of osteoporosis[J]. Journal of Bone and Mineral Research, 2010, 25(12): 2582-2591.
[8] Gomaa Y A, Morrow D I J, Garland M J, et al. Effects of microneedle length, density, insertion time and multiple applications on human skin barrier function: assessments by transepidermal water loss[J]. Toxicology in Vitro, 2010, 24(7): 1971-1978.
[9] Chen M C, Huang S F, Lai K Y, et al. Fully embeddable chitosan microneedles as a sustained release depot for intradermal vaccination[J]. Biomaterials, 2013, 34(12): 3077-3086.
[10] Yuan M, Liu K, Jiang T, et al. GelMA/PEGDA microneedles patch loaded with HUVECs-derived exosomes and Tazarotene promote diabetic wound healing[J]. Journal of nanobiotechnology, 2022, 20(1): 1-18.

来源:Internet


