您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-23 08:45
严重烧伤创面通常会破坏皮肤关键细胞的功能,导致再上皮化和创面再生延迟。促进关键细胞的活动对烧伤创面修复至关重要。角质细胞生长因子-2(KGF-2)参与上皮细胞的增殖和重塑,酸性成纤维细胞生长因子(aFGF)是成纤维细胞和内皮细胞生长和分化的关键介质。然而,烧伤创面较厚的焦痂和恶劣的环境往往会降低成纤维细胞生长因子(FGF)向创面的递送效率。
为解决以上问题,来自温州医科大学吴疆、李晓坤和肖健团队制备了一种新型的微针贴片,用于连续经皮给药KGF-2和aFGF,以增强烧伤创面治疗效果。本文作者将包载有aFGF的NPaFGF 纳米颗粒与KGF-2共同包裹在微针贴片(KGF-2/NPaFGF@MN)中实现经皮给药,达到烧伤创面愈合的效果。结果表明,KGF-2/NPaFGF@MN可成功穿过焦痂,并依次释放KGF-2和aFGF。本研究通过减少坏死组织、加快再上皮化、增强胶原沉积和增加新生血管等多方面影响,加快了创面愈合速率。进一步的证据表明,烧伤创面中缺氧诱导因子-1α(HIF-1ɑ)和热休克蛋白90(Hsp90)的表达显著升高,从而促进创面愈合。相关工作以题目为“Microneedle Patch for Transdermal Sequential Delivery of KGF-2 and aFGF to Enhance Burn Wound Therapy”于2024年4月16日发表在杂志《small》上。
1. 主要内容
通常根据严重程度和穿透皮肤层的程度烧伤可以被分为第一、第二、第三和第四度。例如,二度烧伤同时造成皮肤的表皮和真皮层损伤,会影响血管,并部分破坏疼痛感受器。烧伤通常会导致慢性伤口。烧伤的严重性归因于其会破坏角质形成细胞,导致再上皮化延迟,此过程通常伴有焦痂形成,进一步抑制表皮再生。其次,受损的血管无法为创面提供足够的氧气和营养,导致真皮创面愈合延迟。因此,迫切需要有效的策略来促进早期上皮化、血管重建和无瘢痕的创面修复。
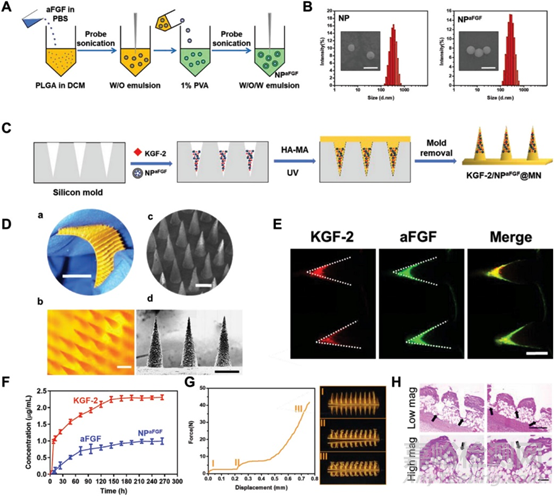
图1 微针制造与表征
使用甲基丙烯酸化透明质酸(HA-MA)在硅微针模具中经过核黄素诱导的光聚合方法构建了包载有KGF-2和NPaFGF的微针贴片。KGF-2/NPaFGF@MN由于存在核黄素而呈黄色,此微针贴片易弯曲,是具有排列良好的锥形针。对KGF-2和aFGF进行荧光标记,可以在共聚焦影像中直观地观察到微针对KGF-2和NPaFGF实现了完美的装载。为进一步证明微针的有效穿透作用,在压缩情况下测试了微针的强度。随后,作者对微针在皮肤表面的穿透能力进行了探究,对烧伤创面小鼠给予KGF-2/NPaFGF@MN处理,取皮肤进行H&E染色,观察微针在皮肤中的穿透深度。结果表明,该微针可成功用针损伤皮肤,穿透皮肤真皮层,使生长因子进入皮肤发挥促进伤口愈合的作用成为可能。
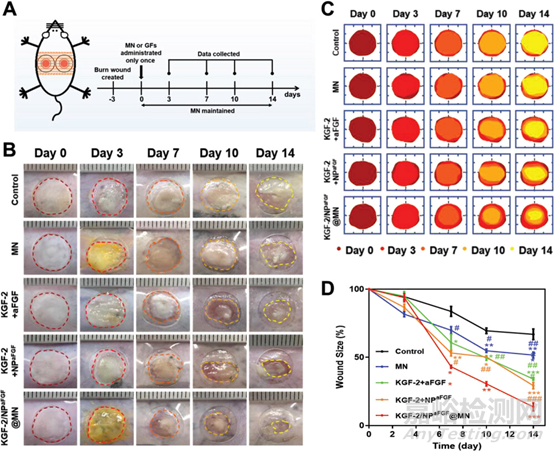
图2 伤口愈合实验
本文利用小鼠二度烧伤模型评估KGF-2/NPaFGF@MN对烧伤创面的治疗效果。创面成功创建后,将PBS(对照)、空白微针(MN,不加载生长因子)、游离KGF-2与游离aFGF的组合、游离KGF-2与NPaFGF的组合以及KGF-2/NPaFGF@MN处理创面。于第0、3、7、10、14天拍摄创面照片,直观评价创面愈合效果,并根据照片测量相对创面大小,定量比较各组创面愈合情况。
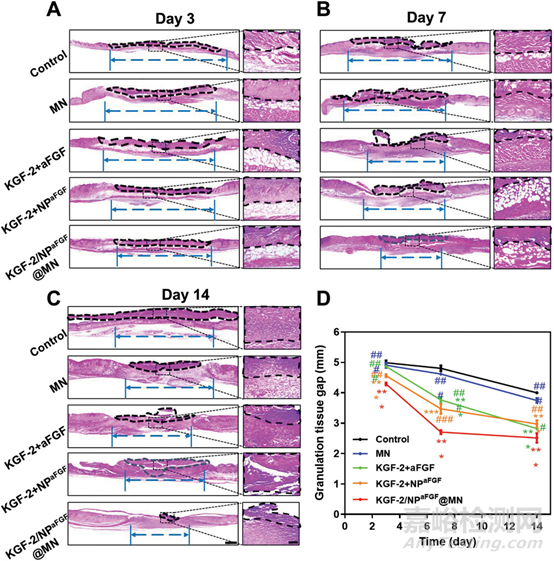
图3 不同处理后创面组织H&E染色的代表性图像以及创面肉芽组织间隙统计曲线
在组织病理学水平进一步评估KGF-2/NPaFGF@MN对烧伤创面的治疗效果。分别于第3、7、14天对烧伤创面进行H&E染色组织学评估。第3天,各组均出现表皮损伤,真皮水肿,治疗后第7天,创面逐渐进展至修复期。随着时间的推移,各组创面愈合率的差异越来越明显。第14天,与其他组相比,对照组整体上皮化程度最低,表皮再生最差,这可能是由于残留的坏死表皮阻碍了创面愈合。KGF-2/NPaFGF@MN组瘢痕下有新生细胞,创面上皮层清晰,表皮大面积修复。真皮水肿消失,外观接近正常皮肤。值得注意的是,由于坏死组织容易被苏木精染色,对照组和微针组图像均呈现出较强的颜色。根据H&E染色,进一步对治疗后创面的肉芽组织间隙进行统计分析,发现KGF-2/NPaFGF@MN组肉芽组织间隙最窄。所有数据表明KGF-2/NPaFGF@MN的创面愈合效果最好。
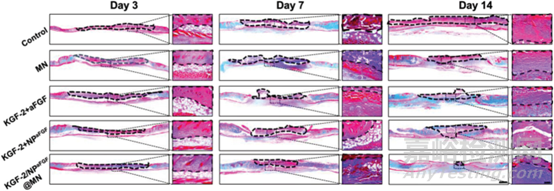
图4 不同处理后的创面组织切片Masson三色(MT)染色的代表性图像(蓝色=胶原;红色=细胞质和肌纤维)。苏木素(紫色)染色细胞核。黑色的圆圈表示焦痂。
Masson三色染色结果说明了组间胶原形成的差异。治疗后第3天,各组真皮均可见少量胶原沉积。第7天时真皮胶原沉积增多,第14天时胶原沉积量更大。第14天,KGF-2/NPaFGF@MN组成熟胶原纤维明显(亮蓝色)且排列密集,其余各组仍有部分未发育的胶原纤维。这进一步证明了KGF-2/NPaFGF@MN的愈合效果优于其他各组。
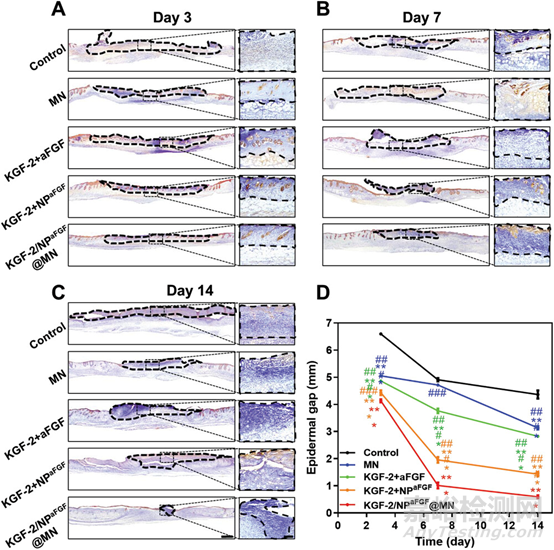
图5 不同处理后创面组织细胞角蛋白免疫组织化学染色代表性图像以及创面表皮间隙的统计曲线
在创面修复过程中,角质形成细胞从创面边缘迁移至创面中心,并逐渐闭合创面,这一过程称为再上皮化。实际上,再上皮化对烧伤创面愈合至关重要,烧伤创面表皮的严重受损会影响角质形成细胞的迁移。因此,在本研究中,我们对角蛋白进行了免疫组织化学染色,以评估伤口愈合过程中的再上皮化。各组创面组织均出现不同程度的再上皮化。在整个愈合过程中,对照组再上皮化最慢,表皮迁移速度较慢,而KGF-2/NPaFGF@MN组表皮迁移速度最快,与H&E和MT染色结果一致。此外,图6中黑色虚线所示的焦痂也表明,应用KGF-2/NPaFGF@MN可以减少焦痂形成。由此可见,KGF-2/NPaFGF@MN组通过加速角质形成细胞迁移、成纤维细胞增殖、肉芽组织形成和胶原沉积,促进创面更快愈合。
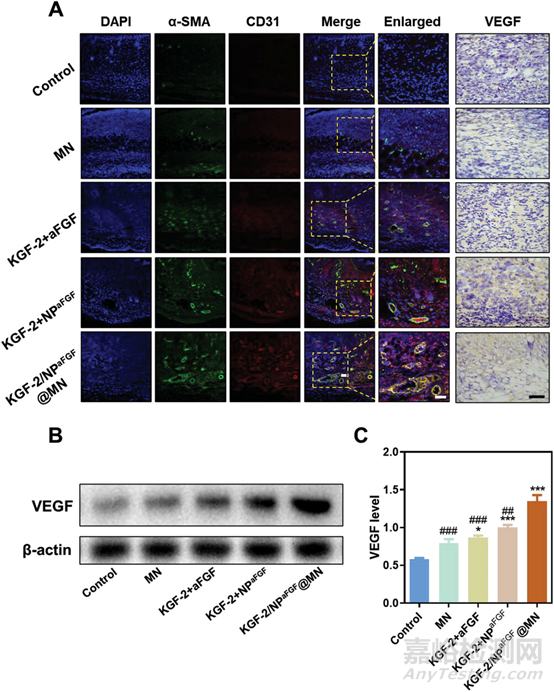
图6 微针贴片促进血管生成
由于创面部位的血管严重受损,因此血管系统及时再生(血管生成)对于创面修复至关重要。有鉴于此,作者通过CD31与α-SMA两个指标对血管进行双重免疫荧光染色,来检测微针在创面中诱导血管生成的能力。CD31和α-SMA是血管生长的两个重要指标,其表达变化提示血管生成的动态平衡。结果表明,KGF-2/NPaFGF@MN处理后的创面血管生长明显加快,对创面的再生具有明显的支持作用,是所有治疗方法中创面愈合效果最好的。
血管内皮生长因子(Vascular endothelial growth factor, VEGF)在协调血管稳态中起着重要作用,是血管发生和血管生成的主要调节因子之一。KGF-2/NPaFGF@MN中VEGF的高表达被认为促进了血管生成,最终促进了伤口愈合。因此,KGF-2/NPaFGF@MN通过促进新血管系统的快速再生促进烧伤创面愈合。
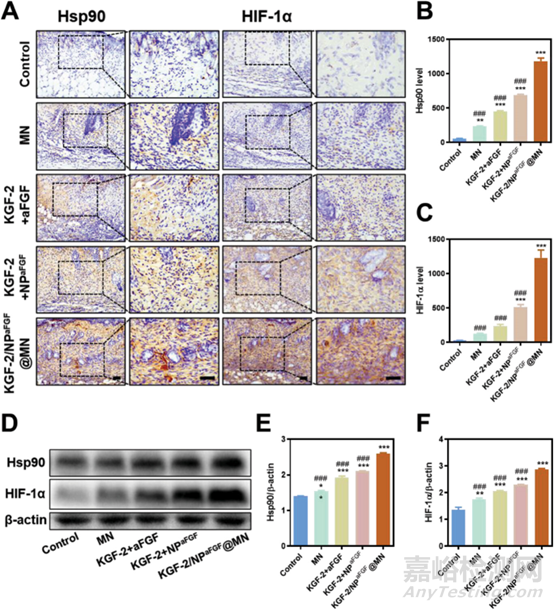
图7 微针可上调HIF-1α和Hsp90的表达
HIF-1α和Hsp90都是通过调节血管生成和血管重塑协同加速创面愈合的关键因子。烧伤后血管完整性受损,导致HIF-1α和Hsp90表达下调。本研究采用免疫组织化学染色和蛋白印迹法检测HIF-1α和Hsp90在创面中的表达,以进一步阐明创面愈合的机制。如图8A所示,与Hsp90和HIF-1α表达最低的对照组相比,MN和含aFGF的游离KGF-2都调节了Hsp90和HIF-1α的水平,表明MN和生长因子可以正向启动Hsp90和HIF-1α的表达。而KGF-2+NPaFGF组的Hsp90和HIF-1α染色阳性率高于KGF-2+aFGF组,表明纳米粒的aFGF释放模式可以提高aFGF在创面中的生物效应。最重要的是,KGF-2/NPaFGF@MN处理组显示出极高的Hsp90和HIF-1α水平,证实了MN作为药物递送系统以及KGF-2和NPaFGF双重驱动因子在烧伤创面修复中的积极作用。综上所述,这些结果证实了烧伤创面中Hsp90和HIF-α的上调可显著提高创面修复率。它们可能成为未来促进烧伤创面再生的靶调控因子。
2. 总结与展望
在本研究中,开发了一种新型的微针贴片,以实现烧伤创面治疗中KGF-2和aFGF的不同释放模式。首先将aFGF包裹在PLGA纳米粒中,实现aFGF相对缓慢的释放。然后将NPaFGF与KGF-2结合形成MN补片(KGF-2/NPaFGF@MN)。以核黄素作为光引发剂制备MN。本文是第一个报道基于生长因子释放核黄素的微核贴片的文献。KGF-2/NPaFGF@MN在体内表现出较高的愈合效率,减少了焦痂形成,增加了肉芽形成、胶原沉积和新生血管形成。这是因为KGF-2/NPaFGF@MN通过释放KGF-2促进再上皮化和aFGF促进真皮形成以闭合创面间隙,共同加速创面修复过程。此外,免疫染色和蛋白印迹法研究表明,这种新型补片可以显著上调Hsp90和HIF-1α,进而诱导血管生成和促进伤口愈合。以上结果表明,联合或序贯释放不同的GFs是治疗烧伤创面的一种有前景的策略。
文章来源:https://doi.org/10.1002/smll.202307485

来源:Internet


