随着“以患者为中心”的研发理念逐步成熟,依托于创新技术的疫苗药学研究策略也在不断升级。本文聚焦于疫苗产品有效性评价的痛点开展分析,具有免疫原性替代终点的成熟疫苗远远少于当前在研疫苗数量,研发过程更应加强过程控制,在难以避免的研发变更中基于质量可比要求有效评估关键质量属性,实现每一道生产工序工艺质量可比,以此优化研究策略。
近年来,因人民生活水平提升、疾病预防需求增加、技术迭代加速等因素,疫苗产品在我国医药市场的消费占比呈上升趋势。而《疫苗管理法》《“十四五”医药工业发展规划》等政策法规的出台,显示国家政策层面积极鼓励疫苗企业加强研发与技术创新,对我国疫苗行业的发展提出了更高的标准与要求。这也就要求广大疫苗企业摈弃传统研发观念,基于“以患者为中心”的理念,从传统数据收集逐步聚焦到患者需求本身,坚持以患者为中心,即从患者角度进行药物开发、设计、实施和决策,将患者对药品安全性、有效性等的关键需求纳入研发设计、工艺开发等关键考虑要素中 [1]。
疫苗作为特殊的生物制剂,作用原理为通过诱导产生特异性免疫应答使健康人群免于患病,主要面向健康人群,对安全性和有效性的要求比普通药物更高。区别于普通药物的特性在于其预防效果不能直观体现,评价疫苗的传统方法是比较疫苗组和安慰剂组的临床终点事件发生率(临床保护性研究),但是存在研发周期长、入组人数多、费用高昂等问题,限制了产品获批上市的速度,当前行业内已在积极探索通过临床替代终点评价疫苗的有效性。
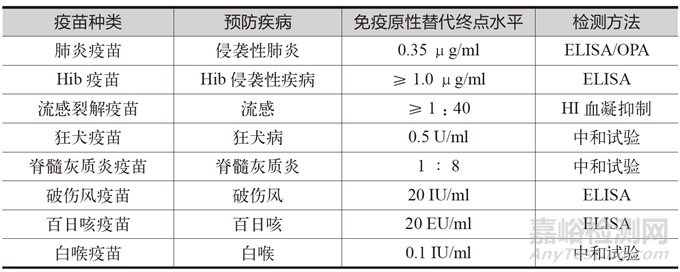
世界卫生组织(WHO)提出了免疫临床替代终点概念,突出可预测疫苗保护效果的免疫学反应指标建立的重要性,能有效减少人群样本量。基于疫苗已有 200 多年的成熟发展历史,部分疫苗已建立了免疫学的临床替代终点,有相对明确的免疫学指标,即有相关性、明确的阈值和统一的检测方法,能够通过免疫后一定时间(7 天、14 天、28 天)内抗体终点水平以及非劣效水平判断主要免疫终点,或通过其他时间的抗体水平、免疫持续性等判断次要免疫终点,代表性疫苗主要有流感疫苗、肺炎疫苗、乙肝疫苗等 [2],具体见表 1。
表1 预防性疫苗的免疫原性替代终点水平
但截至2023 年初,全球疫苗研发种类高达960 余种[3],灭活疫苗、减毒疫苗、重组蛋白疫苗、核酸疫苗、病毒载体疫苗等技术路线多元化发展,大部分疫苗的免疫原性替代终点仍处于摸索阶段,更多的是使用保护率指标来指征疫苗的有效性,尤其是创新技术疫苗的有效性更难以评价。而疫苗研发过程中的不确定性,可能会出现大量工艺变更甚至是场地变更,使得如何可以确保变更后的产品工艺状态仍然代表原临床确认后的产品工艺,使其具有相同的安全性和有效性是研发阶段的重点工作。
2、发生变更后疫苗有效性控制关键要点研判
疫苗在研发过程中发生变更往往不可避免,重要的是在发生工艺变更、场地变更等重大变更时,根据现有的知识和研究确保变更前后质量高度相似以控制产品有效性,并且能用先验知识和技术开展预测,对关键点进行控制,以此证明在工艺变更上存在的差别不足以对产品的安全性或有效性产生不利影响[4]。最重要的是在开展可比性研究时,使用已被临床确证过的批次工艺为中心,获得该工艺过程控制的数据,保证临床批次的生产工艺与因商业化而变更后的工艺的药学数据具有可比性。因多数在研疫苗没有免疫学替代指标,若药学数据无法可比,且非临床研究亦无法证实变更对产品安全性、有效性的影响,需考虑进行桥接性或确证性的临床试验,直接影响研发进程。
2.1可比性研究设计
可比性研究应基于体系化的设计,此阶段从风险评估要求出发,用分析手段对药物的质量属性做不同维度的分析,以分析其可比性。对研发过程的变更实施分阶段管理,早期临床阶段关注安全性风险,发生的变更实质上属于药学研究信息不断充实、完善和修订的过程。确证性临床阶段如发生药学变更,应探索更多的实验数据进行可比分析,重点关注变更前后的过程数据、放行检测、长期/ 加速稳定性及强制性降解等可比性研究[5],涉及场地变更等情况的关键变更还需要明确所有工序的过程控制可比。当药学可比性研究证明变更前后的质量具有较大差异或存在药学数据缺失导致的变更前后不可比等情况,需进一步开展非临床或/ 和临床桥接研究,对于没有合适的免疫原性替代指标进行临床评价的疫苗产品,则需考虑通过临床保护率研究确证变更后有效性。
这些研究对疫苗有效性影响的风险级别逐步升高,对企业成本、开发进度等项目推进过程影响也在逐步增大,因而在前期设计过程中,一方面应将风险前置,尽可能通盘考虑以减少非临床与临床可比研究的开展;另一方面,设计阶段应前瞻性设置可比性研究的验收标准,包括适应不同阶段的疫苗产品质量标准、变更前后数据趋势分析对比结果验收标准等,综合设置定性标准与定量标准,实现科学化的可比性研究。
2.2可比性研究实施要求
第一步,需要收集工艺的关键质量属性,工艺变更的内容以及原因,变更前的各项数据。第二步,要基于对工艺的理解,确认可能被工艺变更所影响的质量属性。第三步,针对这些可能受影响的关键质量属性,设计充分必要的分析策略以证明变更的影响。可比性研究开展过程基于风险递进的原则,针对变更的不同大小,有策略地选择评价策略,可以对工艺性能、放行数据、产品表征、稳定性研究、非临床与临床研究等关键点的数据进行分析和评价,确认变更影响。
工艺性能可比性研究中应重点突出工艺比对信息,分析原液和制剂每一步骤的关键控制点,对中间控制数据进行逐一比对,确保变更前后的工艺控制能力高度相似,避免因变更导致工艺控制能力下降。
批放行数据的可比性研究同样重点突出数据的比对信息,对生产数据、放行检测数据等关键信息进行控制,保证变更前后放行的状态及标准不受影响。
产品表征可比性研究应突出表征分析的关键信息,通过对一级、二级高级结构的对比,潜在杂质及工艺杂质的残留分析等,控制变更前后产品的结构、性能、安全性等表征一致性。
稳定性可比研究也应突出变更前后稳定性变化分析的关键信息,通过稳定性试验进一步发现在常规试验中难以检测的细微差距,主要关注加速稳定性、强制降解稳定性研究中涉及的降解模式、途径和速率等重点内容是否可比。若稳定性研究结果表明变更前后存在差异,则必须在已有数据的基础上进行额外的研究评价,并在生产及贮存过程中采取额外措施以控制不可预期的差异[6]。
2.3可比性研究验收要求
可比性研究完成后应以工艺设计阶段确定的各关键质量属性验收标准进行验收。针对工艺可比研究验收,重点关注工艺步骤、过程参数、过程控制、抗原、效力、杂质及外源因子去除能力分析以及历史数据等结果可比性,必要时需考虑中间产物的可比性;针对质量可比研究,重点关注分析方法适用性、批放行以及扩展表征的结果和历史数据可比性;针对稳定性可比研究,重点关注常规放行检测难以考察的差异点在变更前后的可比性。
实施可比性研究验收时应基于统计学原则与知识,结合质量属性和分析方法的变异程度研判定性和定量评估中需要的批次数量。变更前后的质量属性若只是符合放行标准,通常不足够证明其可比性;很多时候,还需要使用更为严格的统计学进行判定。判定逻辑主要分为两大类:第一类是比较变更前后质量属性的统计学分布,通常使用等效性检验;由于等效性检验对于变更前后的批次数有一定的要求,所以这个方法的使用有一定的局限性;第二类的判定逻辑是用变更前的数据设定一个可接受的范围,若变更后的质量数据落在这个范围内,那么可以认为变更前后质量可比。
为有效观察工艺质量变化趋势,至少需要三批的工艺质量属性数据,因而在上市申请阶段,应至少进行临床批和商业化批次各三批的药学对比研究。而且这些批次的数据均应满足质量标准要求且趋势一致,表明不同阶段生产工艺所生产的产品的有效性具有一致性,质量可比。以某重组蛋白疫苗为例,工艺发生变更后需要对比关键质量数据,抗原含量作为有效性指标之一,开展Ⅲ期临床批与商业化各三批对比,结果趋势一致,可以满足要求,表明变更前后的生产工艺所生产的产品的有效性、安全性具有一致性,质量可比,如图1所示。
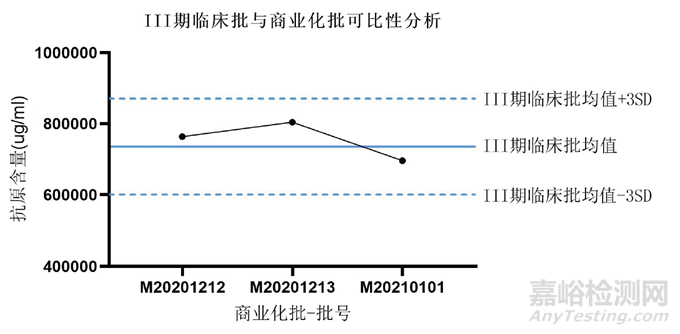
图1 Ⅲ期临床批与商业化批可比性分析
3、基于工艺设计实现研发策略优化
基于“以患者为中心”的研发理念,工艺设计阶段最重要的产出是稳定且高产的生产工艺,它从源头赋予了产品质量,是研发策略优化的重要基础。
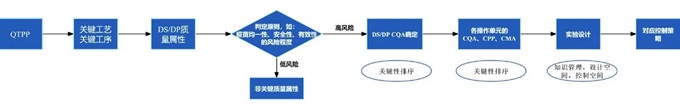
有效的研发策略首先要求每个关键工序的成功与否均有评价标准,这要求每个关键工序的关键质量属性(CQA)和工艺控制能力可被评价,其中工艺控制能力也需要根据关键质量属性(CQA)对应的关键工艺参数(CPP)计算,因而各工序的关键质量属性(CQA)的设计至关重要。目标产品质量概况(QTPP)虽然为CQA 的评估提供了起始点,但此阶段由于对产品的认识才刚刚开始,评估出的CQA 并非最终都是关键的,只是可能的关键质量属性(pCQA)。而将其确认为CQA 的过程还需要不断评估,应结合法规要求、分析与生物学特征及发表文献等先验知识,利用风险评估工具如失效模式与影响分析(FMEA)、危害分析和关键点控制(HACCP)等对每一个pCQA 进行评估并证明合理性, 严格执行工艺控制,保证各项CQA 在适当限度范围内,以期达到控制产品质量的目的[7]。
其次,要求完善的工艺表征以确保工艺一致性。应收集目标产品现有的科学知识,梳理对目标产品的工艺理解以及产品理解,在过程中不断积累产品知识与数据。在工艺开发前利用现有资料评估潜在的CQA 以指导工艺表征开展。确定初步的参数后,根据潜在CQA 确定工艺步骤的优先级,并进一步评估以确定潜在的CPP。在工艺表征阶段利用缩小模型(SDM)、试验设计(DOE、单因子、最差条件研究)等进行科学研究,初步表征产品的结构和杂质信息后,通过风险评估定义设计空间并形成控制策略草案,实现筛选表征实验中的潜在差异,以最大程度地减少试验,并使所获知识最大化,具体流程参见图2。
图2 工艺设计关键要点流程分析
以上市为目标的疫苗产品研发策略涉及药物开发、临床前研究、临床研究及注册申请等关键环节,其中工艺设计阶段的产出直接决定了在研疫苗的研发方向,并与产品有效性密切相关[8]。此阶段应采用上述评估CQA 的合理流程与方法确定各个工序的CQA,形成工艺可比的基础并有效开展工艺表征。当出现工序变化、工艺变化、场地变化等重大变更后,可基于CQA 数据对比变更前后的质量趋势,判断是否在药学上可比。同时在研发进程中应全面记录研发过程的相关数据,保证真实性和准确性,所拥有的可比性数据越多,越能确保工艺的变更不影响患者用药的安全性和有效性。
4、总结和展望
本文以优化疫苗研发策略为目的,在多数疫苗无免疫原性替代指标判断有效性的情况下,分析了变更后开展可比性分析的关键要点,并基于研发工艺设计明确了研发策略应建立评价标准和完善的工艺表征,为“以患者为中心”的疫苗研发策略优化提供了理论依据。
随着国家对疫苗和生物制品行业的日益重视,产品的研发创新成为了推动行业发展的核心动力,也是企业从日益激烈的市场竞争中脱颖而出的有利武器。然而,仅有研发创新是不足够的,一个成功的产品从开发到上市既需要创新理念的支持,也需要技术平台的突破、高质量目标的坚持、成本与进度之间的权衡等。其中,产品质量是研发创新的坚实后盾,也是赢得消费者信任和市场认可的关键。因此,企业必须将质量放在首位,坚持质量源于设计的创新理念,严格把控研发过程质量,以确保每一项研发成果都能转化为安全、有效的产品。只有高质量的产品,才能真正地造福人类,推动行业的可持续发展。
参考文献
[1]F D A . P a t i e n t - F o c u s e d D r u g Development: Selecting, Developing,or Modifying Fi t - f o r-Purpose Clinical Outcome Assessments [EB/OL].(2022-06).https://www.fda.gov/regulatory-information/searchfda-guidance-documents/patientfocused-drug-development-selectingdeveloping-or-modifying-fit-purposeclinical-outcome.
[2]金鹏飞,李靖欣,周洋,等. 评价疫苗效力的免疫学替代终点[J] 中华预防医学杂志. 2015,49(12):1110-1114.
[3]J i a n y i n g Yu e , Yu e h u a L i u ,Mingliang Zhao,et al.The R&D landscape for infectious disease vaccines [J].Nature Reviews Drug Discovery.2023,22:867-868.
[4]ICH,Comparability Of Biotechnological/Biological Products Subject to Changes in Their Manufacturing Process Q5E[EB/OL].(2004-11-18).https://database.ich.org/sites/default/files/Q5E%20Guideline.pdf.
[5]李敏,常卫红,高恩明. 治疗用生物制品上市后变更的药学可比性研究[J]. 中国生物制品学杂志,2012,25(10):1399-1041.
[6]李敏,高恩明. 疫苗生产场地变更质量可比性研究的总体思考[J].中国生物制品学杂志,2013,26(02):289-291+296.
[7]景荣先,曾媛,张国林. 单克隆抗体类生物制品关键质量属性[J]. 中国医药科学,2023,13(18):177-180.
[8]李敏,许嘉齐. 从“质量源于设计”角度浅谈多糖- 蛋白结合疫苗药学研发的考虑[J]. 中国新药杂志,2017,26(14):1623-1627.