利用芽孢杆菌壳聚糖酶BsCsn46A将壳聚糖生物转化为可溶性抗炎壳聚糖低聚糖(CHOS)。酶促反应48 h后,大部分最终产物为二聚体和三聚体。所有CHOS产物对人成纤维细胞都没有毒性。CHOS对LPS诱导的人巨噬细胞炎症生物活性分析表明,不同生物转化过程产生的CHOS具有抗炎活性,其大小取决于底物的类型和生产过程。乳酸和盐酸均可用于溶解壳聚糖;但乳酸溶液生成的产物经冻干后吸湿性较高,不适合长期储存。离心和过滤都会影响其抗炎活性。对已知结构的标准CHOS分析表明,还原性乙酰基和聚合度(DP)对CHOS的生物活性至关重要。重要的是,当应用水平高于最佳浓度时,某些标准的CHOS和CHOS混合物可能诱发炎症。这些结果支持CHOS作为抗炎药物的潜力,揭示批次间的变化和可能的副作用,表明CHOS制剂的质量保证是必要的。
相关研究内容以“Valorization of shrimp processing waste-derived chitosan into anti-inflammatory chitosan-oligosaccharides (CHOS)”为题于2023年11月2日发表在《Carbohydrate Polymers》。泰国素罗娜丽科技大学的Montarop Yamabhai作为文章一作兼通讯。
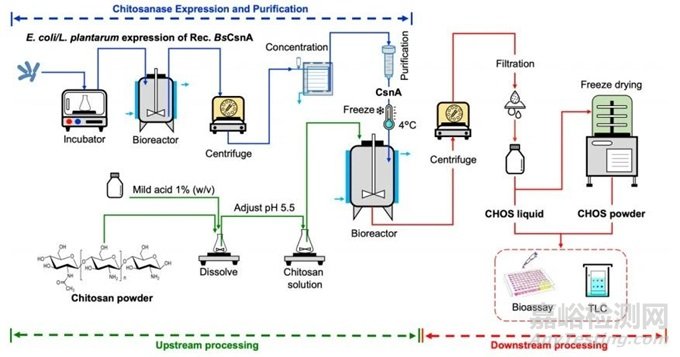
图1 小型、大规模CHOS生产过程示意图
由于CHOS相对于化学和物理方法的优势,以及控制降解反应的能力,因此采用酶水解法生产CHOS。本研究中小规模和大规模的CHOS生产示意图如图1所示。该过程可分为3个主要部分。首先利用大肠杆菌或食品级植物乳杆菌的表达来生产重组BsCsnA,然后将壳聚糖粉末溶于温和酸中的CHOS生产的上游进行加工,最后是CHOS溶解的下游加工过程。
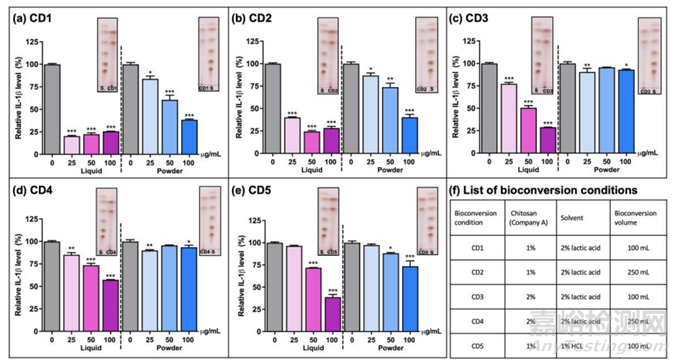
图2 不同生物转化条件(CD1-5)产生的CHOS抗炎活性
在48 h时收集最终的水解产物。对使用盐酸或乳酸的反应实现100%的生物转化,即壳聚糖解聚。接下来使用五种不同的处理条件(CD1-5)产生不同CHOS产物的抗炎特性,使用先前建立的基于测量LPS诱导巨噬细胞中分泌的IL-1β(图2)。虽然效果大小存在差异,但所有CHOS制剂都显示出抗炎活性。一般来说,液体材料比粉末状(冻干)材料效果更好。乳酸中产生的液体和粉末状CHOS(图2a)的抗炎活性均优于盐酸中产生的CHOS(图2e)。通过质谱检测CD1 - CD5反应的最终产物混合物中的CHOS(图2f)。
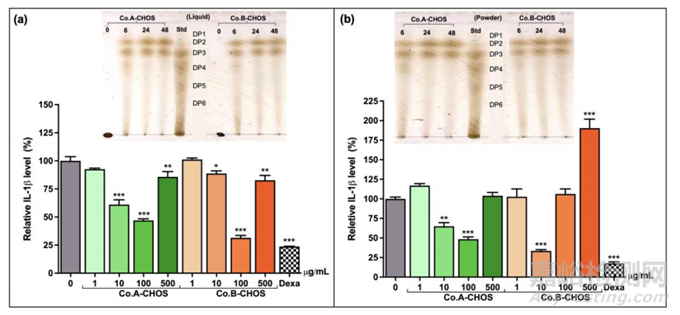
图3 不同壳聚糖来源产生的CHOS生物活性比较
本研究中使用的壳聚糖由泰国两家成熟的壳聚糖供应商提供,分别指定为A公司(Co. A)和B公司(Co.B)。Co. A的壳聚糖是食品级的,呈灰白色外观,由热带海洋干虾壳产生。Co.B的壳聚糖为饲料级,灰白色薄片。图3显示所得液体和粉末状CHOS制剂的薄层色谱分析和抗炎活性。总的来说,Co. A和Co.B的CHOS产物模式相同,二聚体和三聚体占主导地位。两种CHOS制剂均显示出抗炎作用。这些观察表明,CHOS的生物活性和可能的副作用取决于部分壳聚糖来源,从不同生产过程中获得的CHOS产品的整体结构微小差异可能导致对人类细胞的生物效应的重大差异。
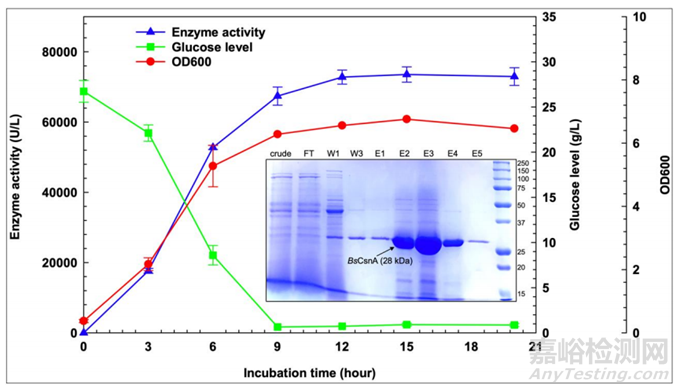
图4 用食品级植物乳杆菌表达系统分泌产生BsCsnA
在5-L生物反应器中分泌产生重组BsCsnA的结果如图4所示。在OD值为600nm时,细胞密度增加(红线)与培养基中BsCsnA活性增加相一致(蓝线)。孵育15 h时,酶活性达到74000 U/L。植物乳杆菌的生长与培养基中葡萄糖的减少(绿线)相对应。该酶可以从培养上清液中纯化。
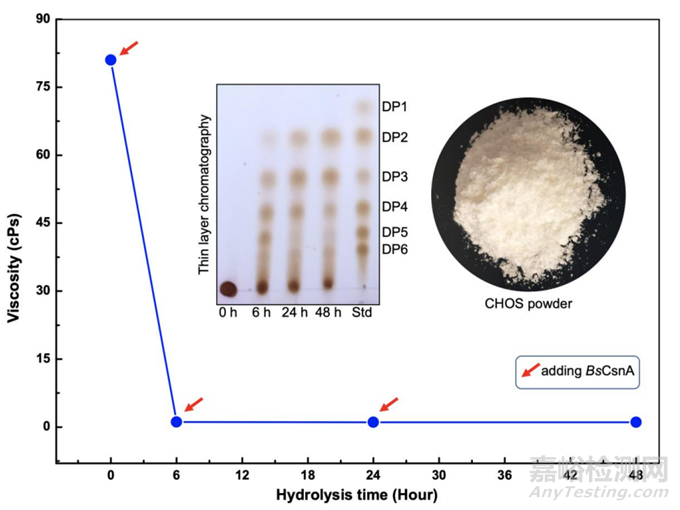
图5 壳聚糖大规模生物转化为CHOS的时间过程
通过薄层色谱法和测量反应混合物的粘度来监测产物的形成(图5)。TLC结果显示,6h后可检测到CHOS,主要是DP3、DP4和DP5。水解48 h后,CHOS主要由二聚体和三聚体组成。
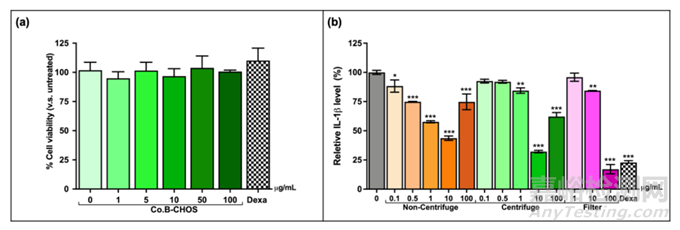
图6 CHOS的生物活性来源于更大规模的生物生产
使用MTT试验评估了潜在的细胞毒性。图6a显示,对任何一种测试的CHOS浓度均未观察到细胞毒性效应。为了确定不同下游过程如何影响CHOS的抗炎活性,将大规模生产的水解反应混合物分为三部分:1)不需要离心直接冻干;2)冻干前离心;3)冻干前通过0.2um尼龙膜过滤器进行过滤。图6b显示了不同的CHOS制剂在不同浓度(0.1~100 ug/mL)下的抗炎活性,用于预处理人THP-1巨噬细胞24小时,然后用LPS刺激巨噬细胞。
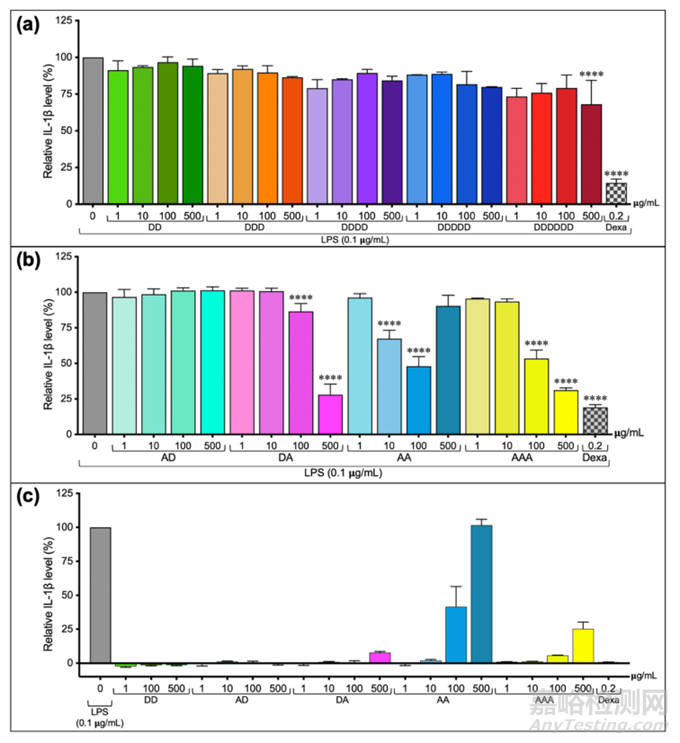
图7 商业化CHOS标准品的抗炎特性比较
用浓度为1~500ug/mL各种标准低聚糖,即D2、D3、D4、D5、D6、DA、AD、AA和AAA检测其抗炎活性。结果证实CHOS的生物活性受到乙酰化模式的影响(图7)。去乙酰化的低聚物(D2-D6)除高剂量的六聚体外,只有轻微的抑制作用(图7a)。相反,非乙酰氨基葡萄糖的二聚体(AA)和三聚体(AAA)均表现出较强的抗炎活性(图7b)。比较四种二聚体(DD、DA、AD、AA)的活性,结果表明还原端A(N-乙酰氨基葡萄糖)是CHOS生物活性的关键。DA轻微诱导炎症,AA诱导IL-1b分泌明显强于AAA(图7c)。以上结果证实乙酰化程度(DA)可以极大地影响CHOS的抗炎活性。
综上所述,本研究建立了利用食品级植物乳杆菌表达系统生产的酶将壳聚糖转化为可溶性壳聚糖(CHOS)的过程。从食品或饲料级壳聚糖中产生的CHOS产物没有显示出对人类细胞的毒性。虽然大多数CHOS制剂对LPS诱导的人巨噬细胞炎症提供保护,但数据显示,生物转化条件的变化可能会影响其抗炎活性,如壳聚糖的来源、实际的水解反应和下游加工。对于某些制剂,当高剂量应用时可以观察到炎症的刺激。标准CHOS的抗炎活性分析表明,非乙酰氨基葡萄糖(A)在还原端和聚合度(DP)的乙酰基对CHOS的生物活性至关重要。为了克服这些挑战,必须进行可靠的壳聚糖原料的质量保证和精确的上游、下游生物工艺标准操作实践(SOP),然后进行体外抗炎活性测试。此外,在申请不同生物工艺生产的CHOS之前,应进行适当的临床前试验和人体研究,以确保CHOS的有效和安全使用。未来的工作应集中于优化上游、下游的生物转化过程,以获得CHOS制剂中最有效的生物活性低聚物。
文章来源:https://doi.org/10.1016/j.carbpol.2023.121546