质量管理模块作为GMP检查六大体系(质量、实验室、生产、设施及设备、物料系统、包装和标签)的重要环节及核心内容,是支撑的药品质量体系的基石。ICH Q10中描述药物质量体系主要包括四个要素,分别是工艺性能和产品质量监督体系、纠正和预防措施体系(CAPA)、管理变更体系、工艺性能和产品质量的管理审核体系,CAPA是药品质量体系的重要组成部分。
CAPA于2006年首次由FDA正式引入制药行业。CAPA是指对存在的或潜在的不合格或不期望情况的原因进行调查分析,采取措施以防止问题再发生或避免发生的全部活动。CAPA不仅是就事论事的对单个问题(偏差、OOS)情况的处理,更是从根本上调查产生问题的原因,采取适当和有效的纠正和/或预防措施以防止其再次发生。对于药企来说,涉及影响药品质量和安全的各方面活动都可能触发CAPA程序。没有CAPA,质量体系就无法正常、高效地运行,药企实施CAPA的目的在于对质量体系不断地完善和改进,从而提高企业质量管理水平,是企业长期发展的必然要求。
一、CAPA概念与法规
根据FDA的描述,CAPA的目的是收集信息、分析信息、识别和调查产品和质量问题,并采取适当和有效的纠正和/或预防措施以防止其再次发生。验证CAPA,与负责人沟通CAPA活动、为管理评审提供相关信息,以及记录这些活动,对于有效处理产品和质量问题、防止其再次发生以及预防或最大限度减少各类故障至关重要。
CAPA通常分为三种类型,分别是纠正、纠正措施、预防措施,定义分别如下(参考ISO 9000:2005(E)):
●纠正(Correction):“action to eliminate a detected nonconformity”.(为消除已发现的不符合项所采取的措施);
●纠正措施(Corrective action):“action to eliminate the cause of a detected nonconformity or other undesirable situation.”(为消除已发现的不合格或其他不期望情况的原因所采取的措施);
●预防措施(preventive action):“action to eliminate the cause of a potential nonconformity or other undesirable situation.”(为消除潜在不合格或其他潜在不期望情况的原因所采取的措施)。
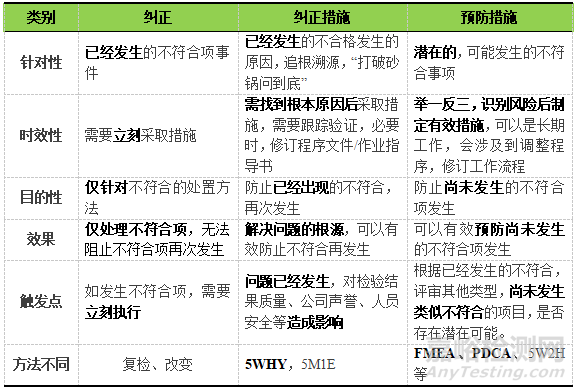
在实际管理过程中需要厘清概念的差异并严格区分,针对上述三个概念,可从时效性、目的、效果、触发点等方面加以对比区分,见表1。
▲表1-CAPA三种类型的对比
1.2 CAPA相关法规
国内CAPA没有专门的法规和指南,但在与制药相关的众多与质量相关的法规指南中,或多或少均涉及CAPA体系的相关内容。以下是归纳了部分涉及与CAPA相关的法规、指南或标准。
ISO 9001:2015质量管理体系标准:这是一个国际标准,规定了组织应建立和维护的质量管理体系要求。其中包括了CAPA的要求,包括问题识别、根本原因分析、纠正措施和预防措施的实施、监督和验证等。
FDA 21 CFR Part 820 – 质量管理体系法规QMSR:这个法规适用于美国制造和分发医疗器械的企业,要求建立和维护适当的质量体系,包括CAPA流程。
FDA 21 CFR Part 211 – 制剂药品的cGMP:这个法规是美国版的GMP,适用于美国药品制造业,规定了质量管理体系的要求,包括CAPA的实施要求。
ICH Q10 制药质量体系:第3节 工艺性能与持续改进(3.2 制药质量体系要素;3.2.2 纠正措施与预防措施体系)中描述“对于由调查研究投诉,产品否决,不合格,召回,偏差,审计,官方检查和发现,及工艺性能趋势和产品质量监控等而产生的纠正措施和预防措施,制药企业应有体系来执行这些措施。”并进一步提出调查问题的要求和CAPA实施目标。
我国《药品生产质量管理规范》(2011版):第十章 质量控制与质量保证(第六节 纠正措施和预防措施;第二百五十二条至第五十三条),分别叙述了中国药监对制药企业建立CAPA系统的总体要求和实施内容。
二、CAPA来源、管理范围及其应用
CAPA通过改进和优化质量管理体系,采取风险防控措施来防范潜在的安全风险。通过CAPA的全面应用,药品制造企业可以保持质量和安全的持续改进,更好地满足监管要求,并为患者提供安全有效的药品。
2.1 CAPA来源
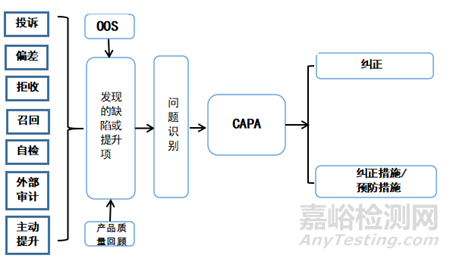
引发CAPA的问题可能源自质量管理体系内的各个方面。包括供应链管理、制造过程、设备维护、人力资源和培训等,罗列制药企业CAPA的通常来源,见图1.
▲图1-制药企业CAPA通常来源
无论出于何种原因或在何处启动CAPA,都应始终从确定问题的那一刻开始立即采取纠正行动,以稳定局势并防止其进一步影响生产和产品质量。
2.2 CAPA管理范围及应用
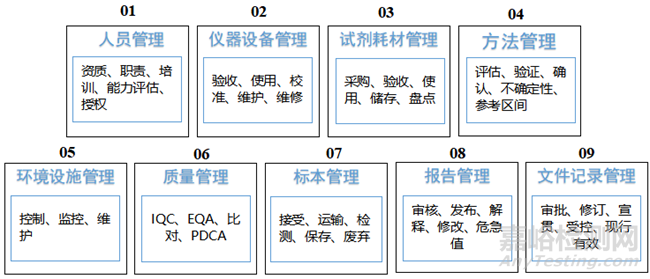
CAPA程序用于解决已经发生的偏差或OOS,并采取措施避免将来出现同样的问题。CAPA的管理范围覆盖了GMP的各个环节,包括人员培训、仪器设备管理、耗材试剂管理、方法管理等,详见图2。
▲图2-CAPA管理范围
ICH Q10描述药品生命周期包括四个阶段:药品开发、技术转移、商业化生产、产品终止,CAPA在药品全生命周期管理中扮演着关键的角色。通过纠正和预防措施来管理风险、处理非合规事件、持续改进质量,并确保符合法规要求,从而确保药品的安全性、有效性和合规性。ICH Q10描述中进一步归纳了CAPA在药品生命周期中的应用,见表2。
▲表2-CAPA系统在整个产品生命周期内的应用
三、CAPA常规流程和实施
CAPA是制药企业质量管理中常用的工具,能够很好地解决问题并预防再次发生。在实施CAPA时,要确保流程规范化、员工参与和培训、数据收集和分析的有效性,并持续监控和改进。
3.1 CAPA常规流程
我国《药品生产质量管理规范》(2011版)第六节:纠正措施和预防措施,第二百五十三条企业应建立实施纠正和预防措施的操作规程,内容包括:
1)对投诉、召回、偏差、自检或外部检查结果工艺性能和质量监测趋势以及其它来源的质量数据进行分析,确定已有和潜在的质量问题。必要时,应采用适当的统计学方法;
2)调查与产品、工艺和质量保证系统有关的原因;
3)确定所需采取的纠正和预防措施,防止问题的再次发生;
4)评估纠正和预防措施的合理性、有效性和充分;
5)对实施纠正和预防措施过程中所有发生的变更应予以记录;
6)确保相关信息已传递到质量受权人和预防问题再次发生的直接负责人;
7)确保相关信息及其纠正和预防措施已通过高层管理人员的评审。
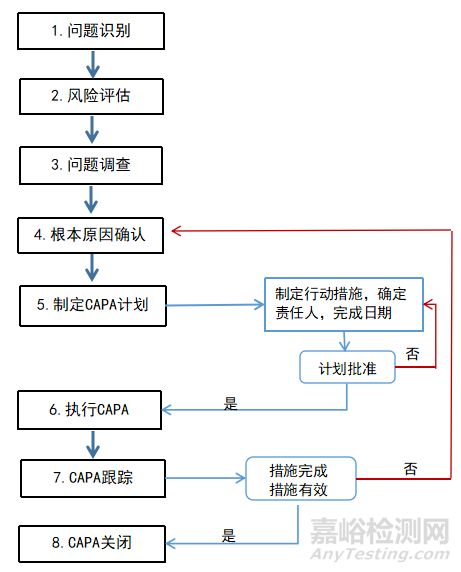
从上述文字可以看出我国GMP对药企CAPA的执行要求和内容做出了框架式的总体规定,执行层面需要企业在遵守法规指南的基础上,根据实际情况具体实施。参考ISO 9001、FDA 21 CFR Part 820等相关标准和法规,结合个人的经验和理解,绘制药企CAPA系统常规流程,见图3。
▲图3-CAPA常规实施流程
由上图可看出,制药企业在实施CAPA时,首先,要识别和评估问题;其次,要通过问题调查,确定其根本原因;再次,制定纠正措施来解决问题,并实施预防措施以防止问题再次发生。在实施CAPA过程中,还需要监督和验证措施的执行,并记录所有的活动和结果,跟踪并评价实施效果,措施完成并且有效,则CAPA关闭;否则,返回流程继续查找根本原因,依次执行后续流程。
3.2 CAPA实施
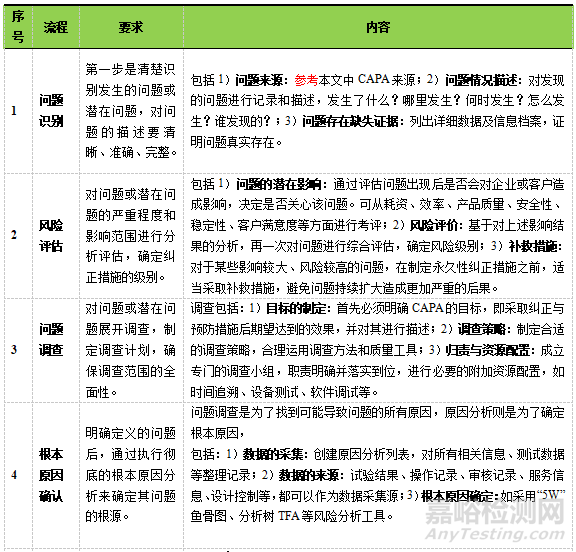
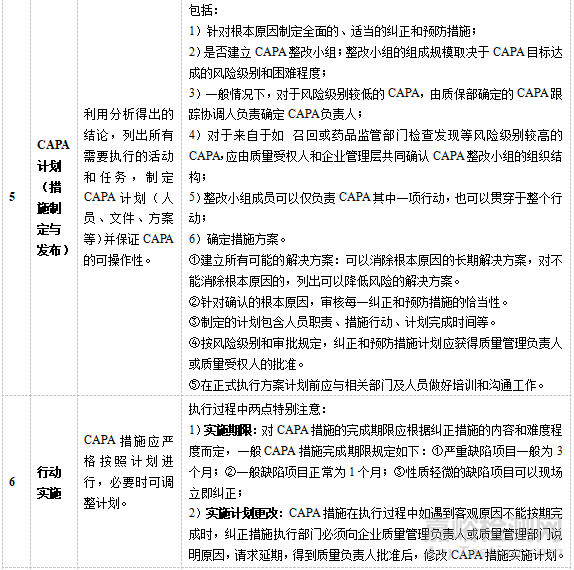
CAPA是质量管理体系的重要组成部分,无论从政府监管的需要还是企业自身产品质量控制以及客户满意度等方面来说,CAPA的有效贯彻实施都是制药企业质量管理体系中不容忽视的内容。结合CAPA常规流程,进一步分析和阐述流程具体实施的要求和内容,见表3。
▲表3-CAPA实施要求与内容
四、总结
在GMP体系下,CAPA实施流程和策略对于确保药品的质量和合规性至关重要。CAPA流程包括问题识别、问题调查、纠正措施的实施、预防措施的制定和验证等步骤。为了有效实施CAPA,必须制定一系列策略,例如明确定义责任和角色、建立合适的纠正和预防方法、建立持续改进和监督机制等。此外,合适的培训和沟通也是成功实施CAPA的关键因素。最终目标是持续改进和提高质量,确保药品的安全性和有效性。通过严格遵循CAPA实施流程和策略,制药企业能够识别和解决问题,防止其再次发生,并符合相关法规和标准的要求。只有致力于不断改进CAPA流程和策略,并将其纳入企业的质量体系中,才能实现持续质量提升的目标。
参考文献
[1]ICH Q10制药质量体系(2008).
[2]《药品生产质量管理规范》(2011版).
[3]ISO 9001:2015质量管理体系标准.
[4]FDA 21 CFR Part 211 –制剂药品的cGMP(2023).
[5]FDA 21 CFR Part 820 – 质量管理体系法规QMSR(2023).
[6]丁晓玥,梁毅.制药企业质量管理体系中纠正与预防措施(CAPA)的实施[J].机电信息,2011(5):5.