长效注射混悬剂(微晶或纳晶)是将原料药粉碎或研磨成微米或纳米晶体并悬浮于水溶液或油溶液中,因具有载药量高和无溶剂残留风险等优势,多用于难溶性药物的制剂开发,目前长效注射混悬剂已成为研究热点之一。长效注射混悬剂在慢性疾病治疗方面具有优势,近年来在抗精神病药物中已得到了广泛应用,已上市产品包括帕利哌酮棕榈酸酯注射混悬剂、双羟萘酸奥氮平注射用悬浮液和阿立哌唑长效注射液均采用微晶或纳晶技术,因此了解长效注射混悬剂(微晶或纳晶)在体内的吸收过程以及吸收影响因素是非常有必要的。
通过查阅相关文献得知,长效注射混悬剂(微晶或纳晶)在机体内的吸收方式主要有两种,第一:扩散血管吸收(包括溶解和相转移),第二:淋巴系统吸收;淋巴系统吸收主要包括细颗粒直接吞噬和局部组织炎症反应,药物通过淋巴系统吸收,但根据文献[1]DARVILLE 等人在研究抗精神病药物长效制剂时通过引流淋巴结的生物分析中发现对于长效注射混悬剂(微晶或纳晶),药物通过淋巴系统吸收对于整个药物吸收的影响几乎忽略不计。因此这篇文章我们重点讲述长效注射混悬剂(微晶或纳晶)通过药物扩散血管吸收的主要影响因素。下面我们先讲述下肌肉注射和皮下注射的生理结构。
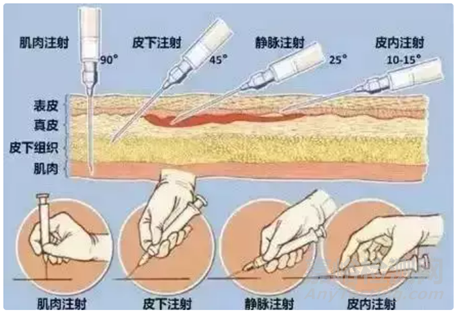
1.皮下注射和肌肉注射的生理结构
皮下注射和肌肉注射的部位一般有丰富的血液和淋巴循环,肌肉注射是将药物注射到骨骼肌中,而在骨骼肌中,1mm2的横切面上,有1000以上毛细血管,因此肌肉注射给药的药物需先经注射部位的结缔组织扩散,再经毛细血管吸收进入血液循环。
皮下注射是将药物注射到皮下组织中,皮下组织有丰富的浅静脉,但其血管少,血流速度低,因此药物吸收较慢。通常情况下肌肉注射比皮下注射吸收要快;通过已上市的长效注射剂(微晶或纳晶),我们可以看出,皮下注射或肌肉注射缓释时长可达一周甚至一个月及以上,比如:帕利哌酮棕榈酸酯注射混悬液、阿立哌唑注射混悬剂等。下图1是不同注射给药途径的部位,让我们更加深入理解不同给药途径的位置。
介绍完皮下注射和肌肉注射的生理特点,下面我们来重点讲述长效注射混悬剂(微晶或纳晶)吸收影响因素。
2.影响长效注射混悬剂(微晶或纳晶)吸收因素
2.1原料因素
2.1.1 粒径
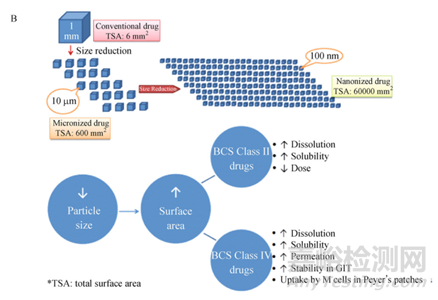
长效注射混悬剂(微晶或纳晶)是将原料药粉碎或研磨成微米或纳米晶体并悬浮于水溶液或油溶液中,通常情况,粒径控制是构建药物晶体长效释药系统的基础,其理论依据为经典的Noyes-Whitney方程和 Ostwald-Freundlich 方程,即随着粒子粒径的减小,粒子表面积增大,药物溶出速率随之增加,进而影响药物的吸收,下图2是不同粒径的总体表面积以及不同粒径对药物溶解度和溶解速率的影响。
图2 Comparison of micro-sized and nano-sized drug crystal in size and distribution in droplets [2]; (B) Advantageous absorption behavior of drug nanocrystals beyond micronized drug
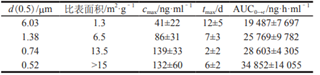
在帕利哌酮的研究资料中得知,通过研磨法制备了不同粒径的混悬型注射液,其比表面积及在 Beagle犬体内的药动学数据如表1所示。由此可见,随着粒径的减小,Cmax和AUC呈明显增大的趋势,Tmax呈减小趋势,但粒径最小时的试验结果偏离了该趋势,可能是因为粒径达到一定程度后,药物可能在体内聚集,导致接触面积变小,进而导致粒径最小时Tmax结果出现偏离。与人体相比,帕利哌酮在 Beagle 犬体内的清除速度较快,所以颗粒大小对其在人体内药动学行为的影响比预期结果大得多。
表1 帕利哌酮的颗粒大小及其肌注后在beagle犬体内相应的药动学参数[3]
2.1.2分子量
根据文献记载,分子量越大的药物,吸收也越慢,大分子(5000~20000)的药物通过细胞壁变的十分困难[4],这时候药物主要是通过淋巴系统的吸收,而小分子药物通常比较容易通过血管壁的微孔,这主要是因为血管壁微孔通常比较小,仅有3nm,因此分子量较小的药物可以通过。
2.1.3亲脂性和亲水性
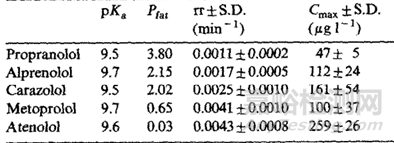
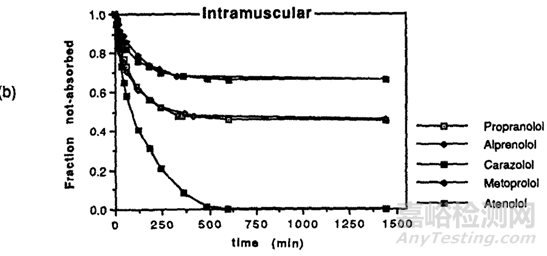
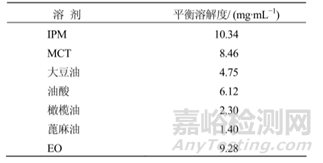
通常情况下,亲脂性化合物通过皮下注射和肌肉注射吸收较慢,水溶性化合物吸收较快,这是因为脂溶性药物向附近周围组织的扩散和分配可能会更慢,当然脂溶性药物有时也可被淋巴细胞转运,但这个速度也是较慢的;根据文献[5]介绍,药物在体内24h的释放主要取决于药物的亲脂性,亲脂性越强的化合物,24h的生物利用度越低,F. Kadirr[6]等对不同亲脂性的β受体阻断剂给猪注射后检测剩余药物的量,其中不同洛尔之间的亲脂性见下表2,结果显示(图3)亲水性最强的阿替洛尔吸收最多,未被吸收的残余量越少,亲脂性最强的普萘洛尔未被吸收的残余量越多。
在早期激素类药物睾酮的研究报道中[7],在大鼠体内,随着脂肪酸链增加药物的作用时间也越长。较长的酯链,特别是癸酸酯,会显著延迟起效时间且使血浆 Cmax值变小。短链脂肪酸的作用时间与其分配系数呈对数关系,例如应用定量构效关系对南诺龙酯前药及代谢物的活性进行预测时,能够在化合物活性与其在油酸乙酯-水体系中的分配系数之间建立二项式关系。此外,快速测定药物在体外的分配系数有助于预测其形成体内贮库的可能性。HO[8]等分别用豆蔻酸、棕榈酸和硬脂酸合成了恩替卡韦酯类前药,比较了各产物的水溶性、分配数 (logP)、水解作用和体外释放曲线,最终选择棕榈酸酯前药为候选药物。
表2 不同β受体阻断剂理化性质及Cmax表[6]
图3 不同β受体阻断剂肌肉注射后药物剩余量
2.1.4晶型
药物不同的晶型对药物吸收也有一定的影响,这可能是因为不同的晶型其溶解度不一样,导致药物的缓释作用时间也会有一定的影响。张聪[9]等在美金刚长效注射剂研究中,对晶型I和晶型II进行了大鼠肌肉注射,结果显示见下图4,晶型I和晶型II两者缓释时长不一,其中晶型II的缓释时长明显长于晶型I。
图4 经肌肉注射给予大鼠125 mg/kg美金刚双羟萘酸盐混悬剂(F1(晶型I)和 F(晶型II))的血药浓度-时间曲线(mean±SD;n = 6)
2.1.5药物浓度和注射量
通过查询文献,发现药物的注射体积和注射量对药物吸收无法得到一致的答案,对于不同的药物,不同的载体材料,注射体积或注射量得出的结论完全不同,甚至可能会相反。对于注射水混悬剂,注射体积越大,吸收越快,这主要是因为该药物吸收受溶解速率影响,即注射体积越大,溶剂被吸收后,固体药物越分散,因此药物溶解速度快,吸收越快;而对于亲水性药物水溶液,注射体积越小,吸收越快,而对于不同于油的大分子混悬剂来说,药物可能通过溶解以及相转移两种方式控制,同时还有一种因素是通过吞噬,吞噬可能对于某些细颗粒直接作用,但是这种作用几乎可以忽略不计。根据Leonid Kagan[10]等人对单克隆抗体的大鼠药代动力学研究得知,相同给药量,大体积皮下注射,药物初始吸收要快于小体积药物的吸收。
图5 大鼠背部皮下注射药时曲线图(▼— 1 mg/kg、 ∇—10 mg/kg (1 mL/kg)、△—10 mg/kg (4 mL/kg)、and x— 40 mg/kg)
而HIRANO[11] 等利用动物模型建立了一系列药动学公式,论证了极难溶药物的水性混悬型注射液的吸收速率常数 (ka) 与注射体积和浓度的关系,得到注射体积和浓度越大、ka值越小的结论。
2.1.6pH-pKa
据研究报道,pH值在肌肉注射和皮下注射吸收过程中有一定的影响,由于组织液的中和或缓冲能力,有可能会导致药物析出;正常情况下,肌肉微环境[20]的pH值为7.4~7.6,为了应对注射导致的创伤,组织的酸碱度会在几个小时内降至 pH 6.5,这可能会影响药物的溶解度。在所有已知的抗精神病药LAI制剂中,药物分子的 pKa 值为 7~9,在酸碱度下降时易发生电离,而药物离子化后溶解度普遍会增加,有0.07%的患者在注射奥氮平双羟萘酸盐后会发生药物突释现象,产生严重不良反应[ 13],研究表明,奥氮平双羟萘酸盐在血浆中的溶解度比在pH 7.6缓冲溶液中高15倍,当血液渗透到注射部位时,药物会快速溶解释放,导致发生不良反应。
2.1.7 药物蛋白结合
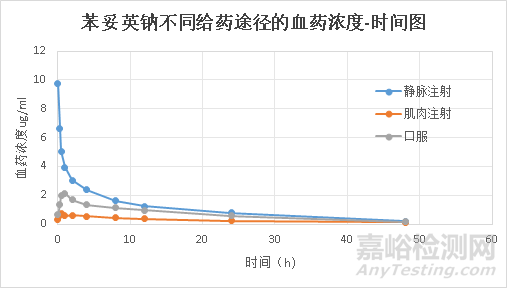
通过文献得知,如果药物与蛋白结合很强,则药物在肌肉注射中吸收可能会慢于口服注射,比如苯妥英钠,苯妥英钠很容易在肌肉内与蛋白质结合,因此该药物在肌肉吸收要慢于口服。查询文献研究8名正常成午人苯妥英钠在不同给药途径即静脉注射、肌肉注射和口服时的绝对生物利用度及药物代谢动力学。肌肉注射的生物利用度比口服低,峰位仅为口服的三分之一左右(图6)。
图6 苯妥英钠不同给药途径的血药浓度-时间图[14]
2.2辅料因素
2.2.1 共溶剂
通常情况,为了提高药物的溶解度,我们会使用一些共溶剂,比如乙醇、甘油、丙二醇和聚乙二醇400,然而这些共溶剂会对吸收起到哪些作用,是值得我们研究的。据报道丙二醇、甘油和聚乙二醇400对不同化合物的吸收均不同,有的降低有的提高。
而乙醇的粘度很小,在高浓度作用下,它会让注射部位的蛋白变性,因此它可能会对水溶性离子和非离子型药物如异烟酰胺、异烟酸甲酯、异烟酸和盐酸普鲁卡因的吸收有抑制作用,这种影响主要因为结缔组织通透性的改变,最终使其吸收降低。
据文献[15]丙二醇对盐酸苯并咪唑吸收的影响说明了共溶剂对其吸收的影响,通常情况下,丙二醇在体内吸收慢于水在体内的吸收速度,然而在某些情况下,丙二醇的存在可以防止部分游离碱(或游离酸)的析出,因此可能会促进药物的吸收。
2.2.2 表面活性剂
对于长效注射混悬剂(微晶或纳晶)表面活性剂可以起到润湿剂和稳定剂的作用,目前获批可用于肌内注射的表面活性剂种类并不多,其中包括吐温80、吐温20、聚乙二醇4000和泊洛沙姆;表面活性剂是注射混悬剂的重要组成部分之一,它不但可以提高药物粒径的稳定性,还可以增加疏水性药物被水润湿的能力。据文献报道[16],表面活性剂或亲水性聚合物(如聚乙二醇或泊洛沙姆)的吸附会增加颗粒的亲水性并降低内化程度。
2.2.3载体的亲脂性
通过文献[17]发现,将青蒿素制备成油混悬剂和水混悬剂,分别肌肉注射给10名志愿者,结果惊奇地发现,青蒿素的油混悬剂在体内的吸收明显快于水混悬剂,结果见下图7,其中b为青蒿素油混悬剂,c为青蒿素水混悬剂:通常情况油混悬或水混悬被认为是一种缓释体系,而且油在体内吸收是相当慢的,有时候油在体内可长达一个月,而本文献中药物形成的油混悬剂的吸收快于水混悬剂,主要可能是青蒿素快速溶于油中,然后再从油中分配到组织液中,而青蒿素在水中不溶,因此,没有油起媒介的作用,最终导致青蒿素水混悬剂慢于油混悬剂。通过查找文献[18]得知青蒿素在水中的溶解度小于在油中的溶解度,青蒿素在水中和不同pH条件下溶解度为60ug/ml~82ug/ml,而青蒿素在不同油中的溶解性为1.4mg/ml~10mg/ml,在pH7.4的油水分配系数为1.58。
图7 青蒿素油混悬剂和水混悬剂肌肉注射的药时曲线图[17]
表3青蒿素在不同油体系中的溶溶解度[18]
2.3临床给药位置
2.3.1注射深度
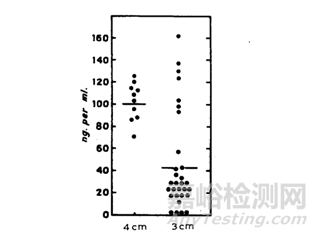
注射不同的深度,其机体环境也有一定的差异,比如皮下注射脂肪结缔组织和脂肪细胞较为丰富,而脂肪组织和肌肉组织的亲脂性也是有一定差异,通常情况,脂肪组织比肌肉组织的亲脂性更强,血流量也更少。据Dundee[19]等人研究,将地西泮注射液进行肌肉注射,注射深度分别为3cm和4cm,结果(结果见下图8)显示,注射3cm的血药浓度小于注射4cm,研究人员解释,3cm的脂肪层多于4cm,因此地西泮在3cm吸收更慢。
图8 不同注射深度对地西泮的吸收影响[19]
2.3.2注射部位
注射部位对药物的吸收也有一定作用,经常使用的部位有臂三角肌、臀大肌、股四头肌以及前臂腹侧的肌肉,据相关文献报道,与臀肌注射相比,三角肌注射时药物吸收速度更快。
3.总结
综上所述,影响长效注射混悬剂(微晶和纳晶)原因非常多,包括原料自身因素、辅料因素以及临床给药位置。原料自身因素包括分子量、亲脂性、粒径、晶型、药物浓度和注射量、pH-pKa、药物蛋白结合等性质,因此在选择药物时需要考虑这些因素,同时还需要考虑半衰期和剂量等,这样可为立项提供一定的参考;辅料因素包括:共溶剂、表面活性剂以及辅料的亲脂性,这些均是我们研发过程中需要考虑的问题。与此同时,我们可能还需要关注临床应用,包括注射位置、注射速度等。
参考文献:
[1]DARVILLE N, VAN HEERDEN M, ERKENS T, et al.Modeling the time course of the tissue responses to intramuscular long-acting paliperidone palmitate nano-/ microcrystals and polystyrene microspheres in the rat [J]. Toxicol Pathol, 2016, 44(2): 189-210
[2]Tzu-Lan CHANG等 Nanocrystal technology for drug formulation and delivery Front. Chem. Sci. Eng. 2015, 9(1): 1–14
[3]FRANÇOIS M K J, DRIES W M A C, BASSTANIE E D G.Aqueous suspensions of submicron 9-hydroxyrisperidone fatty acid esters: US, 6555544 [P].2003-04-29
[4]魏树礼《生物药剂学和药物动力学》
[5]J. Zuidema *, F. Kadir, H.A.C. Titulaer, C. Oussoren Release and absorption rates of intramuscularly and subcutaneously injected pharmaceuticals (II) International Journal of Pharmaceutics 105 (1994) 1X9-207
[6]F. Kadirr等人.Drug lipophilicity and release pattern of some /3-blocking agents after intra-adipose injection in pigs International Journal of Pharmaceutics, 64 (1990) 171-180
[7]VAN DER VIES J.Implications of basic pharmacology in the therapy with esters of nandrolone [J].Acta Endocrinol Suppl (Copenh), 1985, 271: 38-44.
[8]HO M J, LEE D R, IM S H, et al.Microsuspension of fatty acid esters of entecavir for parenteral sustained delivery [J].Int J Pharm, 2018, 543(1/2): 52-59
[9]张聪等人美金刚长效注射剂的研究 江南大学 2021
[10]Leonid Kagan等 Subcutaneous Absorption of Monoclonal Antibodies: Role of Dose, Site of Injection, and Injection Volume on Rituximab Pharmacokinetics in Rats Pharm Res (2012) 29:490–499
[11]HIRANO K, ICHIHASHI T, YAMADA H.Studies on the absorption of practically water-insoluble drugs following injection. III. Intramuscular absorption from aqueous nonionic surfactant solutions in rats [J].Chem Pharm Bull, 1981, 29(3): 834-843
[12]GOMENI R, LAFFONT CM, HEIDBREDER C. A dose switching simulation analyses from Invega® Sustenna® or Risperdal® Consta® to RBP-7000, a new sustained-release formulation of risperidone [J].Clin Pharmacol Ther, 2014, 55(1): 93-103.
[13]MCDONNELL D P, DETKE H C, BERGSTROM R F, et al.Post-injection delirium/sedation syndrome in patients with schizophrenia treated with olanzapine long-acting injection, II: investigations of mechanism [J].BMC Psychiatry, 2010, 10: 45.
[14]霍治平等正常人苯妥英钠不同给药途径 ( 静脉、肌肉、口服)的药物动力学研究
[15]Cheng-Der, Y. and Kent. J.S., Effect of propylene gycol on subcutaneous
absorption of a benzidamole hydrochloride. j. Pharm. SCi.. 71 (1982) 476-478.
[16]BAERT L, VAN 'T KLOOSTER G, DRIES W, et al. Development of a long-acting injectable formulation with nanoparticles of rilpivirine (TMC278) for HIV treatment [J].Eur J Pharm Biopharm, 2009, 72(3): 502-508.
[17]Titulner, H.&C., Zuidcma, J.. Kager. P.A.. Wetsteyn. J.C.F.M.. Lugt. C.B. and Merkus. F.W.H.M.. The pharmacokinetics of artcmisinin after oral, intramuscular and rectal administration to volunteers. J. Pharm.pharmacol, 42 (1990b)810-813.
[18]高伟祺等蒿素在不同溶剂中平衡溶解度和表观油水分配系数的测定 Drug Evaluation Research 第36卷第1期 2013年02月
[19]J. Zuidema Release and absorption rate aspectsof intramuscularly injected pharmaceuticals International Journal of Pharmaceutics, 47 (1988) 1-12
[20]丁静雯等影响注射用长效纳米晶混悬型注射液体内外释药因素的概述中国医药工业杂志 Chinese Journal of Pharmaceuticals 2020, 51(12)