心血管疾病导致全世界每年超过1790万人死亡,以心肌梗死(MI)为代表的缺血性心脏病是心血管疾病相关死亡的主要原因。心肌梗死再灌注后发生不可逆的病理重构,包括左心室扩张和心肌梗死后的过度炎症反应,常常导致致命性的功能损害。
基于此,来自韩国忠南国立大学的Youngkeun Ahn和韩国光州科学技术学院的Jae Young Lee开发了一种使用葡聚糖醛(Dex-ald)和明胶的可涂性和粘附性水凝胶贴片,将抗炎蛋白ANGPTL4加入水凝胶中,直接向梗塞心脏持续释放,以减轻炎症。
1. 作者优化了材料的组成,包括聚合物的浓度和分子量。该水凝胶在135秒内形成原位凝胶,具有心脏组织生理模量(40.5 kPa),合适的组织粘附性(4.3 kPa),以及优异的机械稳定性。ANGPTL4从明胶/dex-ald水凝胶中持续释放,明胶/dex-ald水凝胶可以方便地涂在跳动的心脏上并在体内降解。
2. 体内研究表明,含有ANGPTL4的水凝胶心脏贴片可显著改善心脏组织修复。经ANGPTL4水凝胶贴片处理的心脏组织血管化增加,炎症巨噬细胞减少,心脏细胞结构成熟。该水凝胶系统具有易涂性、适当的组织粘连性和抗炎药物的持续释放,将成为修复各种组织的有效平台,包括心脏、肌肉和软骨。
相关论文“A paintable and adhesive hydrogel cardiac patch with sustained release of ANGPTL4 for infarcted heart repair”于2023年8月29日发表于杂志《Bioactive Materials》上。
图1 可涂胶水凝胶的示意图
1. 可涂水凝胶的设计与制备
使用明胶和葡聚糖作为基础水凝胶材料,因为它们具有固有的粘附性和生物相容性。将右旋糖酐修饰为dex-ald,它可以通过希夫反应与明胶和心脏组织自发反应,分别与心外膜形成共价水凝胶网络和强粘连键,使水凝胶可以涂在左室心外膜上(图1)。在明胶含量恒定(10%)的情况下,dex-ald的浓度在1%到5%之间变化。混合料中dex-ald含量越高,弹性模量增加越快,胶凝时间越短。此外,含有更多dex-ald的凝胶具有更高的模量(图2A和B)。结果表明,密集存在于dex-ald链上的醛基与明胶中的胺基形成席夫碱键的接近性和反应性有限,需要比胺基更大的醛含量才能形成网络。明胶含量从2.5%到10%的变化,在恒定的dex-ald含量(5%)下,对凝胶化时间没有实质性影响(图2C和D)。然而,明胶/dex-ald的弹性模量随着明胶含量的增加而增加。此外,用不同分子量的葡聚糖(150 kDa、500 kDa和1.5 MDa)制备不同的葡聚糖前体和明胶/葡聚糖水凝胶。有趣的是,由dex-ald(由500 kDa葡聚糖氧化而成)和10%明胶组成的前体溶液形成凝胶的速度比其他溶液快(图2E和F)。流变学研究表明,用dex-ald (500 kDa右旋糖酐)制备的水凝胶在1Hz下具有更高的存储模量(G’),为13.5±1.2 kPa,与凝胶时间相反(图2G和H)。此外,通过将混合前驱体溶液以螺旋或直线的方式应用于玻璃管上,验证了水凝胶的可注射性和可涂性。双注射器注射后水凝胶保持稳定不流动(图2I)。SEM图像显示出孔径为3.8±1.7μm的高孔隙结构(图2J)。
图2 可涂明胶/dex-ald水凝胶的制备与表征
2. 明胶/dex-ald水凝胶的粘附性
作者目标是开发一种不需要手术缝合并稳定支持心外膜机械性能的粘性水凝胶心脏贴片。因此,研究了明胶/dex-ald 水凝胶的粘附特性(图3)。将由10%明胶和5% dex-ald组成的水凝胶注射到组织片上,然后将另一个组织片覆盖到水凝胶上(图3A)。该水凝胶对猪心外膜和皮肤的界面粘合强度分别为4.2±0.3kPa和19.5±1.7kPa(图3A和B)。此外,水凝胶粘合组织的循环伸长不会引起粘合强度的实质性变化(图3C),表明具有优异的持久组织粘合力。在扭转、弯曲和水冲洗等各种变形下,水凝胶仍牢固地附着在心外膜上(图3D)。
图3 可涂水凝胶的粘附性能
3. ANGPTL4从明胶/dex-ald水凝胶中释放
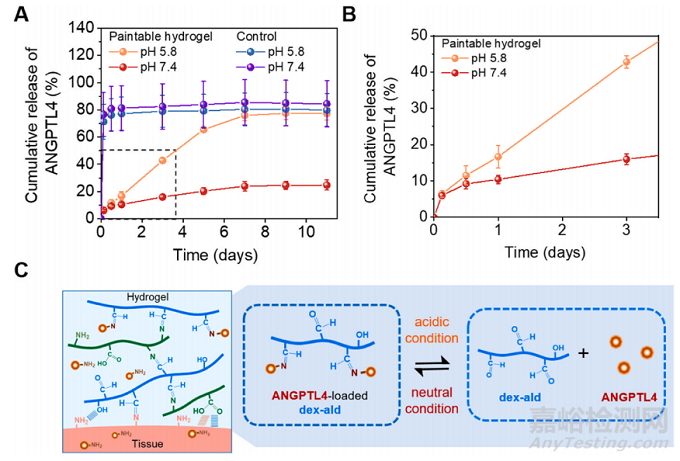
由于ANGPTL4可以通过可逆席夫碱与dex-ald 发生化学键合,因此ANGPTL4具有高负载能力和持续释放。将ANGPTL4与dex-ald溶液混合进行偶联,然后将其与明胶混合,得到负载ANGPTL4的水凝胶(A4/明胶/dex-ald)。使用Cy5共轭ANGPTL4负载的水凝胶检测ANGPTL4从水凝胶中的释放谱(图4A)。A4/明胶/ dexald在早期孵育时间点表现出持续释放的特征,没有明显的爆发释放(图4B)。ANGPTL4持续释放,并在第7天达到饱和释放,表明ANGPTL4在水凝胶内保持稳定。A4/明胶/dex-ald在酸性缓冲液(pH 5.8)中比在中性缓冲液(pH 7.4)中释放ANGPL4更快。结果表明,酸性条件下,ANGPTL4与水凝胶基质之间的席夫碱会逐渐失稳,从而促进ANGPTL4的释放。由于心肌梗死心脏呈轻微酸性pH值,根据心肌梗死的严重程度,可能会诱导ANGPTL4的释放(图4C)。
图4 A4/明胶/dex-ald水凝胶和明胶水凝胶中ANGPTL4的体外释放
4. 明胶/dex-ald水凝胶体外细胞培养
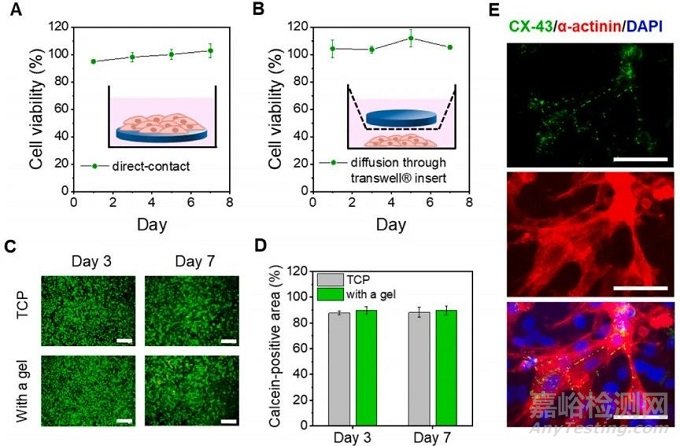
通过在直接和间接培养模式下用明胶/dex-ald水凝胶培养原代心肌细胞(CMs)来研究细胞相容性。LDH 测定显示,在明胶/dex-ald水凝胶中培养的CM在长达7天的时间内表现出优异的细胞活力(图5A)。此外,在Transwell插入物中以水凝胶作为间接接触模式培养的CM具有高达7天的高活力 (>95%)(图5B)。活/死染色表明,在带有水凝胶的 Transwell 插入物中培养的CM与在组织培养板(TCP)上培养的CM之间的细胞活力没有显着差异(图5C和D)。如图5E所示,在培养第7天在水凝胶上培养的CM中观察到α-肌动蛋白的高表达和独特的肌节结构。
图5 体外细胞毒性试验
5. 明胶/dex-ald 的体内可涂性和可降解性
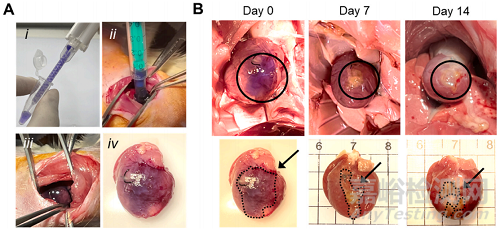
使用活体大鼠检查了明胶/dex-ald 水凝胶作为可涂心脏贴片的适用性。水凝胶成功覆盖了整个左心室,包括梗塞区,并且在跳动心脏的左心室上保持完整(图6A)。在处理后的第7天和第14天,通过收集心脏组织来检测涂覆明胶/dex-ald水凝胶的体内生物降解性(图6B),结果显示涂覆的水凝胶逐渐降解。第7天和第14天,心脏上的初始贴片分别保留了46.6%和30.0%,这表明明胶/dex-ald贴片在体内是可降解的。
图6 明胶/dex-ald水凝胶在心脏上的可涂性和可降解性的体内研究
6. 负载ANGPTL4的可涂水凝胶修复心脏
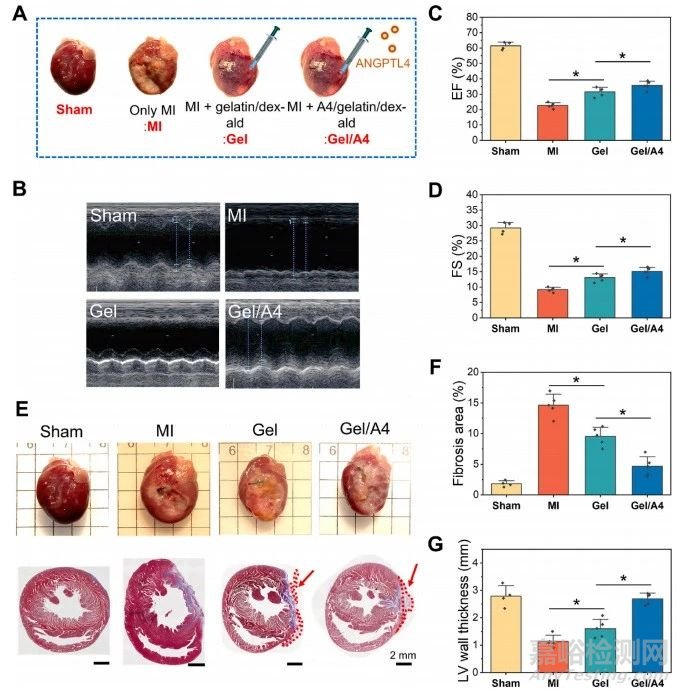
为了确定A4/明胶/dex-ald贴片是否能改善心肌梗死(MI)后的心功能,在心肌梗死后第14天用超声心动图测量了心室收缩力。假手术组、MI组、明胶/dex-ald水凝胶贴片的MI和A4/明胶/dex-ald水凝胶贴片的MI实验组如图7A所示。代表性超声心动图显示MI组左室尺寸增大,室间隔和后壁运动减弱,而明胶/dex-ald和A4/明胶/dex-ald组减弱(图7B)。与MI组相比,以EF和FS为特征的收缩功能障碍在明胶/dex-ald和A4/明胶/dex-ald组中均减弱(图 7C)。FS(%)值显示出与EF(%)相似的趋势(图7D)。A4/明胶/dex-ald组的EF(%)和FS(%)回收率优于明胶/dex-ald组。结果表明水凝胶贴片(明胶/dex-ald和A4/明胶/dex-ald)对心脏功能恢复具有积极作用,并且A4的掺入进一步改善了功能恢复。使用马松三色染色分析MI诱导的纤维化疤痕形成(图7E)。A4/明胶/dex-ald治疗后纤维化面积显着减少,小于MI和明胶/dex-ald组的纤维化面积(图7F)。此外,在贴片治疗组中,左心室壁厚度的减少有所减弱,其中负载A4的心脏贴片更有效(图7G)。
图7 明胶/dex-ald水凝胶心脏贴片对MI后心脏功能和重塑的影响
接下来,使用α-SMA和vWF免疫荧光染色确定了水凝胶贴片在血管生成中的作用。与MI和明胶/dex-ald组相比,A4/明胶/dexald 贴片治疗显着增加了新血管形成,特别是在边缘区域(图 8A)。A4/明胶/dex-ald贴片组中血管生成的增强可能归因于ANGPTL4的促血管生成能力和炎症的减少。此外,通过CD68(全巨噬细胞标记物)和CD206(抗炎巨噬细胞标记物)染色来评估巨噬细胞的类型和分布(图8B)。结果表明,使用水凝胶心脏贴片局部递送 ANGPTL4 可通过促进抗炎和血管生成来有效诱导心脏修复途径。
图8 MI后2周大鼠心脏组织的代表性免疫荧光图像
综上,作者成功开发了生物相容性和粘附性水凝胶,能够使用10%明胶和5% dex-ald通过希夫碱原位形成凝胶。这种水凝胶适用于心脏贴片,可以通过稳定的组织粘附力而无需缝合而附着在心外膜上,为心肌梗死后有效的心脏修复提供组织般的柔软度和机械支撑。此外,将组织再生因子ANGPTL4负载到明胶/dex-ald水凝胶上进行局部持续递送。负载ANGPTL4的水凝胶贴片改善了心肌梗死的功能恢复并防止病理组织重塑。免疫组织学分析表明,负载 ANGPTL4的水凝胶贴片增强了梗塞心肌中的血管生成并增加了抗炎巨噬细胞的数量。
文章来源:https://doi.org/10.1002/adfm.202307766