您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-08-14 21:28
摘 要: 建立了亲水作用高效液相色谱-蒸发光散射检测器法测定农药制剂中春雷霉素含量。在液体制剂和固体制剂样品中加入水,超声提取,经0.45 μm滤膜过滤后直接进样测定。采用HILIC-Amide色谱柱(250 mm×4.6 mm,5 μm)进行分离,以0.2%甲酸溶液和乙腈为流动相进行梯度洗脱,外标法定量。春雷霉素在该色谱柱上保留良好,分离效率高,在质量浓度为50~1 000 mg/L内,春雷霉素质量浓度的自然对数与色谱峰面积的自然对数线性关系良好,相关系数为0.999 9。春雷霉素的定量限为50 mg/L,检测限为1.0 mg/L。以春雷霉素液体制剂和固体制剂为样品基质,测定结果的相对标准偏差分别为0.49%、0.51%(n=6),在不同添加水平下的平均回收率为99.5%和100.4%。在液相色谱分离时采用亲水作用色谱柱,目标化合物能够获得较好保留,同时采用蒸发光散射检测器,没有特征紫外吸收的化合物也能得到较好的响应。该方法适用于各种农药制剂产品中春雷霉素含量的测定,为农药制剂产品的质量检测提供了参考。
关键词: 高效液相色谱法; 蒸发光散射检测器; 春雷霉素; 农药制剂
春雷霉素是农、医两用抗生素,对人、畜、家禽急性毒性较低,随着人们对化学农药安全性认识的提高,春雷霉素作为高效、广谱、低毒、无公害生物农药,展示了越来越光明的市场前景,广泛应用于农业生产中,目前,已有超过200种单剂或复配制剂产品取得了登记。春雷霉素特点为强极性、易溶于水,在液相色谱柱上保留时间短,与杂质不能完全分离,给分析检测带来困难[1]。目前,文献中报道的春雷霉素分析检测方法包括高效液相色谱法[2‒3]、液相色谱-串联质谱法[4‒6]、毛细管电泳法[7]等。在使用常规液相色谱法进行检测时,通常需要加入离子对试剂,以增强其在色谱柱上的保留能力。
紫外检测器是目前应用最为广泛的检测器之一,其局限性在于仅能检测具有紫外吸收的物质,在面对组分复杂且需要进行梯度分离的样品时,使用紫外检测器在低波长条件下进行分析,基线容易发生漂移,降低了定量分析的准确性。相比之下,蒸发光散射检测器(ELSD)作为一种通用型检测器,显示了极大的优越性[8],能够适用于复杂体系中多种成分的同时测定。该检测器已广泛应用于多个领域的化合物成分的分析,尤其在分析那些极性强、挥发性低、无紫外吸收或紫外吸收较弱的化合物方面,如氨基酸[9‒10]、表面活性剂[11‒13]、糖[14‒15]、季铵盐[16‒17]等物质的检测,以及在药物或中药材分析[18‒20]等领域中发挥着重要的作用,为化合物成分分析提供了有力的技术支持。
春雷霉素由于缺乏特征性的紫外吸收,在应用紫外检测器进行分析时,只能在低波长下进行测定。然而,春雷霉素在制剂中的含量通常低于其他辅助成分,导致了较多干扰物的存在。此外,春雷霉素的极性较强,易溶于水,很难通过改变流动相的组成将其完全分离。相比之下,ELSD在检测过程中能够将流动相完全挥发,在梯度洗脱时基线更加平稳。结合使用亲水作用色谱柱,可以通过改变流动相的组成及添加剂的种类和浓度,对组成复杂的成分进行有效分离。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:1260型,美国安捷伦科技有限公司公司。
蒸发光散射检测器:1260型,美国安捷伦科技有限公司。
氮气发生器:NiGen LCMS 40-1型,意大利Claind公司。
超纯水纯化系统:Milli-Q型,德国默克股份两合公司。
超声振荡器:2300T型,上海安谱实验科技股份有限公司。
电子分析天平:MS205DU型,感量为0.01 mg,瑞士梅特勒-托利多仪器有限公司。
离心机:TDL-5-A型,上海安亭科学仪器厂。
春雷霉素盐酸盐对照品:质量分数为98.9%,折算成春雷霉素的质量分数为86.5%,沈阳沈化院测试技术有限公司。
甲酸、乙酸、乙酸铵:均为色谱纯,上海安谱实验科技股份有限公司。
乙腈:色谱纯,德国默克公司。
1.2 仪器工作条件
色谱柱:ChromCore HILIC-Amide柱[250 mm×4.6 mm,5 μm,纳谱分析技术(苏州)有限公司];流动相:A相为0.2%甲酸溶液,B相为乙腈;流量:1.0 mL/min;洗脱方式:梯度洗脱;洗脱程序:0~2 min时B相体积分数为95%,2~10 min时B相体积分数由95%降至40%,10~15 min时B相保持体积分数为40%;柱温:25 ℃;进样体积:5 μL。
蒸发光检测器参数:蒸发温度:80 ℃;雾化温度:80 ℃;雾化气:氮气;载气流量:1.6 L/min;增益值:1。
1.3 对照品溶液的配制
分别准确称取0.005、0.01、0.02、0.04、0.08、0.12 g (精确至0.000 1 g)春雷霉素盐酸盐对照品,置于100 mL容量瓶中,用超纯水溶解并定容至100 mL,配制成春雷霉素质量浓度分别为50、100、200、400、800、1 000 mg/L的系列对照品溶液,过0.45 μm滤膜后测定。
1.4 实验方法
1.4.1 液体样品的处理
准确称取含春雷霉素约0.02~0.06 g (精确至0.000 1 g)的试样,置于100 mL容量瓶中,先加入80 mL超纯水,超声溶解5 min,冷却至室温,用水定容,过0.45 μm滤膜,作为样品溶液。
1.4.2 固体样品的处理
准确称取含春雷霉素约0.02~0.06 g (精确至0.000 1 g)的试样,置于100 mL容量瓶中,先加入80 mL水,超声溶解10 min,冷却至室温,用水定容,取10 mL试样溶液转移至离心管内,在3 000 r/min的条件下离心3 min,取上清液过0.45 μm膜,作为样品溶液。
1.4.3 样品测定
按照仪器设定的条件,将系列对照品溶液和样品溶液进行进样分析,记录相应的对照品溶液的色谱峰面积,以春雷霉素质量浓度的自然对数作为横坐标,春雷霉素色谱峰面积的自然对数作为纵坐标,进行线性回归,绘制标准曲线。
2 结果与讨论
2.1 实验条件的优化
2.1.1 检测器的选择
春雷霉素没有特征的紫外吸收,在使用紫外检测器时,仅能在较短波长下进行检测,导致检测结果容易受到其他物质的干扰。而质谱检测器虽然具有较高的灵敏度,但其对常量分析的准确性较低,并且分析成本高昂,限制了其在实际应用中的普及。相比之下,ELSD作为一种通用型检测器,对春雷霉素展现了良好的灵敏度和稳定性,并且能够通过梯度洗脱技术进行分离,有效解决干扰物对分离的影响,故选择ELSD作为春雷霉素检测的检测器。
2.1.2 色谱柱的选择
春雷霉素作为一种强极性化合物,在水中的溶解度较高。在常规的C18色谱柱上,春雷霉素保留性能较差,出峰较快,难以与样品中的杂质实现有效分离。尽管通过在流动相中引入离子对试剂可以增强其保留能力,但添加了离子对调节剂的流动相缺乏挥发性,限制了使用ELSD进行检测的可能性。鉴于此,考虑采用对极性化合物保留较强的亲水相互作用色谱柱。分别比较常规HILIC色谱柱和HILIC-Amide色谱柱的分离效果,结果发现在相同色谱条件下,春雷霉素在HILIC-Amide色谱柱上保留能力较好,对干扰物的分离也优于常规的亲水作用色谱柱,因此,选定HILIC-Amide色谱柱作为春雷霉素分析的色谱柱。
2.1.3 流动相的优化甲醇和乙腈为液相色谱分析时最常使用的有机溶剂,但是针对HILIC类色谱柱,一般选用乙腈作为洗脱溶剂。使用任何比例的乙腈,色谱柱的背景压力均适中,检测的噪声值也较低,基线稳定,因此选择乙腈作为有机流动相。
ELSD需要选择挥发性添加剂来调节流动相的pH值,从而调节目标化合物的保留行为。比较了甲酸、乙酸、乙酸铵作为流动相时的分离效果,结果表明,采用甲酸作为流动相的添加剂时,基线噪声较低,基线平稳,能够获得良好的保留时间和分离度。比较了添加不同体积分数(0.05%、0.1%、0.2%、0.3%、0.4%)的甲酸溶液对分离和春雷霉素色谱峰面积的影响,当流动相中含有较低的甲酸时,响应较高,但是色谱峰形较差,不利于定量分析,当甲酸体积分数达到0.2%时,色谱峰形对称,分离良好,且基线稳定,因此选择甲酸的体积分数为0.2%。由于HILIC-Amide的洗脱能力与常规C18色谱柱相反,当流动相中乙腈含量较高时,春雷霉素有更强的保留,能够更好与干扰物进行分离,因此,选择梯度洗脱程序进行样品中春雷霉素的色谱分离。
2.1.4 蒸发光散射检测器参数优化
蒸发温度、雾化气温度和雾化气流量是影响ELSD的重要参数,对组分的保留时间影响较小,主要影响色谱峰的峰形、基线噪音及目标化合物的响应。当蒸发温度低于溶剂沸点时,流动相无法充分挥发,造成基线水平升高,反之,若蒸发温度过高,则可能引起较大的噪声。
在载气流量为1.6 L/min条件下,设定蒸发温度分别为50、60、70、80、90、100 ℃,对春雷霉素色谱峰面积进行了考察,结果见图1。由图1可见,当蒸发温度低于80 ℃时,随着温度的升高,春雷霉素的色谱峰面积逐渐增大,当达到80 ℃时,色谱峰面积趋于稳定,基线平稳,噪音低,因此,选用检测时的蒸发温度为80 ℃。
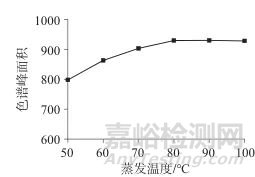
图1 不同蒸发温度对应的春雷霉素色谱峰面积
Fig. 1 Chromatographic area of Kasugamycin corresponding to different evaporation temperatures
在优化后的蒸发温度条件下,进一步探讨了不同雾化气流量(1.2、1.4、1.6、1.8、2.0、2.2 L/min)对分离和春雷霉素色谱峰面积的影响,结果见图2。由图2可见,在低载气流量下春雷霉素色谱峰面积较大,而在较高的雾化气流量下,色谱峰面积减小,同时噪声也有所减少,这主要是因为气体流量的变化会影响春雷霉素在气相中的颗粒形成以及光散射效果,鉴于旨在对春雷霉素制剂进行常量分析,对检测灵敏度的要求并不高,综合考虑春雷霉素的色谱峰面积与仪器噪音,最终选定载气流量为1.6 L/min。
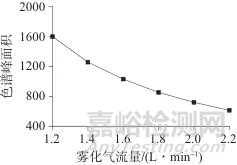
图2 不同雾化气流量对应的春雷霉素色谱峰面积
Fig. 2 The chromatographic areas of Kasugamycin corresponding to different atomizing gas flow rates
2.2 色谱图
图3~图5为在优化的色谱条件下,对照品溶液、6%春雷霉素水剂、10%春雷霉素可湿性粉剂样品的高效液相色谱图。由图3~图5可以看出,春雷霉素样品对春雷霉素的测定没有干扰。

图3 春雷霉素对照品溶液的高效液相色谱图
Fig. 3 Chromatogram of the Kasugamycin reference solution

图4 6%春雷霉素水剂样品加标后的高效液相色谱图
Fig. 4 Chromatogram of the 6% Kasugamycin aqueous solution
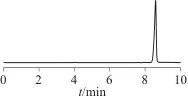
图5 10%春雷霉素可湿性粉剂样品加标后的高效液相色谱图
Fig. 5 Chromatogram of the 10% Kasugamycin wettable powder
2.3 线性关系、定量限和检出限
春雷霉素盐酸盐在水溶液中的存在形式为春雷霉素,因此,实际测定的是春雷霉素的色谱峰面积。将春雷霉素系列对照品溶液按照1.2仪器工作条件进行测定,同时将1.3节配制的50 mg/L春雷霉素盐酸盐标准溶液进行逐级稀释,同时测定,得到相应浓度的色谱峰面积。春雷霉素质量浓度的自然对数与色谱峰面积的自然对数呈现线性相关性,因此以春雷霉素的色谱峰面积(A)的自然对数为纵坐标,以春雷霉素质量浓度(ρ)的自然对数为横坐标,进行线性回归,得到相应的线性回归方程。当春雷霉素的质量浓度为50~1 000 mg/L时,春雷霉素的线性方程为lnA=1.383 9 lnρ-1.164 6,相关系数为0.999 9,线性关系良好。当春雷霉素的质量浓度低于50 mg/L时,线性变差,相关系数降低,影响到定量的准确性,因此,50 mg/L作为方法的定量限。同时,以最低质量浓度标准工作溶液进样分析,并计算信噪比,以3倍信噪比计算方法检出限,检出限为1.0 mg/L。鉴于农药制剂中春雷霉素的含量通常较高,通常以质量分数表示,属于常量分析范畴。当样品中春雷霉素的质量浓度低于线性检测范围时,应适当增加取样量,反之,若质量浓度超出线性范围,则需对样品进行适当稀释后进行测定,以确保定量分析结果的准确。
2.4 精密度试验
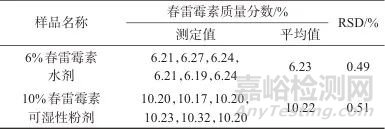
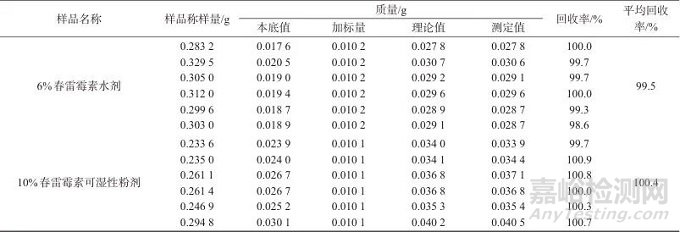
在我国,春雷霉素已经登记的剂型主要有液体制剂和固体制剂,基于此,选取6%春雷霉素水剂和10%春雷霉素可湿性粉剂作为代表性样品,进行精密度试验,试验中对每个样品进行了6次重复测定。具体操作为,称取约0.4 g样品(精确至0.000 1 g),置于100 mL容量瓶中,按照1.4方法进行样品处理,随后按1.2仪器条件进行分析检测,结果见表1。由表1可知,6%春雷霉素水剂、10%春雷霉素可湿性粉剂测定结果的相对标准偏差(RSD)分别为0.49%和0.51%,说明该方法的精密度良好。
表1 春雷霉素样品的精密度试验结果
Tab. 1 Precision test results of Kasugamycin sample
2.5 样品加标回收试验
鉴于无法获取不含目标化合物的空白样本,笔者采用标准加入法进行实际样品的加标回收试验,选择6%春雷霉素水剂和10%春雷霉素可湿性粉剂样品(样品中春雷霉素的本底值根据表1的测定结果确定),称取约0.2~0.3 g (精确至0.000 1 g)的样品,置于100 mL容量瓶中,随后加入约含0.01 g春雷霉素盐酸盐标准溶液,每个添加浓度进行6次重复试验,按1.3进行样品处理,按1.4进行检测,结果见表2。由表2可知,6%春雷霉素水剂样品、10%春雷霉素可湿性粉剂样品的加标平均回收率分别为99.5%、100.4%,说明该方法准确度良好。
表2 春雷霉素样品加标回收试验结果(n=6)
Tab. 2 Test results of spiked recovery of Kasugamycin samples (n=6)
以上结果说明,在50~1 000 mg/L质量浓度范围内,春雷霉素质量浓度的自然对数与峰面积的自然对数呈线性关系,线性相关系数为0.999 9,方法的重复性、精密度、准确度试验结果均符合农业行业标准NY/T 2887—2016《农药产品质量分析方法确认指南》的要求,表明该方法能够满足春雷霉素样品中含量的定量检测需求。
2.6 实际样品检测
从上海农资流通市场采购了6种不同含量及剂型的春雷霉素样品,按照所建立的方法对样品中的春雷霉素含量进行了测定,对于固体制剂,参照GB/T 34761—2017《春雷霉素可湿性粉剂》标准进行测定;对于液体制剂,参照GB/T 34774—2017《春雷霉素水剂》进行了测定,测定结果详见表3。
表3 实际样品检测结果
Tab. 3 Actual sample test results
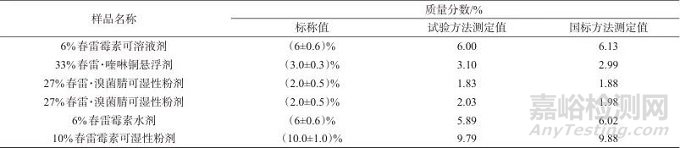
由表3可见,该方法与国标方法的测定结果相比差别不大,说明测定的结果准确可靠。
3 结语
将亲水作用色谱柱分离技术与蒸发光散射检测器相结合,成功建立了高效液相色谱-蒸发光散射检测器法直接测定春雷霉素制的剂含量。通过优化HILIC色谱柱的分离条件,有效解决了作为强极性物质的春雷霉素在制剂中的分离难题,同时,采用蒸发光散射器检测,克服了春雷霉素无特征的紫外吸收,只能在低波长检测的缺陷。该方法已成功应用于春雷霉素水剂、可溶液剂、可湿性粉剂等制剂中春雷霉素单剂或复配制剂样品的分离检测,具有操作简便、快速高效的特点,为农药制剂中春雷霉素含量的质量控制提供了一种可靠的分析手段。
参考文献
1 卢蕾,刘雪,赵善仓,等. 4%春雷霉素可湿性粉剂液相色谱串联质谱法分析[J].农药,2012,51(4): 273.
LU Lei,LIU Xue,ZHAO Shancang,et al. Analytical method for Kasugamycin 4% WP by UPLC-MS/MS[J]. Agrochemicals,2012,51(4): 273.
2 SHEU C,CHEN S C,LO C C. Analysis of antibiotic fungicide Kasugamycin in irrigation water by high performance liquid chromatography[J]. Journal of Environmental Science and Health Part B,Pesticides,Food Contaminants,and Agricultural Wastes,2010,45(5): 478.
3 吴国旭,毕富春,翟立红.春雷霉素高效液相色谱分析方法[J].农药,2010,49(12): 902.
WU Guoxu,BI Fuchun,ZHAI Lihong. The analytical method for Kasugamycin by HPLC[J]. Agrochemicals,2010,49(12): 902.
4 LI W X,DAI X F,PU E T,et al. HLB-MCX-based solid-phase extraction combined with liquid chromatography-tandem mass spectrometry for the simultaneous determination of four agricultural antibiotics (Kasugamycin,validamycin A,ningnanmycin,and polyoxin B) residues in plant-origin foods[J]. Journal of Agricultural and Food Chemistry,2020,68(47): 14 025.
5 ZHANG H,WANG C C,LI H D,et al. Simultaneous determination of Kasugamycin and validamycin-a residues in cereals by consecutive solid-phase extraction combined with liquid chromatography-tandem mass spectrometry[J]. Food Additives & Contaminants Part A,Chemistry,Analysis,Control,Exposure & Risk Assessment,2018,35(3): 487.
6 李丽.柱前衍生-高效液相色谱-串联质谱法测定鲜茶叶中的春雷霉素[J].食品安全质量检测学报,2024,15(10): 64.
LI Li. Determination of Kasugamycin in fresh tea using high performance liquid chromatography-tandem mass spectrometry after pre-column derivation[J]. Journal of Food Safety & Quality,2024,15(10): 64.
7 AL M S, ABDEL H A T M, EL N R. A novel electrochemical hybrid platform for sensitive determination of the aminoglycoside antibiotic Kasugamycin residues in vegetables[J]. Food Chem,2023,411(6): 13 550.
8 张大伟,赵杉林,祝馨怡,等.蒸发光散射检测技术在石油化工领域中的应用[J].化学分析计量,2007,16(1): 76.
ZHANG Dawei,ZHAO Shanlin,ZHU Xinyi,et al. Evaporative light-scattering technology in the field of petrochemistry[J]. Chemical Analysis and Meterage,2007,16(1): 76.
9 徐自奥,张军忠,赵成仕. HPLC-ELSD法测定食品中γ-氨基丁酸含量[J].化学分析计量,2012,21(5): 49.
XU Ziao,ZHANG Junzhong,ZHAO Chengshi. Determination of γ-aminobutyric acid in food by HPLC-ELSD[J]. Chemical Analysis and Meterage,2012,21(5): 49.
10 HOMERIN G,GHINET A,NICA A S,et al. Optimization of detection of native amino acids with evaporative light scattering detector in chiral supercritical fluid chromatography[J]. Chromatographia,2021,84(2): 179.
11 PASCHEN C A,KLEMM D,GRAF T,et al. Simultaneous quantification of polysorbate 20 and poloxamer 188 in biopharmaceutical formulations using evaporative light scattering detection[J]. Journal of Pharmaceutical and Biomedical Analysis,2021,192: 113 640.
12 卓文珊,唐建锋,梁金胜,等.高效液相色谱-紫外检测法同时测定洗面奶中4种N-月桂酰氨基酸表面活性剂[J].色谱,2024,42(1): 99.
ZHUO Wenshan,TANG Jianfeng,LIANG Jinsheng,et al. Simultaneous determination of four N-lauryl amino acid surfactants in facial cleansers by high performance liquid chromatography-ultraviolet detection[J]. Chinese Journal of Chromatography,2024,42(1): 99.
13 卓文珊,冯顺卿,唐建锋.高效液相色谱法-蒸发光散射检测器测定表面活性剂中月桂酰基甘氨酸钠含量[J].日用化学工业(中英文),2023,53(2): 220.
ZHUO Wenshan,FENG Shunqing,TANG Jianfeng. Determination of sodium lauroyl glycinate by HPLC-ELSD[J]. China Surfactant Detergent & Cosmetics,2023,53(2): 220.
14 苏本正,都波,周建永.高效液相色谱法测定北沙参中的蔗糖及其指纹图谱[J].化学分析计量,2021,30(6): 26.
SU Benzheng,DU Bo,ZHOU Jianyong. Determination of sucrose in Glehniae Radix and its fingerprint by HPLC[J]. Chemical Analysis and Meterage,2021,30(6): 26.
15 刘宇,邢家溧,沈坚,等.高效液相色谱-蒸发光散射检测法同时测定固态食品中6种稀有糖[J].色谱,2023,41(9): 781.
LIU Yu,XING Jiali,SHEN Jian,et al. Simultaneous determination of six rare sugars in solid food by HPLC-ELSD[J]. China Industrial Economics,2023,41(9): 781.
16 陈建波,黄兰淇,马琳,等.附蒸发光散射检测器的高效液相色谱法测定水溶性肥料中3种季铵盐类植物生长调节剂的含量[J].理化检验-化学分册,2022,58(3): 299.
CHEN Jianbo,HUANG Lanqi,MA Lin,et al. Determination of 3 quaternary ammonium salt plant growth regulators in water-soluble fertilizer by high performance liquid chromatography with evaporation light scattering detector[J]. Physical Testing and Chemical Analysis (Part B Chemical Analysis),2022,58(3): 299.
17 睢超霞,袁鹏,张文豪,等.高效液相色谱-示差折光检测器法测定复配消毒液中3种双链季铵盐的含量[J].理化检验-化学分册,2024,60(1): 27.
SUI Chaoxia,YUAN Peng,ZHANG Wenhao,et al. Determination of 3 double-chain quaternary ammonium salts in compound disinfectant by high performance liquid chromatography combined with differential refractive index detector[J]. Physical Testing and Chemical Analysis (Part B Chemical Analysis),2024,60(1): 27.
18 MONDAL B,KOTE M,LUNAGARIYA C,et al. Development of a simple high performance liquid chromatography (HPLC)/evaporative light scattering detector (ELSD) method to determine Polysorbate 80 in a pharmaceutical formulation[J]. Saudi Pharmaceutical Journal,2020,28(3): 325.
19 肖雪,商广勇,马岩堂,等.蒸发光散射检测器高效液相色谱法同时测定猪肉中4种氨基糖苷类抗生素[J].化学分析计量,2024,33(6): 68.
XIAO Xue,SHANG Guangyong,MA Yantang,et al. Determination of 4 aminoglycosides in pork by high performance liquid chromatography with evaporative light scattering detector method[J]. Chemical Analysis and Meterage,2024,33(6): 68.
20 蒋婷婷,郑金星,林雪志.高效液相色谱法测定四季青中长梗冬青苷[J].化学分析计量,2021,30(4): 54.
JIANG Tingting,ZHENG Jinxing,LIN Xuezhi. Determination of Pedunculoside in Ilex Chinensis Sims by high performance liquid chromatography.[J]. Chemical Analysis and Meterage,2021,30(4): 54

来源:化学分析计量


