引用本文
史宇航,梁毅*.跨国医药公司实施ICH 指南的挑战与对策思考[J].中国食品药品监管.2025.8(259):130-137.
跨国医药公司实施ICH 指南的挑战与对策思考
Challenges and Countermeasures for Multinational Pharmaceutical Companies in Implementing ICH Guidelines
史宇航
中国药科大学国际医药商学院
SHI Yu-hang
School of International Pharmaceutical Business, China Pharmaceutical University
梁毅*
中国药科大学国际医药商学院
LIANG Yi*
School of International Pharmaceutical Business,China Pharmaceutical University
摘 要 Abstract
随着全球化程度的逐渐加深与医药行业的不断发展,国际人用药品注册技术协调会(ICH)指南的持续更新对跨国医药公司的影响日益显著。跨国医药公司需要密切关注有关变化,及时调整业务策略和运营模式,确保适应并遵循不断更新的ICH 指南要求。本文采用文献分析与政策研究方法,基于ICH 发展背景与跨国医药公司发展模式,分析跨国医药公司在实施ICH 指南时遇到的主要挑战以及应对策略,同时探索构建跨国医药公司质量管理通用标准,以期为其更好地实施ICH 指南提供参考。跨国医药公司应将适应和实施不断更新的ICH 指南作为持续监测的战略重点,以确保其在全球医药市场中保持竞争优势,实现可持续发展。
With the deepening of globalization and the ongoing evolution of the pharmaceutical industry, frequent updates to the International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) guidelines have had an increasingly significant impact on multinational pharmaceutical companies. These companies must closely monitor regulatory developments, promptly adjust business strategies and operational models, and ensure timely compliance with the evolving ICH requirements. This paper employs literature review and policy analysis methodologies to examine the key challenges faced by multinational pharmaceutical companies in implementing ICH guidelines, taking into account the historical development of ICH and corporate operational strategies. Furthermore, it proposes the construction of a general quality management framework adaptable across multinational operations to facilitate effective implementation of ICH standards.It is recommended that multinational pharmaceutical companies treat the adaptation to and implementation of updated ICH guidelines as a continuous strategic priority to maintain competitiveness in the global pharmaceutical market and achieve sustainable development.
关键词 Key words
国际人用药品注册技术协调会指南;跨国医药公司;监管;挑战;策略
ICH guidelines; multinational pharmaceutical companies; regulation; challenges; strategies
国际人用药品注册技术协调会
(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)是致力于促进全球药品监管协调与统一的国际组织,通过制定共同的药品监管指南,推动国际药品研发、注册、生产等监管工作的合作与互认。ICH的成立可以追溯至1990 年,全球制药行业面临着越来越多的挑战,如快速发展的科学技术、日益严格的法律法规、不断增长的国际贸易需求等。为了应对相关挑战,欧洲、美国和日本药品监管机构及相关组织共同发起成立ICH。2017 年6 月,原国家食品药品监督管理总局正式加入ICH,标志着我国药品标准在国际合作领域迈出重要的一步[1]。ICH 指南涵盖多个方面的内容,包括药物非临床研究、药物临床试验设计、质量控制标准、安全性评估以及药品注册申请等。这些内容经过广泛的学者讨论与专家评审,具有较好的科学性、有效性、可操作性等。由于ICH 成员覆盖全球主要的药品市场,ICH 指南具有较高的国际认可度和适用性,许多国家和地区药品监管机构将ICH 指南作为药品注册审评审批的参考标准。
跨国医药公司在全球医药市场中扮演着重要角色,ICH 指南的持续更新对其影响深远。首先,跨国医药公司通常承担药物研发的重要工作。其通常拥有庞大的专家团队和充足的研发资金,致力于药物创新,推动全球医药领域进步。其次,跨国医药公司通常具有较多药品国际市场准入的现实任务。其通常在多个国家和地区注册与销售产品,需要考虑药品国际市场准入顺序以及遵守不同国家和地区的监管要求,从而有效推动产品在全球范围内上市销售。最后, 跨国医药公司对于国际合作与协调“ 生态系统”的需求较大。其通常与不同国家和地区医疗机构、学术研究机构等开展多方合作,促进科研成果的转化和应用,推动医药科技的发展。因此,跨国医药公司需要及时监测ICH 指南的更新动态,为全球患者提供数量与质量并重的医药产品与服务。本文基于ICH 发展背景与跨国医药公司发展模式,探析ICH 指南实施过程中的主要挑战和应对策略,并探索构建跨国医药公司质量管理通用标准,以期为其更好地实施ICH 指南提供参考。
1 ICH 及其指南发展概况
2015 年10 月,ICH 召开大会宣布进行组织改革,根据瑞士法律,成为一个具有法律实体的国际组织。此次会议的召开不仅代表ICH 总结并交付了已探索25 年的全球药品监管指南,同时也反映出世界各国和地区对药品研发、注册、生产等监管环节达成长期协调稳定的愿景。协调监管要求是由欧共体于20 世纪80 年代初期提出的,欧洲各国和地区向药品市场的联合迈进证明了协调监管的可行性。1989年, 在法国巴黎举行的世界卫生组织国际药品监管机构会议(International Conference of Drug Regulatory Authorities,ICDRA)就实际操作计划展开了研究。随后,世界卫生组织与国际药品制造商协会联合会(The International Federation of Pharmaceutical Manufacturers and Associations,IFPMA) 商讨了关于国际协调的行业监管联合倡议, 并构思成立ICH。1990 年,欧洲制药工业协会联合会(European Federation of Pharmaceutical Industries and Associations,EFPIA)在布鲁塞尔召开会议, 各方代表共同讨论了ICH 的意义与任务。2015 年,ICH 被确立为独立的法律实体,旨在形成更加稳定的运行结构,不断增加国际外联,向更广泛的利益相关者传播更多关于药品监管的信息。
ICH 指南的发展历程可主要分为4 个阶段:① ICH 指南制定初期。其内容主要是围绕国际药品注册技术要求编写的,包括质量(quality)、安全性(safety)、有效性(efficacy) 和多学科(multidisciplinary) 等方面。② ICH 指南的修订与进一步扩展。ICH 指南经过不断修订和扩展,以适应不断发展的科学技术和国际药品监管的需求。③全球多方利益相关者参与编写。许多国家和地区药品监管机构与全球制药行业协会逐渐在ICH 指南研讨过程中贡献自身力量。④ ICH 应对新兴挑战。近年来,随着科学技术在医药领域的快速发展,ICH不断应对新兴挑战,如生物标志物、人工智能等在药品研发和注册中得到应用。为了应对这些新的挑战,ICH 不断修订和更新其指南,以持续引领国际药品注册和监管标准的更新。
2 跨国医药公司发展模式概况
跨国医药公司通常具有较为复杂的发展模式,以应对快速变化的全球医药市场与不断更新的国际监管要求。
2.1 运营模式
跨国医药公司的运营模式主要分为2 种:研发驱动型和市场驱动型。研发驱动型运营主要是指采用研发驱动模式,将创新作为主要竞争优势。这些公司通常在全球范围内拥有庞大的研发团队,并投入大量资金用于新药研发。市场驱动型运营主要是指采用市场驱动模式,注重市场营销和销售,将产品推向全球市场。这些公司通常在全球范围内建立了强大的销售网络和分销渠道,以确保产品的广泛覆盖和市场份额的增长。
2.2 全球布局
跨国医药公司在全球布局时重点考虑总部协调、研发设计与生产基地。总部协调即总部地区规划,跨国医药公司通常在全球范围内的政治金融中心设立总部,以便管理和协调各地业务,总部负责制定地区战略、管理运营活动,并与当地政府、行业组织和合作伙伴等沟通交流。研发设计即布局研发中心,跨国医药公司通常在全球范围内的人才聚集地设立研发中心,以便充分利用当地的科研人力资源开展药物研发和创新活动,研发中心通常拥有先进的实验设备和技术平台,致力于研发新药物。跨国医药公司的生产基地主要分布在全球范围内资源丰富之处,以满足不同国家和地区的市场需求,生产基地通常按照国际标准建设,并受当地监管机构的监管。
2.3 国际化战略
部分跨国医药公司采用标准化战略,即在不同国家和地区使用相同的品牌和产品,并采用统一的营销和销售策略。这种战略有助于降低成本,提高效率,增强品牌影响力。另有部分跨国医药公司采用本地化战略,根据不同国家和地区的文化、法规和市场需求,定制产品以及营销和销售策略。这种战略可以更好地适应当地市场环境,提高产品的市场竞争力。目前,较多跨国医药公司乐于与当地相关组织和机构进行战略合作,共同开发市场和推广产品,助其更好地理解当地市场和行业环境,更快实现市场准入和增长。
3 跨国医药公司实施ICH 指南面临的挑战
3.1 ICH 指南更新较快
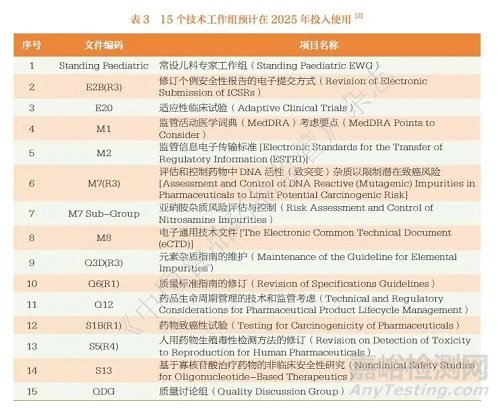
笔者分析ICH 官网发布的《2025 年度ICH 工作计划》(ICH Association 2025 Annual Work Plan)[2] 发现,ICH 于2024 年初步计划了2025 年度5 类目工作,其中战略工作(Strategy)6 项、协调工作(Harmonisation)4 项、运营工作(Operations)22 项、程序工作(Procedures)3 项、沟通交流工作(Communication)4 项。此外,工作计划包含3 个附件:附件1 为10 个技术工作组预计在2025 年达到步骤4 或实现最终交付,见表1 ;附件2 为7个技术工作组预计在2025 年达到步骤2a/b,见表2 ;附件3 为15 个技术工作组预计在2025 年投入使用,见表3。ICH 指南逐年快速的更新与完善为跨国医药公司带来了挑战,主要体现在以下3 个方面。
3.1.1 反应时间压力
跨国医药公司通常需要花费大量时间和精力了解更新变化的ICH指南,并将其应用到业务实践中。不论是学习更新的ICH 指南,还是将ICH 指南转化到实践中,都需要较长时间,这可能导致项目延迟或者影响产品上市规划,从而影响企业的收入和市场竞争力。
3.1.2 技术难题压力
部分ICH 指南的更新涉及技术要求的提升,跨国医药公司需要采用新的技术以达到相关要求。ICH 指南对非临床研究与临床试验数据管理具有严格的要求,跨国医药公司需要具备先进的数据采集、统计分析、整理归纳等技术,还需要具备先进的药物安全评价技术和监测手段。此外,ICH 指南对药品的生产工艺、质量控制和质量保证等具有较高的标准,如在稳定性、纯度、杂质等方面,跨国医药公司需要建立健全质量管理体系,确保药品生产过程的合规性和产品质量的稳定性。
3.1.3 成本增加压力
跨国医药公司通常需要不断投入资源用于员工培训与教育,以及与监管机构持续沟通等,以适应ICH 指南的快速更新。具体而言,跨国医药公司需要为员工提供有关ICH 指南的知识培训,以确保员工了解和遵循相关要求,该成本可能涉及组织内部培训课程、组织外部学习活动以及雇佣专业顾问等费用。与监管机构沟通的成本是指跨国医药公司在日常运营过程中与监管机构进行持续交流需要付出的成本。
3.2 国际监管要求存在差异
3.2.1 实施进度差异
不同国家和地区的药品监管机构对于ICH 指南的实施进度具有差异。有的国家和地区能够快速落实全部ICH 指南,也有国家和地区受各种因素影响只能实施部分ICH 指南[3]。跨国医药公司需要灵活调整项目计划,选择适合药品先行进入的国家和地区,并确保及时提交和更新注册申请。
3.2.2 注册申请差异
不同国家和地区的药品监管机构对于符合ICH 指南的药品注册申请的要求具有差异[4]。一些国家和地区药品监管机构要求提交详细和全面的数据,也有一些国家和地区药品监管机构对部分数据的要求较少。跨国医药公司需要根据不同国家和地区药品监管机构的要求准备申请资料,确保其符合对应市场的规范。
3.2.3 审查标准差异
不同国家和地区的药品监管机构可能采用不同的审查标准和评价方法对ICH 指南的符合性进行审查。一些国家和地区可能更加关注药品的安全性,也有一些国家和地区可能更加注重药品的疗效和临床效果。跨国医药公司需要根据不同国家和地区药品监管机构的要求进行不同的临床试验设计和数据分析整理。
3.3 跨国医药公司内部调整管理困难
3.3.1 内部组织结构和工作流程调整困难
首先,部分跨国医药公司内部存在组织文化差异。跨国医药公司可能在不同国家和地区设有多个分支机构,每个分支机构具有不同的组织文化和工作方式,不同部门或团队可能对新的ICH指南持有不同的态度。其次,跨国医药公司不同部门或团队之间可能存在权力和利益冲突。例如,研发部门通常希望加快新药研发进程,而质量管理部门可能更关注合规性和产品质量,各方可能对适应新的ICH 指南产生不同的意见。最后,部分跨国医药公司内部信息沟通和协调困难。不同部门或团队之间信息沟通和交流困难,可能导致新的ICH 指南的信息难以被有效传达和理解,影响变革的推进和实施效果。
3.3.2 内部实现标准化困难
跨国医药公司在实施ICH 指南时,其内部在实现标准化过程中可能面临多种挑战。首先,业务流程多元化。由于地理位置不同,市场需求存在差异,跨国医药公司在不同国家和地区的业务流程呈现多样性,其内部要实现标准化,需要克服不同业务流程之间的差异挑战。其次,技术平台不一致。跨国医药公司在不同国家和地区可能使用不同的信息技术平台和软件系统来支持业务开展,技术平台不一致可能导致数据整合和信息共享困难,阻碍标准化的实现[5]。最后,标准化流程需要持续改进。实现标准化不是一次性的任务,而是一个持续改进的过程。跨国医药公司需要建立有效的监控机制和反馈机制,及时发现和解决标准化过程中的问题,并持续改进标准化流程,以确保其有效性和持续性。
4 跨国医药公司应对ICH 指南更新的策略
4.1 加强沟通交流,紧跟前沿动态
跨国医药公司应与药品监管机构和行业协会保持密切沟通交流,以确保及时获取ICH 指南更新变化的重要信息,使其运营符合最新的ICH 指南要求。一方面,跨国医药公司应加强与不同国家和地区药品监管机构的沟通与协调,建立开放、透明的沟通渠道,定期进行会议交流,及时向监管机构报告项目进展信息,积极回应监管机构提出的问题和疑虑,与监管机构形成长期稳定的沟通交流关系,通过参与政府部门组织的会议和研讨等活动,建立持续改进机制,不断总结经验教训,提升内部合规水平[6]。另一方面,跨国医药公司应积极与行业协会和倡导团体沟通交流,如IFPMA、生物技术创新组织(Biotechnology Innovation Organization,BIO)、EFPIA 等,分享相关经验和资源,共同推动ICH 指南的制定和实施。
4.2 优化内部组织结构
跨国医药公司可建立专门的团队或部门跟踪ICH 指南合规工作,并及时调整工作流程以满足需要。该团队或部门可以是一个典型的跨职能工作组,例如,其成员可以包含临床试验、质量管理、药物警戒等部门的代表。此举不仅可以兼顾各项工作的顺利开展,也考虑到公司内部各方利益,有利于ICH 指南的实施。此外,该团队或部门可负责不同部门之间的沟通协作,解决跨部门合作中的问题和矛盾,确保信息畅通,并识别现存的瓶颈问题,采取优化措施,建立健全质量控制和风险管理系统,确保所有业务活动符合质量标准和合规要求。
4.3 制定内部标准化流程
跨国医药公司可制定和实施内部标准化流程和操作规范,并不断改进,以确保持续遵循ICH指南要求,提高业务运作的效率和质量,增强市场竞争力。首先,全面分析和评估当前的业务流程和操作规范,确定与ICH 指南要求相符的部分,并认定其为标准化流程,重点关注有待调整或持续更新的环节。其次,确保已被认定的标准化流程的质量管控工作按照统一的标准进行,包括标准化的操作流程、文件模板、记录格式等[7]。最后,建立持续改进机制,不断优化和完善标准化流程和操作规范,以适应业务发展的需要和指南更新的要求。
5 对于跨国医药公司构建质量管理通用标准的思考
跨国医药公司需要在复杂多变的市场环境中重点关注并坚持实施ICH 指南,笔者探索构建跨国医药公司的质量管理通用标准,以期为跨国医药公司进行常态化运营的合理监管提供参考。
5.1 严格执行药物非临床研究质量管理规范
跨国医药公司应遵守药物非临床研究质量管理规范(good laboratory practice,GLP),以符合ICH 指南的相关要求。精心设计研究方案,确保研究结果的可靠性和可重复性。合理选择动物模型和研究方法,避免潜在的偏差。寻找并应用新的技术和方法,以提高研究效率和准确性。建立完善的数据管理系统,确保数据的完整性和安全性,并利用统计学方法对数据进行深入分析,发现其潜在的规律和趋势。
5.2 优化药物临床试验设计与执行
跨国医药公司可通过开展多中心临床试验、随机双盲对照试验等,确保试验结果的准确性和可靠性[8]。同时,采用先进的临床试验技术和方法,如生物标志物分析、适应性设计等,提高临床试验效率和成本效益[9]。
5.3 加强药品生产与流通质量管理
跨国医药公司应建立健全质量管理体系,包括标准化的质量控制流程、质量文档管理系统、质量审核和评估机制等。具体而言,建立标准化的质量控制流程,包括原材料采购、生产制造、包装和分销等环节的质量控制和监督;制定可追溯的质量文档管理系统,包括电子文档管理系统、数据采集和分析平台、物联网平台等,实现数据的实时监测和管理[10] ;实施质量审核和评估机制,定期对质量管理体系进行内部审核和外部认证,以确保符合ICH指南和相关法规要求。
5.4 健全药物警戒体系
跨国医药公司应建立完善的药物安全评价与监测体系,包括临床试验前、临床试验过程中和上市后的药物安全监测和报告机制。通过实时监测,及时发现并应对药物安全问题,保障患者的安全与权益。加强药物风险评估与控制,通过分析产品生命周期中可能存在的风险,建立风险评估和管理控制体系,及时识别潜在的质量风险,并采取措施加以预防和控制[11]。
6 讨论与小结
本文主要探析了跨国医药公司在实施ICH 指南时面临的挑战,包括ICH 指南更新较快、国际监管要求存在差异、跨国医药公司内部调整管理困难等。针对这些挑战,笔者提出了相关对策思考,如加强多方沟通以掌握ICH 更新的前沿动态、优化内部组织结构并建立标准化流程等,以期帮助跨国医药公司更好地应对ICH 指南的更新,不断提高产品质量和合规水平。同时,本文为跨国医药公司建立质量管理通用标准提供了参考,以期帮助跨国医药公司更好地实施ICH 指南。需要说明的是,由于ICH 指南研究范围广泛且内容深入,跨国医药公司受国际药品监管环境变化的影响较大,本文的分析不足以涵盖全部要点,有待进一步完善。未来,随着全球药品监管趋于标准化与统一化,跨国医药公司需要不断优化和完善自身管理体系和运营策略,加强合作伙伴关系和沟通交流,推动数字化转型,提高创新能力和管理水平,以更好地适应国际药品监管环境的变化,保持竞争优势,应对新的机遇与挑战。