您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2025-09-29 09:30
1、如何完善中间产品存放时限验证?
如何完善中间产品存放时限验证?需要根据车间实际生产工序(生产设备、生产工艺、中间产品存放条件)指导小试开发,再根据小试开发结果指导中试放大生产过程中的中间产品存放时限确认,再根据中试放大生产的中间产品存放时限确认的结果指导工艺验证过程中的中间产品存放时限的验证,从而形成科学、合理的中间产品存放时限。
中间产品存放时限的开发:
①:评估生产工序对中间产品存放时限的风险;
②:分析可能影响中间产品存放时限的工艺参数,进行小试开发;
③:根据小试开发结果进行中试放大生产确认;
④:根据中试放大生产确认的结果指导工艺验证;
⑤:商业化后持续监测产品工艺,形成科学合理的中间产品存放时限;
2、中间产品存放时限的风险评估
(1)关键工艺步骤风险评估

(2)关键工艺参数风险评估

(3)生产过程中的中间产品存放时限

(4)确定生产过程中的中间产品存放时限
①:配制时限:配制开始至过滤结束;
②:过滤时限:过滤开始至过滤结束(适用于过滤时间较长的产品);
③:灌装时限:过滤结束至轧盖结束(注射液);
④:灌装时限:过滤结束至冻干开始(冻干粉);
⑤:冻干结束至轧盖结束(冻干粉);
3、小试开发过程中的中间产品存放时限研究
(1)配制、过滤及灌装过程中的中间产品存放时限

注:配制、过滤及灌装过程中的温度、时限需根据产品实际生产所需适当调整。
4、中试放大生产过程中的中间产品存放时限
根据小试开发结果设计中试放大生产中的中间产品存放时限。
(1)配制时限
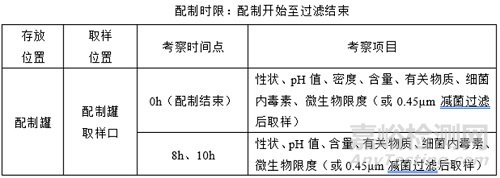
注:
①:配制开始以采水开始计算;
②:0h取配制结束的样品;
③:配制开始后10h开始过滤或过滤后留一部分药液用于中间产品存放时限取样;
④:考察时间点、考察项目随产品特性、生产实际情况灵活调整;
(2)灌装时限
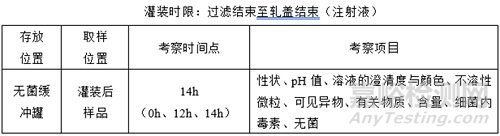

注:
①:注射液需连续或间隙式灌装14h,稳定性样品取灌装后期样品;
②:冻干粉需连续或间隙式灌装14h,稳定性样品取灌装后期样品,过滤结束14h后开始冻干;
③:考察时间点、考察项目随产品特性、生产实际情况灵活调整;
(3)轧盖时限
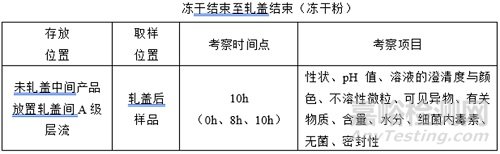
注:
①:注射液灌装后随即进入轧盖工序进行轧盖,可将轧盖时限并入灌装时限;
②:冻干粉冻干结束后开始轧盖,未轧盖样品在冻干机或A级层流下可能停留数个小时等待轧盖,需单独研究轧盖时限;
③:考察时间点、考察项目随产品特性、生产实际情况灵活调整;
5、工艺验证过程中的中间产品存放时限
可根据中试放大生产过程中的中间产品存放时限的结果调整并设计工艺验证过程中的中间产品存放时限,以保证生产工艺稳定、可控,可稳定、持续的生产出符合质量要求的产品。
6、参考资料
1.化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行).
2.国家药品监督管理局.关于发布除菌过滤技术及应用指南等3个指南的通告(2018年第85号).
3.EU.GMP Annex 1 : Manufacture of Sterile Products(2020).
4.EMA. Guideline on the sterilisation of the medicinal product, active substance, excipient and primary container(2019).
5.PDA Process Simulation Testing for Aseptically Filled Products Technical Report No. 22 (2011 Revision) of PDA.

来源:药事纵横


