今日头条
盛世泰科SGLT-2/DPP-4抑制剂获批临床。盛世泰科1类化药CGT-2201胶囊获国家药监局临床试验默示许可,拟用于单药或联合其他药物用于2型糖病患者的血糖控制。CGT-2201是一款SGLT-2/DPP-4双靶点抑制剂,可在抑制SGLT-2活性来降低葡萄糖在肾脏中的重吸收的基础上,同时减缓DPP-4对GLP-1的灭活作用。而且它还可以减轻现有SGLT-2药物泌尿系统感染副作用,降低肾脏负担,减轻肾功能不全的糖尿病患者使用禁忌。
国内药讯
1.礼来AD新药在华启动III期临床。礼来新一代N3pG淀粉样蛋白抗体remternetug在中国登记启动一项国际III期研究(CTR20230785),拟评估用于静脉输注治疗具有脑淀粉样蛋白和tau蛋白病理的早期症状性阿尔茨海默病(AD)受试者中的安全性和有效性。该项试验计划国内入组140人,国际入组1300人,中国方面的主要研究者由复旦大学附属华山医院医学博士郁金泰担任。
2.以岭CLDN18.2单抗获批实体瘤临床。以岭药业1类生物制品BIO-008获国家药监局临床试验默示许可,拟开发用于实体瘤的治疗。BIO-008是一款靶向CLDN18.2的单抗药物,通过抗体和补体依赖介导的细胞毒性作用,诱导细胞凋亡、抑制肿瘤细胞增殖,杀伤CLDN18.2阳性肿瘤细胞。在临床前研究中,该产品具有良好的体内外活性和安全性。
3.辉瑞CD47抑制剂在华获批临床。辉瑞通过收购Trillium Therapeutics所得的SIRPα Fc融合蛋白PF-07901801(TTI-622)在中国申报的IND申请获得国家药监局批准,拟用于治疗晚期血液系统恶性肿瘤患者。PF-07901801通过阻止CD47传递其抑制信号以及IgG4 Fc产生适度的促吞噬信号来增强巨噬细胞对肿瘤细胞的吞噬作用和抗肿瘤活性。在国外,PF-07901801用于血液肿瘤和实体瘤治疗的多项临床研究已推进至II期。
4.赛诺菲RIPK1抑制剂获批UC临床。赛诺菲1类化药SAR443122硬胶囊(eclitasertib,DNL758)获国家药监局临床试验默示许可,适应症为溃疡性结肠炎。SAR443122是一款选择性受体相互作用丝氨酸/苏氨酸蛋白激酶1(RIPK1)小分子抑制剂。RIPK1是肿瘤坏死因子(TNF)受体信号通路中的关键性信号蛋白,它能调节全身组织中的炎症和细胞死亡。目前,全球尚未有RIPK1抑制剂获批上市。
5.亿帆22-Fc融合蛋白国内获批酒精肝炎II期临床。亿帆医药旗下子公司上海亿一自主开发的重组人白介素22-Fc融合蛋白F-652(普罗纳亭,promenakin)新适应症获CDE批准开展II期临床,用于治疗酒精性肝炎。在美国开展的急性移植物抗宿主病(GVHD)和酒精性肝炎(AH)两项临床试验的结果表明,F-652在抗中重度组织炎症、修复器官损伤等方面具有突出的疗效。FDA已于2019年10月授予该新药治疗GVHD的孤儿药资格。
国际药讯
1.艾伯维IL-23抑制剂银屑病IIIb期临床积极。艾伯维IL-23抑制剂Skyrizi(瑞莎珠单抗)治疗难治性斑块状银屑病患者的IIIb期临床最新数据积极。该项试验此前已达到主要终点,Skyrizi治疗组16周时有56.3%患者达到银屑病体征和症状的显著改善(sPGA 0/1)。此次52周扩展研究显示,有63.0%患者达到皮损清除或几乎清除(sPGA 0/1)的主要终点;分别有19.8%和26.2%患者在第16周和第52周达到完全皮损清除的次要终点。
2.精分症口服新药达III期临床主要终点。Karuna公司口服M1/M4型毒蕈碱型乙酰胆碱受体激动剂KarXT(xanomine -trospium)治疗成人精神分裂症的III期EMERGENT-3研究达到主要终点。与安慰剂相比,KarXT在阳性和阴性综合征量表(PANSS)总评分上降低8.4分,具统计学意义。此外,KarXT耐受性良好,副作用与EMERENT-1和EMERENT-2研究一致。再鼎医药拥有该新药在大中华区的独家权益。
3.武田TYK2抑制剂银屑病Ⅱb期临床积极。武田TYK2抑制剂TAK-279在AAD年会上公布用于治疗中重度斑块状银屑病的Ⅱb期临床积极结果。该项研究达到主要和次要终点,与安慰剂相比,TAK-279(5mg、15mg和30mg)治疗组达到PASI 75应答的患者比例显著更高(44%、68%和67%,vs6%,p<0.001);达到医生整体评估(PGA)评分为0/1的患者比例分别为27%、49%和52%;不良事件发生率为53-62%(vs44%),严重程度多为轻中度。
4.第一三共HER3-ADC两项早期临床积极。第一三共HER3靶向ADC药物patritumab deruxtecan (HER3-DXd)在治疗EGFR突变、不可切除或转移性非小细胞肺癌(NSCLC)患者的I期临床(U31402-A-U102),以及治疗HER3阳性/HER2阴性、局部晚期或转移性乳腺癌患者的I/II期临床(U31402-A-J101)均获得积极结果。在U31402-A-U102研究中,HER3-DXd(5.6mg/kg)的确认ORR为40.2%,DCR为78.4%,DOR为7.6个月。在U31402-A-J101研究中,HER3-DXd在HER2低表达亚组患者的确认ORR为36.2%,DOR为7.2个月。
5.吉利德引进IRAK4靶向蛋白降解剂。吉利德行使选择权,获得与Nurix公司于2019年6月签订的共同开发5个靶标的创新蛋白降解药物项目的第一个候选产品NX-0479(GS-6791)独家许可授权。GS-6791是一种强效的、选择性的、口服的IRAK4降解剂,针对IRAK4蛋白激酶的支架和激酶功能,阻断TLR和IL1Rs下游的炎症反应。IRAK4降解在治疗类风湿性关节炎(RA)和其他炎症性疾病方面有潜在的应用。
6.BioNTech与OncoC4合作开发CTLA-4单抗。BioNTech公司与OncoC4公司就后者临床期CTLA-4单抗ONC-392达成合作,共同开发和商业化ONC-392用于(单药或联合用药)治疗多种实体瘤。去年,FDA已授予ONC-392快速通道资格,用于单药治疗先前接受过抗PD-1/L1疗法后进展的转移性非小细胞肺癌(NSCLC)患者。根据协议,OncoC4将获得2亿美元前期付款,以及开发、监管和商业化里程碑后期付款。昂科免疫拥有该药的大中华区权益。
医药热点
1.四川省牙冠降价结果公布。3月20日,四川省药械招标采购服务中心发布《关于口腔牙冠竞价挂网拟入围结果公示的通知》。此次牙冠竞价挂网共有110家企业参与报价,其中107家企业获得拟入围资格, 产品入围率为88%,产品入围均价为327元。此次牙冠竞价挂网中,最低入围价格仅100元,最高入围价格为656元。竞价前有效申报价最高的原材料为3M的LAVA全瓷牙冠产品的入围均价降至653元,原材料为爱尔创的全瓷牙冠产品入围均价降至228元。
2.国家卫健委、医保局、药监局设置公布。3月20日,中国政府网发布《国务院关于机构设置的通知》。根据通知,国家卫健委属于国务院组成部分,国家医保局属于国务院直属机构。《国务院关于部委管理的国家局设置的通知》同时发布,其中国家中医药管理局由国家卫健委管理,国家疾病预防控制局由国家卫健委管理,国家药监局由国家市场监督管理总局管理。
3.美CDC:耳念珠菌已遍布美国一半以上的州。美国疾控中心(CDC)20日表示,耳念珠菌正在以“惊人的速度”传播,目前已遍布美国一半以上的州,成为紧迫的公共卫生威胁。从2019年到2020年,美国的感染人数增加了59%,达到756人,2021年感染人数增加了95%,达到1471人,2022年感染人数进一步上升,达到2377人。根据研究,耳念珠菌可导致免疫系统较弱的人患上严重疾病,且具有耐药性。
评审动态
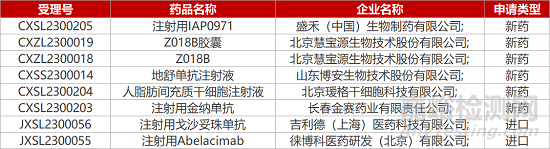
1. CDE新药受理情况(03月21日)
2. FDA新药获批情况(北美03月17日)