吹灌封技术即吹瓶Blow、灌装Fill、封口Seal,简称BFS,早在20世纪60年代就已经发展起来。
BFS是采用一种专用无菌包装技术,连续操作,将医用聚乙烯(PE)或聚丙烯(PP)颗粒制成容器,全自动地完成灌装和封口过程,快速地连续循环生产。它将数个制造工艺集成在同一设备中,以单一工序在无菌状态下完成塑料容器的整个吹塑、灌装和封口等过程,能有效确保产品的使用安全。
无菌药品的生产历来是要求最严格、风险最高的制药项目,也是实施《药品生产质量管理规范》(2010版)的重点和难点。《中华人民共和国药典》(2010版)在附录XVⅡ灭菌法中规定“一般热不稳定性物品的F0值≥8”。
1、BFS生产线基本介绍
历史沿革
BFS ( Blow/Fill/SeaI )生产线集制瓶、灌装、封口三个步骤于一体,也叫做“三合一”技术,是无菌制剂灌装线的一种。BFS技术及其设备始于20世纪60年代德国的Rommelag(罗姆莱格)公司,后来在美国、意大利等相继推出这一技术设备产品;我国国产BFS技术设备研制开发和应用方面有近20年历史,已经形成了楚天科技、东富龙、新华医疗、上海位山科技等多个国产知名BFS技术设备制造公司品牌;当前国内已有几百家制药企业、化妆品企业等在应用BFS技术设备,这一技术到目前为止仍然是无菌制剂灌装生产的先进制造技术。
经过了多次改进和提升,现在的BFS技术已经有了更为广泛的适用范围和应用场景,可用于无菌液体制剂(溶液、乳状液、混悬液)和无菌半固体制剂(凝胶、乳霜和软膏)生产,也有用于非无菌产品的生产情况。
在制药行业,目前BFS技术主要应用于终端灭菌和非终端灭菌无菌液体制剂生产,如滴眼液、注射液、吸入溶液等。BFS技术在制药领域主要可满足0.1ml~1500ml容量的无菌生产,其灌装速度在不同型号和不同设备制造商可能存在一定的差异,均具有在线清洁(CIP)和在线灭菌(SIP)功能。上世纪80年代末期,BFS技术开始引入中国,目前国内在大容量注射剂生产、小容量无菌液体制剂生产等方面,已经积累了丰富的应用经验,并促进了国内BFS技术设备的生产和开发。
随着1962年第1台BFS机器面世,BFS无菌灌装工艺已有近50年的历史,是一种技术成熟的无菌灌装工艺,符合各国GMP的要求。中国、美国、欧盟、日本等国家的相关法规都对BFS无菌灌装工艺作了相应的规范。
欧洲
欧洲是 BFS 技术的发源地,BFS 无菌灌装工艺在欧洲应用的领域也比较广泛。欧盟药品管理部门对 BFS 无菌灌装工艺有比较系统的法规和技术要求。与 BFS 无菌灌装工艺相配套的指导性技术文件也比较多,如《EMEA 直接接触塑料包装材料指导原则》、《溶液剂型产品灭菌方法选择的决策树》、《药品生产中计算机处理系统的验证指南》等。
《EUGMP—2008》附件1“无菌医药产品的生产”:第26条:吹、灌、封系统是一套专用机械设备,连续操作,从热塑性颗粒吹制成容器至灌装和密封,整个过程由一台全自动机器完成。用于无菌生产的吹、灌、封设备本身装有A级空气风淋装置,在操作人员按A/B级区着装要求的条件下,该设备可以安装在洁净度为C级的环境中。在静态条件下,此环境微粒和微生物指标均应达标,在动态条件下,此环境的微生物指标应达标。用于生产最终灭菌产品的吹、灌、封设备至少安装在D级环境中。
美国
美国是无菌药品研发、生产大国和强国,也是 BFS 技术应用比较规范的国家。在国际吹/灌/封操作者协会(BFS IOA)的会员中有近半数的成员来自美国。FDA 和美国药典(USP)在相应的技术报告中也对 BFS 无菌灌装技术进行了较为系统的研究和阐述。
USP(1116)《洁净室和其他受控环境的微生物学评价》中, “吹瓶、灌装、封口三合一技术”:吹瓶、灌装、封口三合一技术把容器的成型、溶液的灌装、容器的封口在同一台设备上完成。从微生物角度来说,在从容器成型到封口的过程不间断工作,极少地暴露在环境中,从而获得无菌效果。这种技术已经使用了大约30年,已经证明污染率在0.1%以下。通过总结和分析介质灌装的数据,印证了吹瓶、灌装、封口三合一系统的污染率可以到0.001%。
《USAGMP—2004》附件2“吹灌封技术”:“吹、灌、封技术是指容器成型、灌装、封口在一台设备上连续完成的自动化工艺过程。它常用来生产包装眼药、呼吸护理产品,并有时用于生产注射类产品。BFS设备的环境要求满足十万级,重点区域的空气质量要求应满足微生物性百级标准。
中国
我国为了鼓励药品生产企业使用 BFS 无菌灌装工艺生产无菌药品,提高无菌药品的质量和无菌药品的研发能力,《药品生产质量管理规范(2010)》在附录一(无菌药品)中新增了第五章《吹灌封技术》。
《药品生产质量管理规范》(2010版)附录1(无菌药品)第5章“吹灌封技术”:第17条:用于生产非最终灭菌产品的吹灌封设备自身应装有A级空气风淋装置,人员着装应当符合A/B级区的要求,该设备至少应当安装在C级洁净区环境中。在静态条件下,此环境的悬浮粒子和微生物指标均应当达到标准,在动态条件下,此环境的微生物指标应当达到标准。用于生产最终灭菌产品的吹灌封设备至少应当安装在D级洁净区环境中。第18条:因吹灌封技术的特殊性,应当特别注意设备的设计和确认、在线清洁和在线灭菌的验证及结果的重现性、设备所处的洁净区环境、操作人员的培训和着装,以及设备关键区域内的操作,包括灌装开始前设备的无菌装配。
上述法规为BFS无菌灌装工艺在设备选型、安装、运行等方面提供了法规依据,同时也证明了BFS工艺是一种技术成熟的无菌灌装工艺,符合各国GMP要求,用BFS无菌灌装工艺生产无菌产品是一种发展趋势。
2、BFS无菌灌装工艺特点及其比较
BFS机器可以在计算机程序控制下完成所有物料管线的CIP/SIP(在线清洗/在线灭菌),使制瓶、灌装、封口3种工艺过程均在A级风淋保护下的同一无菌环境中完成。
整个生产控制过程由计算机程序按预定的程序完成,工艺过程中可能出现的风险(环境、温度、压差等因素)都由计算机控制系统按设定的参数进行全过程监控,整个生产过程的各项参数完整地储存在计算机中,可随时查阅,但不可更改,这是目前无菌保障能力最强的灌装工艺。
BFS无菌灌装工艺的优势
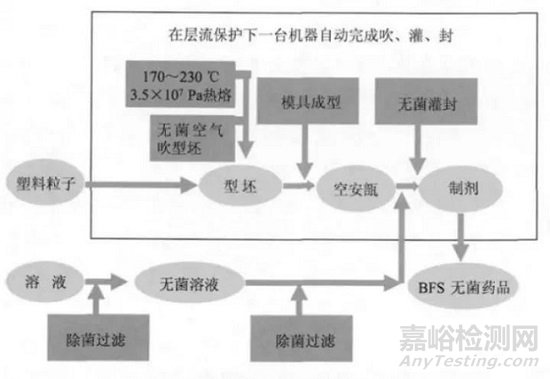
BFS无菌灌装工艺流程如图1所示,其优势有:
图1 BFS无菌罐装工艺流程
(1)BFS设备按照“黑白分区”的原则设计、安装,整个生产过程由计算机程序控制完成,工艺参数稳定可靠,设备的灌装区在A级层流保护下,生产期间的灌装间无操作人员,生产过程不存在污染源;与物料接触的所有工艺管线(包括配制系统)均可实现CIP/SIP,吹、灌、封工位有A级风淋室保护,产品在灌装间外冲裁,产品输送通道一端在A级层流区,一端在普通生产区,有不小于40Pa的压差保护,整个工艺过程有很强的无菌保障能力。
(2)BFS设备在无菌状态下自制容器,无需对容器进行清洗和灭菌,节约工艺用水和能源。
(3)BFS设备采用模块化设计,一台设备就像一个小工厂,可自动完成吹、灌、封全部工艺过程及监控,设备占地面积小,生产过程能耗少,所以BFS无菌灌装工艺的综合生产成本并不比传统无菌灌装工艺高,但产品质量和综合经济效益要大大高于传统的无菌灌装工艺。
(4)BFS设备可根据工艺需要使用PP/PE2种材料,塑料容器生产的综合成本低,产品技术含量和附加值高。
(5)BFS设备可在计算机程序控制下自动完成CIP/SIP,并有可靠的重现性,结果安全可靠。
(6)BFS设备可实现无菌灌装,不需高温灭菌,产品质量稳定,只要更换不同的模具就可适用多种形式的无菌产品灌装和多种无菌容器的生产。
(7)BFS设备的灌装机会在产品灌装的同时,在瓶颈处形成“鲁尔接口”结构,“鲁尔接口”可以和注射器紧密连接,抽取溶液时外部空气不会进入容器内,产品可实现无菌生产、 无菌使用,安全性能好。塑料包装废弃物易处理,不会对环境造成污染。BFS无菌灌装工艺有近50年的历史,由于在生产和使用过程中的无菌保障能力强等优势,BFS无菌灌装工艺替代洗、灌、封、灭菌的玻璃安瓿生产工艺和玻璃瓶大输液生产工艺已成为一种趋势。柔性包装的无菌产品在战备和救灾等特殊领域更具不可替代的优势。
与BFS无菌灌装相比传统无菌灌装的缺陷
在传统的无菌灌装工艺中,由于设备不能真正实现CIP/SIP,特别是设备的关键组件要在使用前进行人工组装、调试,因此会对设备和无菌环境造成污染。容器和组件都是外购的,要分别进行清洗、消毒,然后再组合在一起,每一环节都存在污染的风险,无法达到整个工艺过程都得到无菌保证的要求。实际生产过程也证实了传统无菌灌装的缺陷,如小容量玻璃安瓿的洗、灌、封、灭菌工艺就有以下缺陷:
(1)外购玻璃安瓿需要建造较大的内包材库房,洗、灌、封、灭菌及后处理设备多,组成的生产线长,占用厂房面积大,基础建设成本高;洁净生产区面积大,区域划分复杂,控制和检测难度大;洗瓶工序用水多,容器、成品需2次灭菌,能源消耗大;操作岗位多,管理风险大;产品易破碎,包装、运输成本都很高。传统无菌灌装工艺的综合成本要高于BFS无菌灌装工艺。
(2)火焰热熔封口,冷却时安瓿内会产生负压,使用时会有大量的细玻璃屑在负压的作用下进入药液中,使产品在使用时受到污染,不溶性微粒会对使用者造成潜在的危害,产品在使用过程中存在风险;锋利的玻璃安瓿断口也会对操作者造成伤害。
(3)高温灭菌过程会改变一些药品的有效成分,同时产生“新物质”,造成药害事件,有些产品受原料和工艺限制不能实现高温灭菌,不符合无菌药品生产工艺的要求,“流通蒸汽灭菌” 本身就是一个很大的风险过程。
(4)设备及工艺管线,特别是除菌过滤后的设备组件及输送管线不能实现CIP/SIP,灌装前设备的组件需进行人工组装、调试,灌装区内需要人员操作,不可控因素多,无菌保障能力差;废弃物不可降解会对环境造成污染,达不到使用者安全、操作者安全、环境安全的要求。
(5)传统工艺在库房面积,灭菌经济性方面较差。
与BFS无菌灌装工艺相比冻干工艺的缺陷
许多产品因不耐热,不能实现最终灭菌,只好选择冻干工艺。BFS无菌灌装工艺和冻干工艺都是非最终灭菌工艺。通过生产过程的无菌保障能力、生产效率和生产效益的对比,可以看出BFS无菌灌装工艺同冻干工艺相比,有很大的产品安全性和无法比拟的工艺优越性。冻干工艺的基本过程:西林瓶和胶塞清洗灭菌→产品灌装→半加塞→进冻干机长时间冷冻升华、压塞→出冻干机→轧铝盖→贴标包装。
冻干产品的生产需外购西林瓶、胶塞、铝盖,需较大面积的库房进行存放;冻干工艺过程设备多、高等级的洁净厂房占用面积大,要求高 控制难、投资大;冻干工艺路线长,生产过程不能实现无人操作,产品无法进行有效地检漏,无法检测出不溶性微粒;环节多、风险大;生产周期长、成本高、产量低,经济效益差。
BFS无菌灌装工艺的应用
BFS工艺更适合热敏类药物、生化制剂、疫苗等产品的生产。在生产过程中,独特的模具设计使得安瓿的成型和冷却过程几乎是同时完成的,产品的温度虽在灌装开始时略有上升,但不足以影响药物的质量。BFS无菌灌装工艺在国内无菌药品生产中,已有许多成熟的应用案例,如克林霉素磷酸酯注射液、生化类疫苗(不耐热)、苯甲醇注射液(挥发性强)、特殊疗效的大容量注射液等。
工艺验证
在基于BFS技术的无菌液体制剂无菌验证方面,我们主要从以下几方面入手:
(1)挤出工艺验证
对于新的吹灌封设备有必要采用一定的方法证明吹灌封设备生产的包装容器是无菌无热原的,通过对塑料颗粒染菌对比实验,经2015版药典四部1100生物检查法验证容器无菌、无热源。
(2)在线清洁验证
吹灌封设备的清洁验证通过操作屏幕设定,在线清洗过程是自动运行的,这些设定的清洗参数需要经过验证,只有通过验证后才能够用于生产,确保生产产品不会带入超过限度的污染物。
完整清洁验证程序还应该包括溶液的配制系统、溶液输送管线和称量原材料使用的工器具等,清洁验证通常包括设备的评估、清洗操作规程的评估和清洁标识物的选择与残留限度的计算。
(3)在线灭菌验证
在线灭菌使用的是饱和蒸汽灭菌,采用设置在管线上固定位置的热电阻来进行控制和监测。在线灭菌过程中,纯蒸汽的影响最大,当纯蒸汽压力不够、纯度不够或者流量不够时会导致在线灭菌过程某点或者几个监测点的温度达不到设定值或者在设定值上下波动,影响结果。
(4)过滤器验证
在吹灌封无菌工艺中会使用产品过滤器和空气过滤器,当然某些产品(例如混悬液)可能不会使用产品过滤器。过滤器的验证包括过滤器性能确认和过滤工艺验证两部分,主要测试项目有微生物截留测试、可提取物、与产品的相容性、产品吸附、完整性测试等。
(5)容器密封性验证
在吹灌封无菌工艺中,容器的封口是自动完成的,容器在灌封完成后立刻由头模进行密封。在封口不严的情况下,采用常规的真空检漏法很容易检测出来,但是极其细小的孔隙,常规方法很难检出。通常采用微生物侵入法验证容器的密封性能。
(6)吹灌封无菌工艺的合格条件
对于一项无菌生产工艺,最终的判断方法就是通过培养基模拟灌装试验,吹灌封无菌工艺也不例外,虽然它被证明具有良好的无菌保障能力,但是每个项目的生产环境、生产条件、人员等并不是完全一样的,而且在 2010 版 GMP 附录一无菌药品中也规定了所有无菌工艺必须通过培养基模拟灌装试验。
3、结语
BFS工艺是一种与技术、法规、设备配套的技术成熟的无菌灌装工艺,是目前最好的无菌灌装工艺。采用BFS无菌灌装工艺生产无菌药品不仅会规范无菌药品的生产包装形式,还会改善我国无菌药品生产设备和技术落后、产品开发困难的被动局面,缩短与制药强国在无菌药品生产中的差距,为人类的健康事业提供安全有效的产品。