您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-01-30 19:20
本文适用于与内窥镜配合使用,通过口鼻进入胆管,用于胆汁引流的经鼻胆汁外引流管,属于一次性使用无菌产品。
一、经鼻胆汁外引流管的结构组成
经鼻胆汁外引流管由管体和接头组成,有的根据需要配有鼻转换管、连接管或三通阀、矫直管等,鼻转换管用于将引流管进行口鼻转换,连接管或三通阀起连接引流管和引流袋作用,矫直管用于矫直产品,方便产品进入内窥镜。
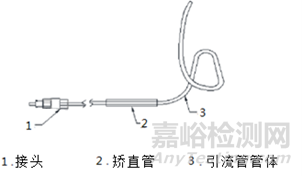
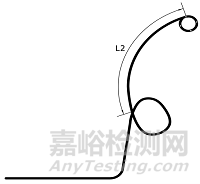
图1结构示意图
管体所用材料常见的为聚乙烯。典型引流管产品的结构示意图如图1所示,各部件图示如图2所示。各个组件的结构示意图不代表固定的结构设计,仅用于增加感性认识。
α形引流管(右α形) 逆α形引流管(左α形)
猪尾α形引流管
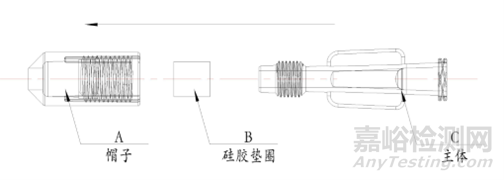
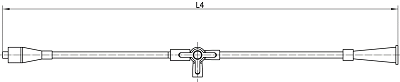
引流管接头(接头由帽子、硅胶垫圈和主体组成)

鼻转换管
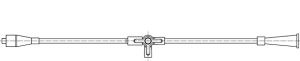
连接管
图2 引流管各部件图示
二、经鼻胆汁外引流管主要风险
经鼻胆汁外引流管主要的风险包括生物学危害、信息危害、人为因素产生的危害、操作危害、功能危害、机械能危害、失效产生的危害等,具体危害如下:
表1 产品主要危害
|
危害分类 |
危害形成的因素 |
可能的后果 |
|
|---|---|---|---|
|
生物学危害 |
再次或交叉 感染 |
一次性使用的产品被再次使用。 |
引起感染、交叉感染 |
|
添加剂或加工助剂 |
在产品中引入的助剂,如使用未经过生物安全性评价的硅油、粘合剂或增塑剂等; 未按照工艺要求配料,添加剂或助剂使用比例不正确。 |
对人体产生潜在的危害 |
|
|
生物 污染 |
生产环境污染产品,如外来的纤维、粉尘、细菌等其他杂质; 产品原材料受到污染; 灭菌操作不严格; 包装破损; 使用时操作不正规; 残留物过多。 |
产品带菌、热原,引起患者感染 |
|
|
生物不相容性 |
与患者接触材料的化学成分的毒性 |
引起细胞毒性、迟发致敏反应、皮肤刺激反应等。 |
|
|
信息 危害 |
标记 |
不完整的产品使用说明书; 对产品性能特征不恰当地描述; 不恰当地对产品预期的使用规范; 对产品注意事项的限制未充分公示。 |
产品对人体产生危害 |
|
操作说明书 |
产品过于复杂的操作说明; 警告不明确; 副作用的警告不明显或叙述不清; 没有一次性使用医疗器械可能再次使用时会产生危害的警告。 |
对人体产生副作用或引发其他伤害 |
|
|
不完整的要求产生的危害 |
对参数的不恰当规范 |
产品的设计参数不恰当; 产品性能的要求不全面; 未提及产品的货架有效期或不规范。 |
产生无效治疗或发生副作用 |
|
人为因素产生的危害 |
显示信息与实际状态不对应 |
由缺乏技术的/未经培训的人员使用。 |
对操作者和患者均产生不必要的危害 |
|
操作 危害 |
使用错误 |
和配套的医疗器械一起使用时不适当; 操作者未经过培训或未按照说明书作业导致伤害病人或操作者; 使用错误的型号规格。 |
对人体产生危害 |
|
功能危害 |
无法通过钳道 |
产品规格选择错误;引流管外径超出内窥镜内径;操作方法错误 |
对人体产生危害 |
|
无法进行引流 |
产品泄露; 引流管被封堵不通畅;引流管溢出孔被封堵无法引流; |
||
|
机械能危害 |
零部件脱落 |
外引流管与基座脱离,连接力不足;显影环脱落 |
对人体产生危害 |
|
外引流管断裂 |
产品易打折;产品断裂强度低; 钻孔撕裂导致断裂 |
||
|
失效产生的危害 |
功能 退化 |
由于老化、重复使用、使用过程中产品破裂而导致功能退化。 |
产生无效的治疗,延误患者病情。 |
|
功能性失效引起的危害 |
造成病人损伤 |
引流导管表面太粗糙。 导管端部边缘锋利。 导管强度不够。 导管塑形形状不合理 产品引流通畅性差。 导管显影性差。 导管的形状恢复差 |
对乳头和胆道壁造成刺激或损伤。 对乳头和胆道壁造成刺激或损伤。 受到人体运动和胃肠道蠕动压迫,导管损伤甚至断裂,对病人造成损伤 导管形状不贴合人体自然腔道,置入后对人体造成损伤影响胆汁的引流效果,影响病人的康复效果。 操作无法辨识导管,影响插入和释放操作,延长手术操作时间。 导管放置后,无法恢复原本的形态,无法贴合人体自然腔道,导致腔道损伤。 |
|
损坏配套内窥镜器械 |
引流导管表面太粗糙。 引流导管偏硬,抬钳器无法抬起。 |
损坏内窥镜钳道。 损坏内窥镜抬钳器。 |
|
三、经鼻胆汁外引流管性能研究实验要求
1、经鼻胆汁外引流管性能的技术指标主要包括:
1.1形状尺寸要求
1.1.1外观:引流管(尤其是头端)的相关要求。
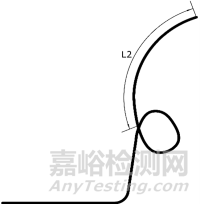
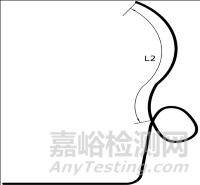
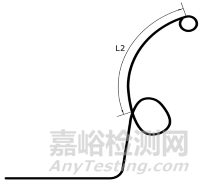
1.1.2尺寸及形状:引流管的外径、内径、总长度、远端长度(L2)、固定圈形状;经鼻管的外径和长度。
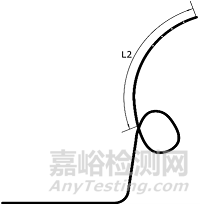
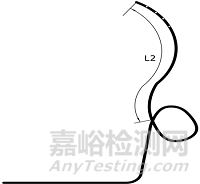
α形引流管(右α形) 逆α形引流管(左α形)
猪尾a形引流管

鼻转换管
连接管
图3 一次性鼻胆引流管结构示意图
1.2物理性能:
1.2.1射线可探测性(如适用)
如果开发标示射线可探测,应能开展相应的试验证明。
1.2.2抗弯曲性
引流管的管体在弯曲状态下是否可靠支撑引流的完成。
1.2.3抗变形(适用于连接负压泵的产品)
预期在负压使用下的任何组件,在规定的最大负压下应无明显影响其功能的变形。
1.2.4无泄漏
引流管或任何组件在规定的最大负压下应无泄漏。
1.2.5断裂力
1.2.5.1连接器
连接器的定义参照GB/T 15812.1《非血管内导管第1部分:一般性能试验方法》附录F的规定:即按照规定的说明,需要装配的连接器。
连接器的最小断裂力建议不低于YY 0489《一次性使用无菌引流导管及辅助器械》的相关规定,否则应开展充分的验证证明产品的安全有效性。
1.2.5.2引流导管和其他组件部分
引流导管和其他组件部分的定义参照GB/T 15812.1《非血管内导管第1部分:一般性能试验方法》附录B的规定:即产品中各管状部分、各座或连接器与管路的各连接处、以及不同管路的各连接处。
引流导管和其他组件部分的最小断裂力建议不低于YY 0489《一次性使用无菌引流导管及辅助器械》的相关规定,否则应开展充分的验证证明产品的安全有效性。
1.2.6流量
按照GB/T 15812.1《非血管内导管第1部分:一般性能试验方法》附录E进行试验。
1.2.7鲁尔接头(若适用)
应符合GB/T 1962.1《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求》、GB/T 1962.2《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头》的要求。
1.2.8配合性能(若适用)
引流管与鼻转换管的配合性能应予以要求。
1.2.9导丝通畅性
从外引流管远端插入导丝(导丝直径由企业制订),导丝在引流管内应穿行顺滑,无明显阻滞现象。
1.3化学指标
1.3.1环氧乙烷残留量
1.3.2根据不同材料特性,参照GB/T 14233.1《医用输液、输血、注射器具检验方法第1部分:化学分析方法》,由开发人决定对化学性能提出要求项目,至少应包括还原物质、酸碱度、重金属总含量、蒸发残渣。
1.4无菌性能:以灭菌包装提供的产品应无菌。
2、产品性能研究
应当开展产品性能研究以及产品技术要求的研究,明确功能性、安全性指标以及与质量控制相关的其他指标的确定依据,明确所采用的标准或方法,采用的原因及理论基础。
虽然目前还没有完全适用的国家标准和行业标准,但是可以参照类似产品和相关产品的国家标准和行业标准,并结合实际使用情况制订相应的产品技术指标。例如各性能指标的制订可参考YY 0489《一次性使用无菌引流导管及辅助器械》,外径小于2mm的导管虽然不在该标准的范围内,亦可参考。
建议开展模拟胆汁下,引流管抗断裂力(尤其是远端打孔处)、疲劳性能研究。
3、生物相容性评价研究
应评价预期插入患者体内引流液体的引流导管和引流系统的其他任何组件的生物相容性,应无生物学危害。
产品生物相容性评价应依据GB/T 16886系列标准进行评价,必要时进行生物相容性试验。
通常产品组件与患者人体黏膜长期接触,直接接触的部位采用医用高分子材料制成。
实施或豁免生物学试验的理由和论证可参照《医疗器械生物学评价和审查指南》中相关要求。
4、灭菌工艺研究
应明确灭菌工艺(方法和参数)及其选择依据和无菌保证水平(SAL),并进行灭菌确认。如:
对于经环氧乙烷灭菌的产品,需开展灭菌结果确认和过程控制,具体可参照GB 18279系列标准。
残留毒性:若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当开展研究明确残留物信息及处理方法。
5、稳定性研究
5.1货架有效期
应开展产品有效期研究,产品有效期研究可采用加速老化或实时老化的研究,加速老化研究可参考YY/T 0681.1《无菌医疗器械包装试验方法第1部分:加速老化试验指南》。
5.2运输稳定性
应开展包装研究,依据有关国内、国际标准进行(如GB/T 19633.1、GB/T 19633.2、ISO 11607、ASTM F2475、ASTM D4169、ISTA 2A:2011等)对包装进行分析研究和评价。直接接触产品的包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适应性。
应当开展运输稳定性和包装研究,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
6、其他研究
该产品列入《免于进行临床评价的医疗器械产品目录》,开发人应当按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》的要求,开展相关研究,从基本原理、结构组成、性能、安全性、适用范围等方面,证明产品的安全有效性。
对于一次性使用的医疗器械,还应当开展证明其无法重复使用的支持性研究。

来源:嘉峪检测网


